Какими способами можно собирать водород в пробирку на каких свойствах

Тема: Вещества и их превращения
Урок: Получение водорода и изучение его свойств
1. Получение водорода и проверка его на чистоту
Водород можно получить при взаимодействии цинка и соляной кислоты.
Zn + 2HCl = ZnCl2 + H2↑
Цинк вытесняет водород из кислот, как и все металлы, стоящие в ряду напряжений левее водорода.
Чтобы собрать водород в пробирку, нужно перевернуть ее вверх дном, потому что водород – легче воздуха и стремится вверх. Такой метод собирания водорода называется «методом вытеснения воздуха».
Рис. 1. Получение водорода и собирание его методом вытеснения воздуха
В пробирке накапливается водород, но в ней также есть и воздух, а значит и кислород. Водород и кислород – взрывоопасная смесь. Поджигаем лучинкой собранный водород. Пробирка невелика, и взрыв водорода и кислорода – просто резкий хлопок. Чем меньше кислорода в смеси, тем тише хлопок.
Если собранный в пробирке водород – чистый, то мы услышим глухой хлопок. Такой водород можно поджигать.
2. Горение водорода
Водород, значит, рождающий воду. Вода получается при горении водорода — при соединении водорода с кислородом. В ходе реакции выделяется очень большое количество энергии.
2H2 + O2 = 2H2O + Q
Значит, водород можно использовать в качестве топлива. И как со всяким топливом с водородом нужно обращаться осторожно.
Получаем водород реакцией цинка с соляной кислотой.
Поджигаем водород у конца газоотводной трубки. Вначале пламя едва заметно (водород не окрашивает пламя). Постепенно стеклянная трубка раскаляется, и пламя становится желтым: соединения натрия, входящие в состав стекла окрашивают пламя.
Рис. 2. Горение водорода
Итак, водород – топливо. На водороде и кислороде могут работать реактивные двигатели. Теплоту реакции горения водорода используют для сварки и резки металлов. При сгорании водорода в чистом кислороде температура достигает 2800оС. Такое пламя плавит кварц и большинство металлов. Важно, что водород – безвредное для окружающей среды топливо, т.к. продуктом его горения является вода.
3. Восстановление меди водородом из ее оксида
Водород – прекрасный восстановитель. Водород способен восстанавливать некоторые металлы из их оксидов. Проведем реакцию восстановления меди из оксида меди(II).
В пробирке – черный порошок оксида меди(II). Получаем водород взаимодействием цинка и соляной кислоты.
Zn + 2HCl = ZnCl2 + H2↑
Направим водород в пробирку. Реакция восстановления меди идет при нагревании:
CuO + H2 = Cu + H2O
Водород связывает кислород, образуя воду, выделяется свободная медь красного цвета.
Реакция водорода с оксидом меди(II) относится к типу замещения.
Рис. 3. Восстановление меди водородом из оксида меди(II)
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.85-88)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 78-80)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2013. (с.146-148)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (с.139-141)
5. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§27)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Взрыв гремучего газа (Источник).
2. Восстановление меди из оксида меди (II) (Источник).
3. Горение водорода (Источник).
4. Мыльные пузыри с водородом (Источник)
5. Получение, свойства и применение водорода (Источник).
Домашнее задание
1. с. 80 № 7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2. с.145-146 №№ 7, 8 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
Урок 31 Класс 8 —
Тема: Практическая работа № 4 Получение водорода и исследование его свойств.
Дата ____________20
МБОУ «С(К)ОШ №16», учитель химии Березинская А.А.
Цель:
совершенствовать экспериментальные умения — приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетрад;
работа над развитием навыков умелого обращения с огнем, опасными веществами.
умение составлять уравнения химических реакций, умение делать выводы, соблюдать правила техники безопасности;
расширение кругозора обучающихся, формирование уважения к истории науки.
развитие представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное поведение».
Коррекционные цели: коррекция и развитие связной устной и письменной речи, коррекция и развитие моторной памяти, развитие умений делать выводы.
Оборудование:
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
спиртовка, спички
автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
Реактивы:
гранулы цинка, соляная кислота (разб.), оксид меди (II).
Тип урока: урок- практикум (виртуальная лаборатория)
Правила техники безопасности: Работа со спиртовкой; работа со стеклом; Проверка прибора на герметичность.
Ход работы:
I. Подготовка к проведению практической работы.
Инструктаж по технике безопасности при работе с сухим горючим.
Технический инструктаж о проведении практической работы.
II. Актуализация знаний
Какие исходные вещества будем использовать мы для получения водорода?
Необходимо ли нагревать реакционную смесь?
На что обратить внимание при записи наблюдений?
Какой прибор будем использовать для получения водорода?
Какими способами можно собрать водород, почему?
Знакомство с инструкцией: учебник стр. ________
III. Проведение практической работы (просмотр видео: Получение водорода.)
III. Закрепление знаний, умений, навыков.
После проведения работы сделать вывод, записать все результаты в тетрадь.
Домашнее задание: § ________.
Практическая работа № 4.Получение водорода и исследование его свойств.
С правилами ТБ ознакомлен (а)
Цель: научиться получать, собирать водород; изучить физические и химические свойства водорода.
Оборудование:
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага,спиртовка, спички, автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой.
Реактивы: гранулы цинка, соляная кислота (разб.), оксид меди (II).
Ход работы
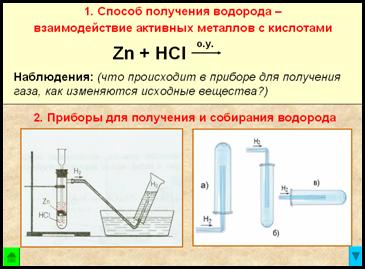
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q — при обычных условиях
Наблюдения:
реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
из газоотводной трубки выделяется бесцветный газ
при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода

Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
Наблюдения:
при сжигании первой порции газа раздается резкий лающий звук
при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
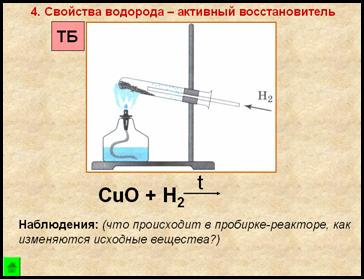
4. Свойство водорода – активный восстановитель
Наблюдения:
порошок меняет цвет с черного на медный
на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разбавленной соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
3
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения — приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда — халат
- Наполняемость лабораторного лотка для ученика (13 шт.)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.
- Проблемно-поисковый.
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:

На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:
Ознакомление с планом урока. I.

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:

Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой

Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы

1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
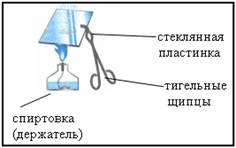
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
Что наблюдается?
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI. Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q — при обычных условиях
Наблюдения:
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
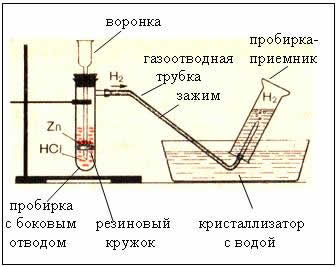
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
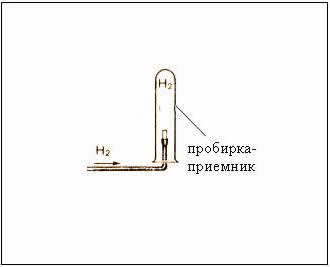
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
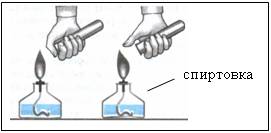
Наблюдения:
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
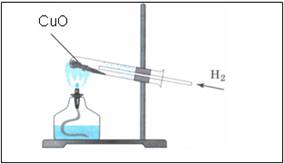
Наблюдения:
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
