Какими физическими свойствами характеризуются вещества с ионными

Ken Ba · 12 декабря 2018
2,8 K
- Такие соединения очень прочные, с энергией 300-700 кДж
- Связи в таких соединениях ненаправленные и ненасыщенные
- В процессе образования молекул с ионной связью не происходит полной передачи электронов, поэтому стопроцентной ионной связи в природе не существует.
- Такие соединения твердые кристаллические вещества с высокой температурой плавления и кипения
- Большая часть таких соединений растворяется в воде, а их растворы проводят электрический ток
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????Что такое ионная связь?????
Это связь,которая образуется между катионами и анионами за счёт их притяжения
????Свойства соединений с ионной связью????
✅Прочная связь( энергия ионной связи равна примерно 300-700кДж/моль)
✅Ионные соединения растворяются в воде
✅На самом деле ,чистой ионной связи не существует(соединения имеют несколько видов связей)
✅Расплавы и растворы с… Читать далее
Какие связи формируются в комплексном соединении?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
☘️Что такое комплексное соединение?
Это сложная химическая частица)
Давайте разберёмся с её строением????
????У комплексного соединения есть внешняя и внутренняя сфера
????Во внутренней сфере лежит комплексообразователь (катион металла) и лиганд (это всё остальное кроме металла ????)
⚠️Между линандом и комплексообразователем связи по донорно-акцепторному механизму
У катиона металла есть свободные атомные орбитали, а у лиганда лишние электроны, которыми он с удовольствием делится????так и получается связь
Почему электроотрицательность фтора больше, чем электроотрицательность неона?
Если говорить простыми словами, то электроотрицательность — это способность атомов оттягивать к себе электроны других атомов. Считается, что самый электроотрицательный элемент — фтор. Об электроотрицательности расположенного правее от него неона говорить не приходится, так как этот элемент в обычных условиях не может вступать в химическую реакцию, у него завершён второй внешний слой — 8 электронов, т.е. отсутствуют вакантные орбитали как и у остальных инертных газов, исходя из квантовых представлений. Поэтому, когда говорят о самой высокой электроотрицательности фтора, имеют в виду, что среди всех элементов он — сильнейший окислитель.
Что представляют собой комплексные соли? В чем обоснование их механизма образования?
ALBA synchrotron, postdoc
Как нам подсказывает капитан очевидность, комплексные соли — это соли, содержащие хотя бы один комплексный ион. А вот хорошего определения комплексных ионов мне не попадалось. Давайте для начала не будем лезть в тонкости и пограничные ситуации и назовём комплексными ионами те, в которых есть некий центральный атом, окруженный некими частицами по имени лиганды, причём вокруг центрального атома упаковано больше электронных пар, чем его формальная степень окисления.
Отсюда сразу понятно, каков механизм образования комплексов. Металлы, особенно переходные, содержат кучу легкодоступных вакантных орбиталей. И наоборот, частицы (как нейтральные молекулы, так и ионы), построенные на основе элементов 5-7 групп почти всегда содержат хотя бы одну неподеленную электронную пару. Это значит, что между ними может возникнуть донорно-акцепторное взаимодействие. Дальше вопрос в силе этого взаимодействия и наличии свободного места вокруг нашего металла. Обычно оптимальный баланс возникает при 4 или 6 лигандах, хотя возможны варианты.
Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью
Студент Massachusetts Institute of Technology, получил приглашения от Harvard… · ischemist.ru/blog
Немного уточню.
Водородная связь образуется между атомами водорода, которые связаны с электроотрицательными атомами, а значит несут на себе частично положительный зарят (δ+) и атомами с неподеленной электронной парой. Последними, как правило, являются электроотрицательные атомы.
При этом, стоит заметить, что у атомов водорода электроны находятся на 1s орбитали. Для образования прочного взаимодействия с неподеленными электронными парами на других атомах, эти самые пары должны находиться на орбиталях со схожей геометрией. Иными словами, если мы возьмем элементы третьего и ниже периодов, у которых пары сидят на 3p орбиталях, например, разница в размере между 3p и 1s настолько велика, что водородная связь образовываться не будет.
Таким образом, водородная связь может образовываться между а) атомами водорода с δ+ и б) атомами N, O, F.
Прочитать ещё 1 ответ
Какие факторы определяют электропроводимость вещества?
Инженер, немного пилот. Физик, химик, электронщик-любитель. Независимый звукореж…
Электропроводность вещества определяется наличием свободных (то есть, способных перемещаться) носителей зарядов. В металлах это электроны, свободно перемещающиеся между атомами кристаллической решётки, в полупроводниках — электроны и «дырки» (гипотетический носитель положительного заряда, отсутствие электрона на атомной орбитали, может «перепрыгивать» с одного атома на другой), в растворах и расплавах электролитов — ионы. Кроме того, в вакууме, который, как известно, не вещество, тоже возможен электрический ток, если есть свободные электроны (в электронной лампе, например).
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Химическая связь подразделяется на
Внутримолекулярные
Межмолекулярные
Характеристики химической связи
Длина связи – расстояние между ядрами атомов в молекуле; зависит от количества электронных уровней у каждого элемента.
Энергия связи — энергия, затрачиваемая на разрушение связи. Чем больше длина связи, тем меньше энергия.
Полярность молекулы определяется разностью электроотрицательностей атомов. Чем больше разность электроотрицательностей, тем больше полярность связи.
Ковалентная неполярная связь
Образуют атомы с одинаковой электроотрицательностью, чаще атомы одного и того же химического элемента (неметалла).Например:Cl2.Как образуется ковалентная неполярная связь?
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Ковалентная полярная связь
Образуют атомы неметаллов с разной электроотрицательностью. Пример:HCl.
Ионная связь
Образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности.
Пример: NaCl Как образуется ионная связь?
!!!!!Обрати внимание: существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи. Например, NaOH, KNO3.
Металлическая связь
Образуется в металлах или сплавах.
Примеры: Fe
Как образуется металлическая связь?
Атомы металлов слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. Эти электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь
Связь между атомами водорода одной молекулы и сильно электроотрицательными элементами (O, N, F) другой молекулы.
Ван-Дер-Ваальсова связь
Это силы притяжения между молекулами.
Что такое кристаллическая решетка?
Это каркас вещества, который получится, если частицы вещества соединить линиями.
Ионная кристаллическая решетка
Ионными называют решётки, в узлах которых находятся ИОНЫ.
Свойства веществ с ионными кристаллическими решетками:
1) все вещества при обычных условиях твердые
2) хрупкие
3) имеют высокие температуры кипения и плавления
4) нелетучесть
5) многие растворимы в воде
6) расплавы и растворы проводят электрический ток
Металлические кристаллические решетки
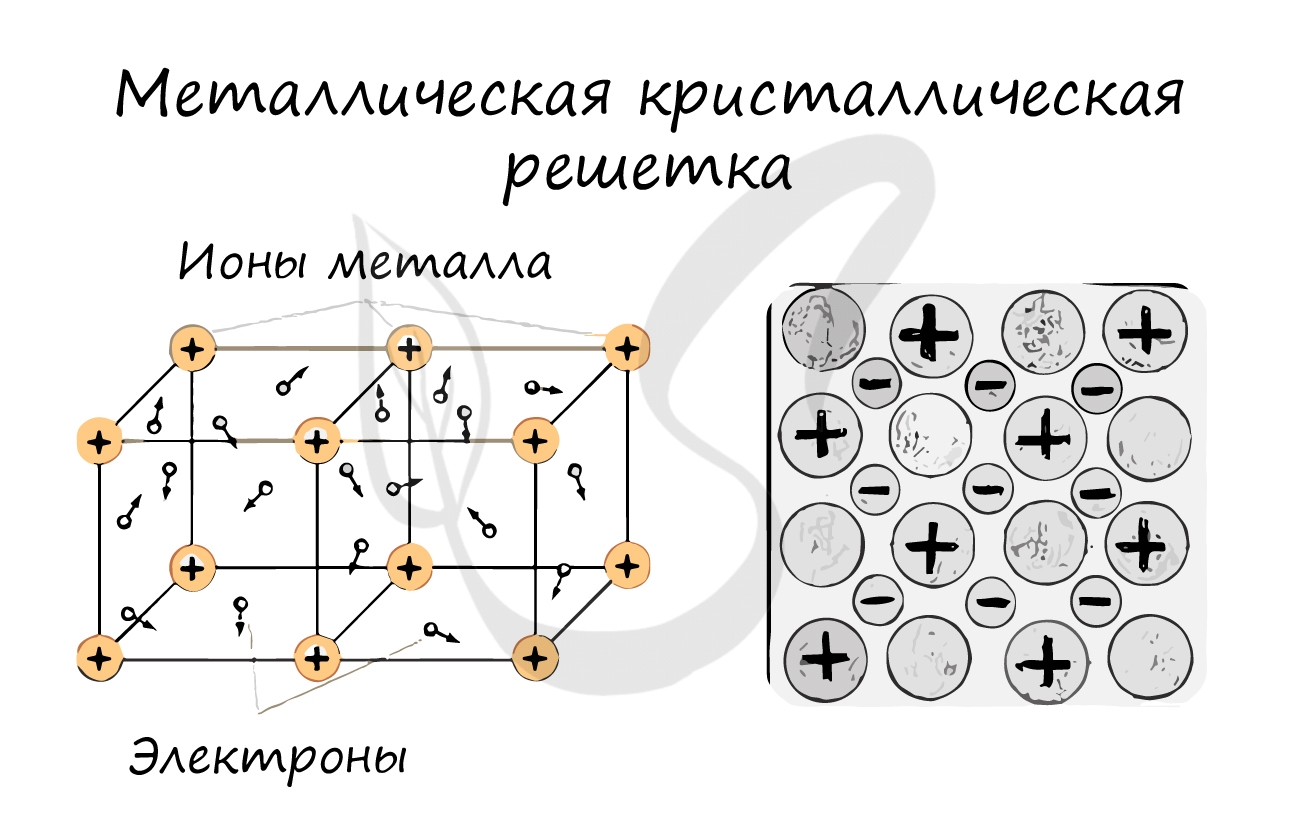
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Свойства веществ с металлическими кристаллическими решетками
1)Твердость
2)Электро- и теплопроводность
3)Металлический блеск
4)Ковкость, пластичность
Атомная кристаллическая решетка
Это кристаллические решётки, в узлах которых находятся отдельные атомы, соединенные ковалентными связями.
Свойства веществ с атомными решетками:
1) очень высокая твердость, прочность
2) очень высокая Тпл (алмаз 3500°С)
3) тугоплавкость
4) практически нерастворимы
5) нелетучесть
Примеры веществ атомного строения: углерод,алмаз, бор, оксид кремния.
Молекулярные кристаллические решетки
Это решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Примеры веществ: газы, органические вещества, вода.
Свойства веществ с молекулярными решетками:
1) малая твердость, прочность
2) низкие Тпл и Ткип
3) при комнатной температуре обычно жидкости или газы
4) высокая летучесть
5) растворы и расплавы проводят электрический ток
Взаимосвязь
типа химической связи с видом кристаллической решеткиВещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще
всего имеют кристаллическое строение).Кристаллическое строение характеризуется
правильным расположением частиц в определенных точках пространства. При
соединении этих точек воображаемыми прямыми линиями образуется так называемая
кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.В узлах кристаллической решетки могут
находиться ионы, атомы или молекулы.В зависимости от вида частиц,
расположенных в узлах кристаллической решетки, и характера связи между ними
различают четыре типа кристаллических решеток:
·
ионные,·
атомные,·
молекулярные и·
металлические.Ионная решетка
Эту решетку образуют все вещества с
ионным типом связи — соли, щелочи, бинарные соединения активных металлов с
активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты,
соли аммония и аминов. В узлах решетки — ионы, между которыми существует
электростатическое притяжение. Ионная связь очень прочная.Примеры:
КОН, СаСО3, СН3СООК, NH4NO3, [CH3NH3]Cl,
С2Н5ОК.Свойства ионных кристаллов:
· твердые, но хрупкие;
· отличаются высокими температурами
плавления;· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают
электропроводностью;· многие растворимы в воде; при растворении
в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят
электрический ток.Металлическая решетка
Характерна для веществ с металлической
связью. Реализуется в простых веществах — металлах и их сплавах. В узлах
решетки — атомы и катионы металла, при этом электроны металла обобществляются и
образуют так называемый электронный газ, который движется между узлами решетки,
обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и
обусловлены свойства веществ с
металлической решеткой:·
тепло- и электропроводность;·
обладают металлическим блеском;·
высокие температуры плавления.Атомная решетка
В узлах решетки — атомы, связанные
ковалентными связями. Химическая связь — ковалентная полярная или неполярная.
Атомная кристаллическая решетка характерна для углерода (алмаз, графит),
бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц,
речной песок), карбида кремния SiC (карборунд), нитрида бора BN.Свойства веществ с атомной решеткой:
·
высокая твердость;·
высокие температуры плавления;·
нерастворимость;·
нелетучесть;·
отсутствие запаха.Молекулярная решетка
В узлах — молекулы веществ, которые
удерживаются в решетке с помощью слабых межмолекулярных сил.Молекулярное
строение имеют:o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах
которых ковалентные связи (полярные и неполярные).Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и
свойства веществ
Тип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная
Ионы
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем.
металловТвердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в
воде, расплавы проводят электрический токАтомная
Атомы
1. Ковалентная неполярная -очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния
(IV) SiO2Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Молекулярная
Молекулы
Между молекулами — слабые силы межмолекулярного притяжения, внутри
молекул — прочная ковалентная связьПри обычных условиях — газы, жидкости или летучие твердые вещества:
(О2,Н2,Cl2,N2,Br2,
H2O, CO2, HCl); сера, белый фосфор, йод; органические
веществаНепрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую
твердостьМеталлическая
Атом-ионы
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
источник информации: https://foxford.ru/wiki/himiya/vzaimosvyaz-tipa-himicheskoy-svyazi-s-vidom-kristallicheskoy-reshetki
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 октября 2016;
проверки требуют 26 правок.
Атомы натрия и фтора подвергающиеся окислительно-восстановительной реакции с образованием фторида натрия. Натрий теряет свой внешний электрон, приобретая стабильную электронную конфигурацию, и этот электрон переходит в атом фтора. Противоположно заряженные ионы притягиваются друг к другу с образованием стабильного соединения.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1,7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью.
Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы, окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион — катион (в переводе с греческого — «идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы — анионы (от греческого «анион» — идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь — это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Пример образования ионной связи[править | править код]
Рассмотрим способ образования на примере «хлорида натрия» NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: и . Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Схематично это можно записать так:
— ион натрия, устойчивая восьмиэлектронная оболочка () за счет второго энергетического уровня. — ион хлора, устойчивая восьмиэлектронная оболочка.
Между ионами и возникают силы электростатического притяжения, в результате чего образуется соединение.
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
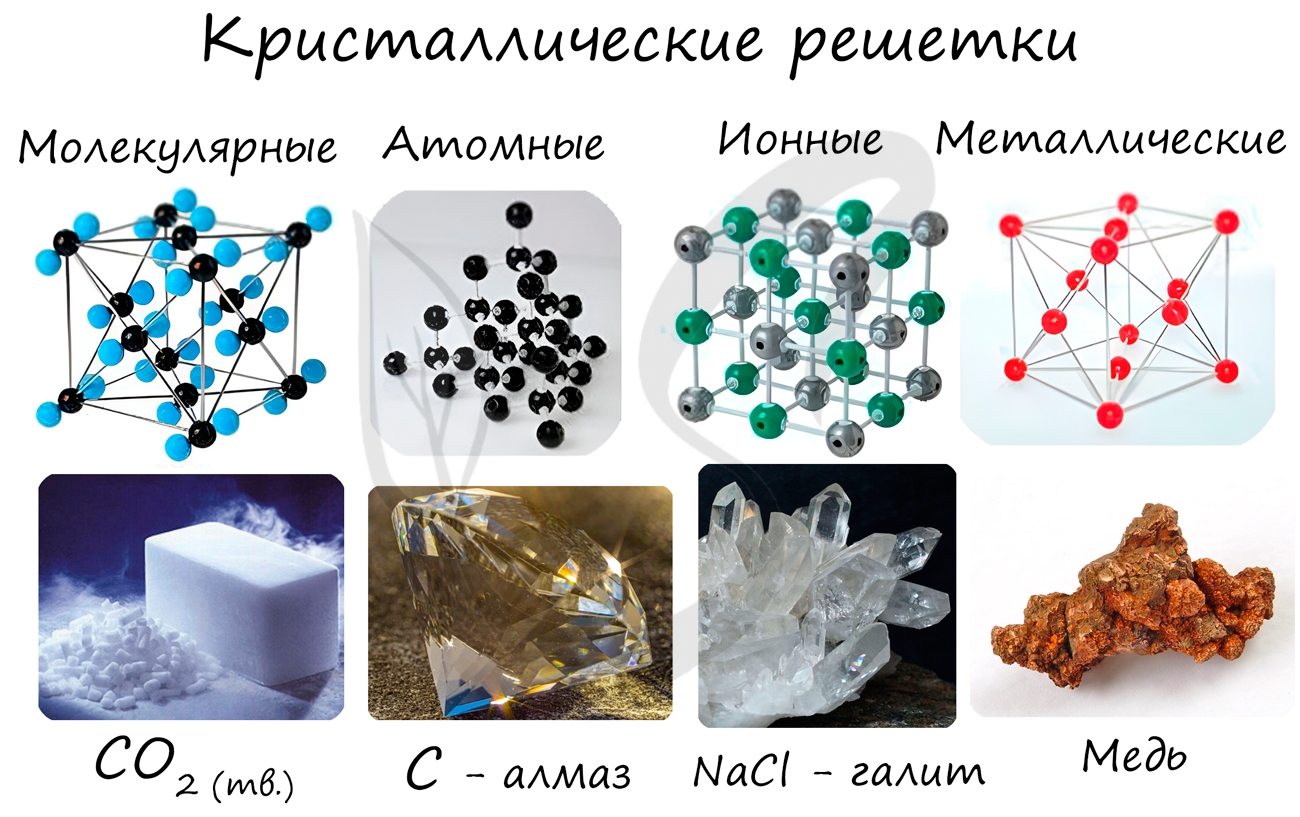
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
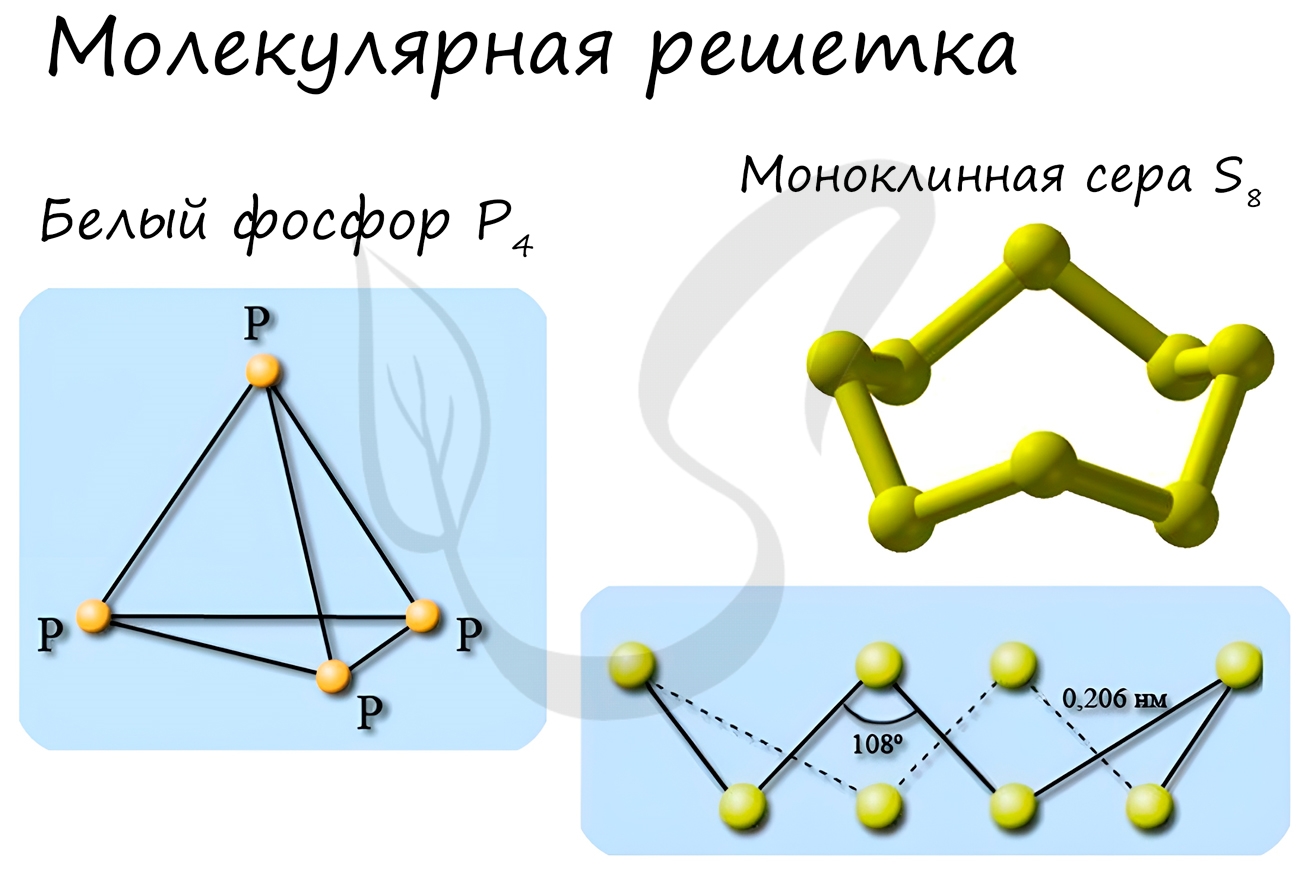
Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.

