Какими физическими свойствами характеризуются вещества с ионной кристаллической решеткой
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
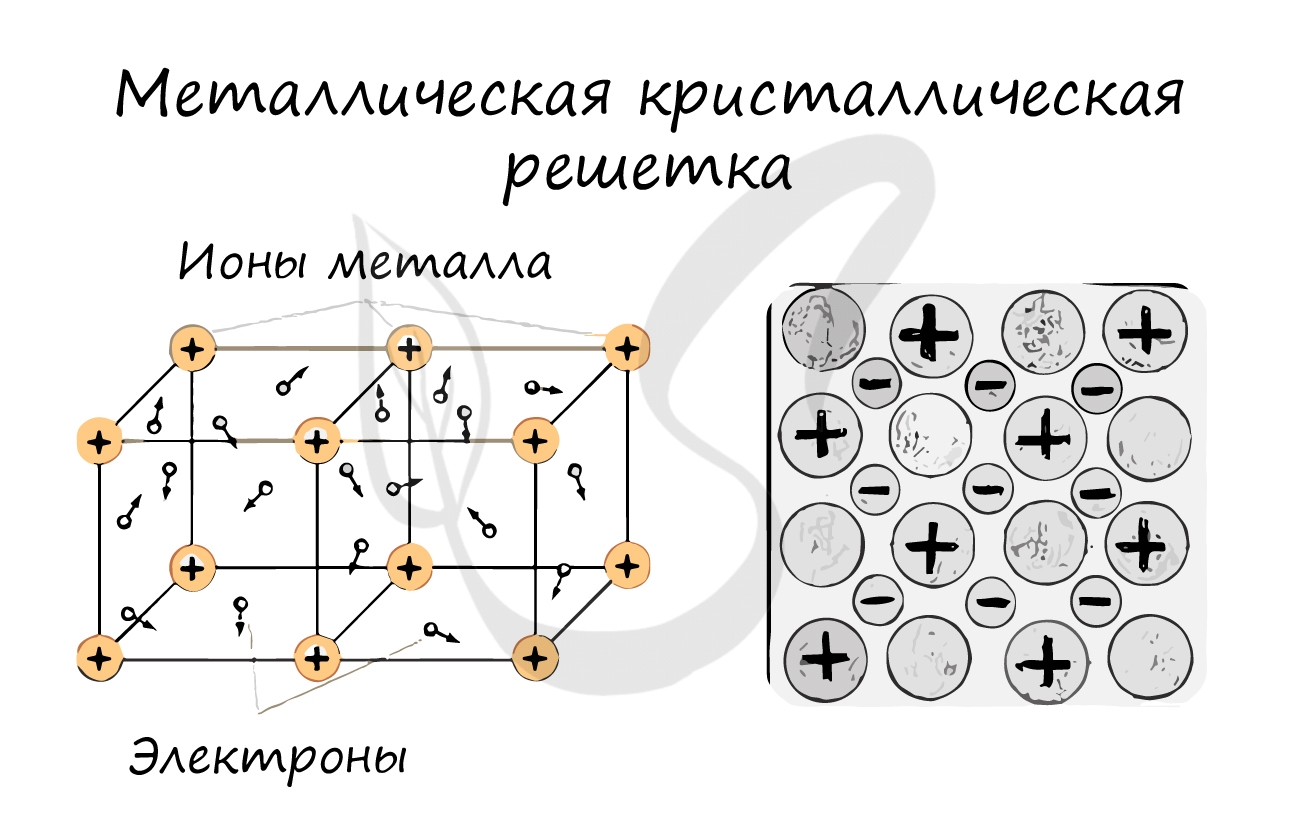
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
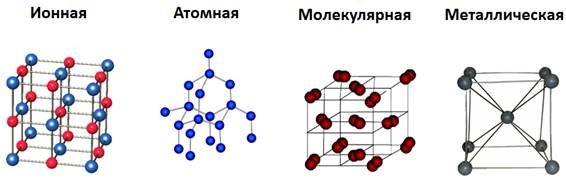
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле .
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n — большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных) , называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
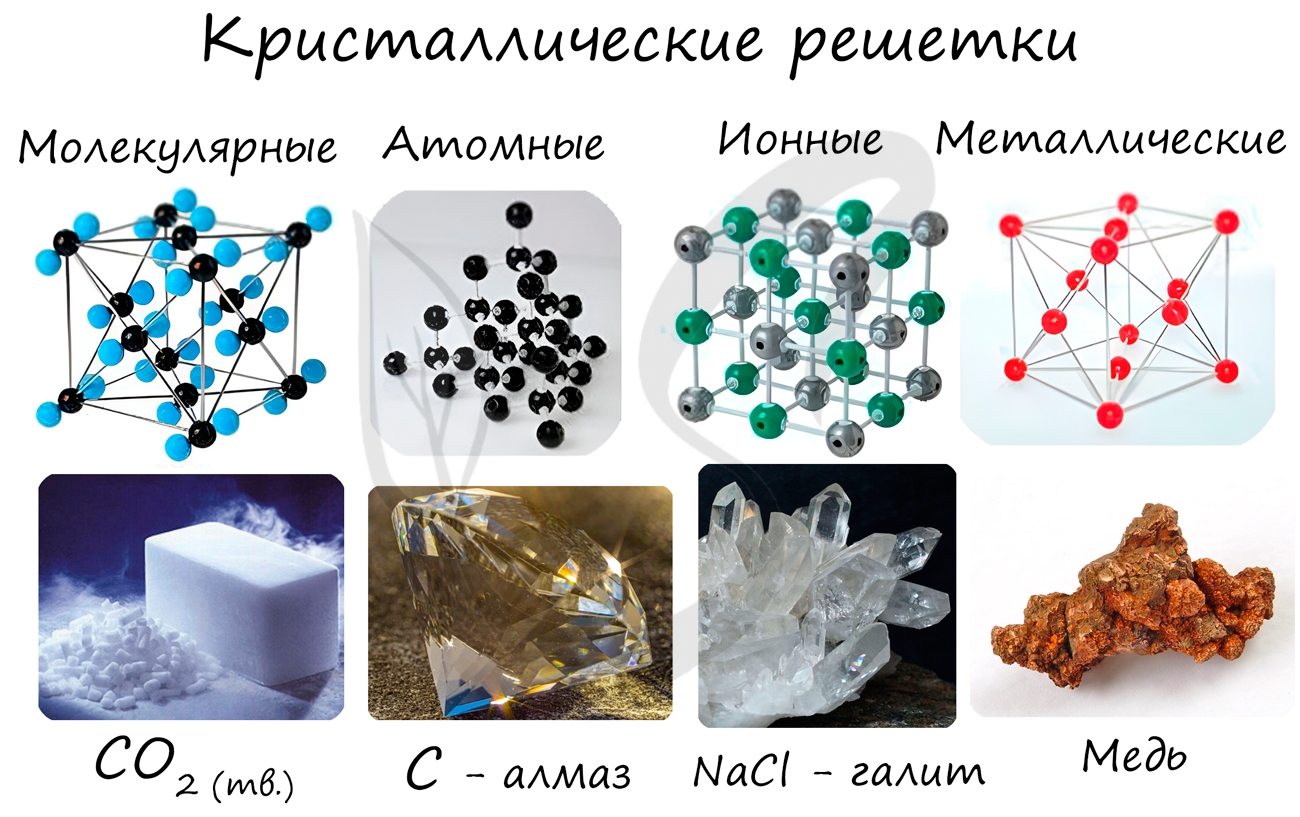
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
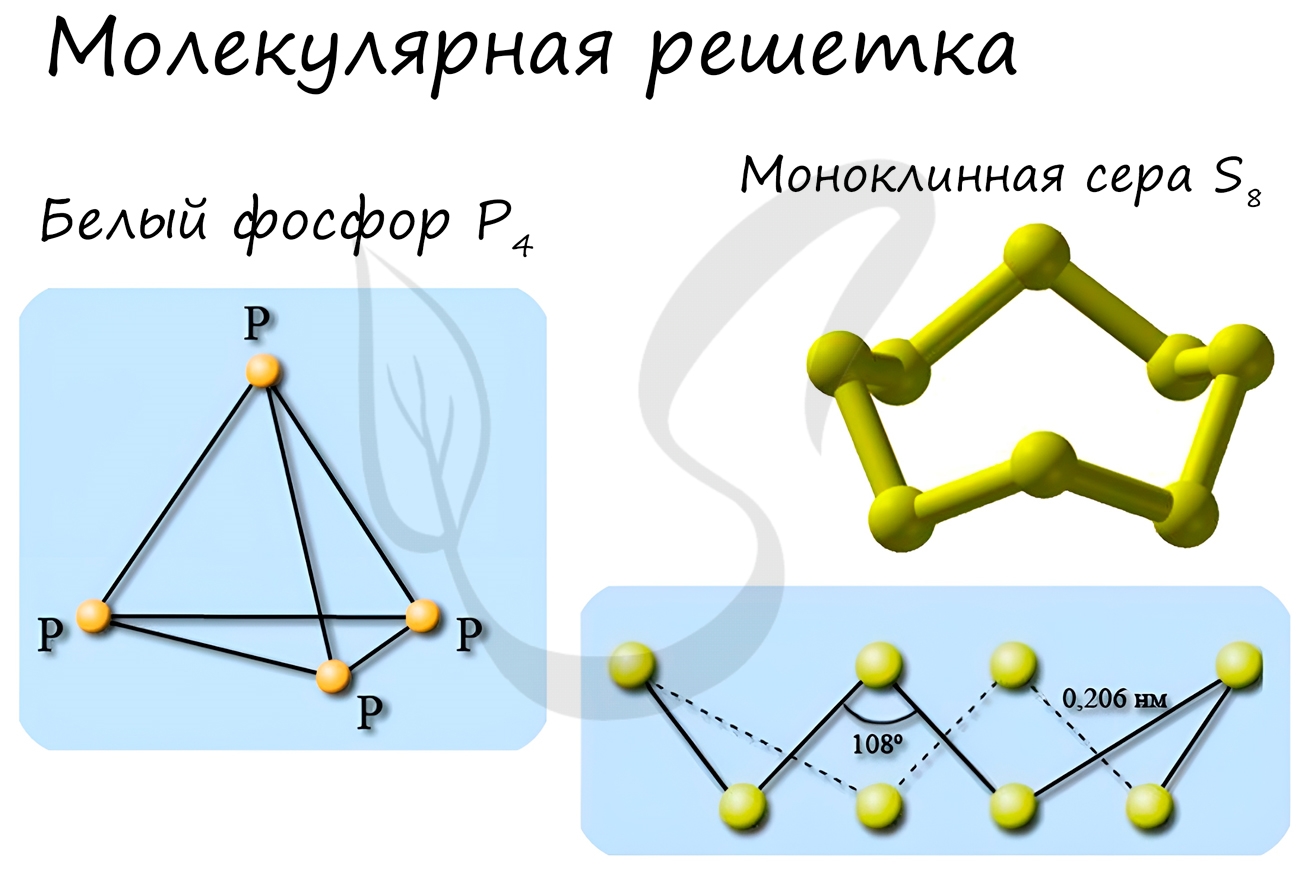
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.

Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Вещества с ионной кристаллической решеткой обладают следующими свойствами:
1. Относительно высокой твердостью и прочностю;
2. Хрупкостью;
3. Термостойкостью;
4. Тугоплавкостью;
5. Нелетучестью.
Примеры: соли – хлорид натрия, карбонат калия, основания – гидрооксид кальция, гидрооксид натрия.
4. Механизм образования ковалентной связи (обменный и донорно-акцепторный).
Каждый атом стремится завершить свой внешний электронный уровень, чтобы уменьшить потенциальную энергию. Поэтому ядро одного атома притягивается к себе электронную плотность другого атома и наоборот, происходит наложение электронных облаков двух соседних атомов.
Демонстрация аппликации и схемы образования ковалентной неполярной химической связи в молекуле водорода. (Учащиеся записывают и зарисовывают схемы).
Вывод: Связь между атомами в молекуле водорода осуществляется за счет общей электронной пары. Такая связь называется ковалентной.
Прочитать стр. 33 в учебнике и записать определение.
Какую связь называют ковалентной неполярной? (Учебник стр. 33).
Составление электронных формул молекул простых веществ неметаллов:
•• ••
•• CI •• CI •• — электронная формула молекулы хлора,
•• ••
CI — CI — структурная формула молекула хлора.
••
•• N •• N •• — электронная формула молекулы азота,
••
N ≡ N — структурная формула молекулы азота.
Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
Но молекулы могут образовывать и разные атомы неметаллов и в этом случае общая электронная пара будет смещаться к более электроотрицательному химическому элементу.
Изучить материал учебника на стр. 34
Вывод: Металлы имеют более низкое значение электроотрицательности, чем неметаллы. И между ними она сильно отличается.
Демонстрация схемы образования полярной ковалентной связи в молекуле хлороводорода.
Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Составление электронных формул молекул йодоводорода и воды:
••
H •• J •• — электронная формула молекулы йодоводорода,
••
H → J — структурная формула молекулы йодоводорода.
••
H •• O •• — электронная формула молекулы воды,
••
H
Н →О — структурная формула молекулы воды.
↑
Н
Самостоятельная работа с учебником: выписать определение электроотрицательности.
Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками
Самостоятельная работа с учебником.
Вопросы для самоконтроля
— Атом, какого химического элемента имеет заряд ядра +11
– Записать схему электронного строения атома натрия
– Внешний слой завершен?
– Как добиться завершения заполнения электронного слоя?
– Составить схему отдачи электрона
– Сравнить строение атома и иона натрия
— Сравнить строение атома и иона инертного газа неона.
— Определить атом, какого элемента с количеством протонов 17.
– Запишите схему электронного строения атома.
– Слой завершен? Как этого добиться.
– Составить схему завершения электронного слоя хлора.
Задание по группам:
1-3 группа: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи Br2 ; NH3.
4-6 группы: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи F2 ; HBr.
Два ученика работают у дополнительной доски с этим же заданием для образца к самопроверке.
Устный опрос.
1. Дайте определение понятия «электроотрицательность».
2. От чего зависит электроотрицательность атома?
3. Как изменяется электроотрицательность атомов элементов в периодах?
4. Как изменяется электроотрицательность атомов элементов в главных подгруппах?
5. Сравните электроотрицательность атомов металлов и неметаллов. Отличаются ли способы завершения внешнего электронного слоя, характерные для атомов металлов и неметаллов? Каковы причины этого?
7. Какие химические элементы способны отдавать электроны, принимать электроны?
Что происходит между атомами при отдаче и принятии электронов?
Как называют частицы, образовавшиеся из атома в результате отдачи или присоединения электронов?
8. Что произойдет при встрече атомов металла и неметалла?
9. Как образуется ионная связь?
10. Химическая связь, образуемая за счет образования общих электронных пар называется …
11. Ковалентная связь бывает … и …
12. В чем сходство ковалентной полярной и ковалентной неполярной связи? От чего зависит полярность связи?
13. В чем различие ковалентной полярной и ковалентной неполярной связи?
ПЛАН ЗАНЯТИЯ № 8
Дисциплина: Химия.
Тема:Металлическая связь. Агрегатные состояния веществ и водородная связь.
Цель занятия: Сформировать понятие об химических связях на примере металлической связи. Добиться понимания механизма образования связи.
Планируемые результаты
Предметные: формировании кругозора и функциональной грамотности человека для решения практических задач; умение обрабатывать, объяснять результаты; готовность и способность применять методы познания при решении практических задач;
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь.
2. Физические свойства металлов.
3. Агрегатные состояния веществ. Переход вещества из одного агрегатного состояния в другое.
4. Водородная связь
Оснащение: Периодическая система химических элементов, кристаллическая решетка, раздаточный материал.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Химическая связь подразделяется на
Внутримолекулярные
Межмолекулярные
Характеристики химической связи
Длина связи – расстояние между ядрами атомов в молекуле; зависит от количества электронных уровней у каждого элемента.
Энергия связи — энергия, затрачиваемая на разрушение связи. Чем больше длина связи, тем меньше энергия.
Полярность молекулы определяется разностью электроотрицательностей атомов. Чем больше разность электроотрицательностей, тем больше полярность связи.
Ковалентная неполярная связь
Образуют атомы с одинаковой электроотрицательностью, чаще атомы одного и того же химического элемента (неметалла).Например:Cl2.Как образуется ковалентная неполярная связь?
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Ковалентная полярная связь
Образуют атомы неметаллов с разной электроотрицательностью. Пример:HCl.
Ионная связь
Образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности.
Пример: NaCl Как образуется ионная связь?
!!!!!Обрати внимание: существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи. Например, NaOH, KNO3.
Металлическая связь
Образуется в металлах или сплавах.
Примеры: Fe
Как образуется металлическая связь?
Атомы металлов слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. Эти электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь
Связь между атомами водорода одной молекулы и сильно электроотрицательными элементами (O, N, F) другой молекулы.
Ван-Дер-Ваальсова связь
Это силы притяжения между молекулами.
Что такое кристаллическая решетка?
Это каркас вещества, который получится, если частицы вещества соединить линиями.
Ионная кристаллическая решетка
Ионными называют решётки, в узлах которых находятся ИОНЫ.
Свойства веществ с ионными кристаллическими решетками:
1) все вещества при обычных условиях твердые
2) хрупкие
3) имеют высокие температуры кипения и плавления
4) нелетучесть
5) многие растворимы в воде
6) расплавы и растворы проводят электрический ток
Металлические кристаллические решетки
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Свойства веществ с металлическими кристаллическими решетками
1)Твердость
2)Электро- и теплопроводность
3)Металлический блеск
4)Ковкость, пластичность
Атомная кристаллическая решетка
Это кристаллические решётки, в узлах которых находятся отдельные атомы, соединенные ковалентными связями.
Свойства веществ с атомными решетками:
1) очень высокая твердость, прочность
2) очень высокая Тпл (алмаз 3500°С)
3) тугоплавкость
4) практически нерастворимы
5) нелетучесть
Примеры веществ атомного строения: углерод,алмаз, бор, оксид кремния.
Молекулярные кристаллические решетки
Это решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Примеры веществ: газы, органические вещества, вода.
Свойства веществ с молекулярными решетками:
1) малая твердость, прочность
2) низкие Тпл и Ткип
3) при комнатной температуре обычно жидкости или газы
4) высокая летучесть
5) растворы и расплавы проводят электрический ток
