Каким общим свойством обладают органические вещества

Метан, CH4; одно из простейших органических веществ
Органи́ческие соединения, органические вещества́ — вещества, относящиеся к углеводородам или их производным, то есть это класс химических соединений, объединяющий почти все химические соединения, в состав которых входит углерод[1] (за исключением карбидов, угольной кислоты, карбонатов, некоторых оксидов углерода, роданидов, цианидов).
Органические соединения редки в земной коре, но обладают большой важностью, потому что все известные формы жизни основаны на органических соединениях. Такие вещества часто включены в дальнейший круговорот жизни, как например органические вещества почвы (к слову, годовая продукция биосферы составляет 380 млрд.т)[2]. Основные дистилляты нефти считаются строительными блоками органических соединений[3]. Органические соединения, кроме углерода (C), чаще всего содержат водород (H), кислород (O), азот (N), значительно реже — серу (S), фосфор (P), галогены (F, Cl, Br, I), бор (B) и некоторые металлы (порознь или в различных комбинациях)[4].
История[править | править код]
Название органические вещества появилось на ранней стадии развития химии во времена господства виталистических воззрений, продолжавших традицию Аристотеля и Плиния Старшего о разделении мира на живое и неживое. В 1807 году шведский химик Якоб Берцелиус предложил назвать вещества, получаемые из организмов, органическими, а науку, изучающую их, — органической химией. Считалось, что для синтеза органических веществ необходима особая «жизненная сила» (лат. vis vitalis), присущая только живому, и поэтому синтез органических веществ из неорганических невозможен. Это представление было опровергнуто Фридрихом Вёлером, учеником Берцелиуса, в 1829 году путём синтеза «органической» мочевины из «минерального» цианата аммония, однако деление веществ на органические и неорганические сохранилось в химической терминологии и по сей день.
Количество известных органических соединений составляет почти 27 млн.
Таким образом, органические соединения — самый обширный класс химических соединений. Многообразие органических соединений связано с уникальным свойством углерода образовывать цепочки из атомов, что в свою очередь обусловлено высокой стабильностью (то есть энергией) углерод-углеродной связи. Связь углерод-углерод может быть как одинарной, так и кратной — двойной, тройной. При увеличении кратности углерод-углеродной связи возрастает её энергия, то есть стабильность, а длина уменьшается. Высокая валентность углерода — 4, а также возможность образовывать кратные связи, позволяет образовывать структуры различной размерности (линейные, плоские, объёмные).
Классификация[править | править код]
Основные классы органических соединений биологического происхождения — белки, липиды, углеводы, нуклеиновые кислоты — содержат, помимо углерода, преимущественно водород, азот, кислород, серу и фосфор. Именно поэтому «классические» органические соединения содержат прежде всего водород, кислород, азот и серу — несмотря на то, что элементами, составляющими органические соединения, помимо углерода могут быть практически любые элементы.
Соединения углерода с другими элементами составляют особый класс органических соединений — элементоорганические соединения. Металлоорганические соединения содержат связь металл-углерод и составляют обширный подкласс элементоорганических соединений.
Характерные свойства[править | править код]
Существует несколько важных свойств, которые выделяют органические соединения в отдельный, ни на что не похожий класс химических соединений.
- Органические соединения обычно представляют собой газы, жидкости или легкоплавкие твёрдые вещества, в отличие от неорганических соединений, которые в большинстве своём представляют собой твёрдые вещества с высокой температурой плавления.
- Органические соединения большей частью построены ковалентно, а неорганические соединения — ионно.
- Различная топология образования связей между атомами, образующими органические соединения (прежде всего, атомами углерода), приводит к появлению изомеров — соединений, имеющих один и тот же состав и молекулярную массу, но обладающих различными физико-химическими свойствами. Данное явление носит название изомерии.
- Явление гомологии — существование рядов органических соединений, в которых формула любых двух соседей ряда (гомологов) отличается на одну и ту же группу — гомологическую разницу CH2. Целый ряд физико-химических свойств в первом приближении изменяется симбатно (мера схожести зависимостей в математическом анализе) по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами.
- Горючесть. [источник не указан 1312 дней]
Номенклатура[править | править код]
Органическая номенклатура — это система классификации и наименований органических веществ.
В настоящее время распространена номенклатура ИЮПАК.
Классификация органических соединений построена на важном принципе, согласно которому физические и химические свойства органического соединения в первом приближении определяются двумя основными критериями — строением углеродного скелета соединения и его функциональными группами.
В зависимости от природы углеродного скелета органические соединения можно разделить на ациклические и циклические. Среди ациклических соединений различают предельные и непредельные. Циклические соединения разделяются на карбоциклические (алициклические и ароматические) и гетероциклические.
- Органические соединения
- Углеводороды
- Ациклические соединения
- Предельные углеводороды (алканы)
- Непредельные углеводороды
- Алкены
- Алкины
- Алкадиены (диеновые углеводороды)
- Циклические углеводороды
- Карбоциклические соединения
- Алициклические соединения
- Ароматические соединения
- Гетероциклические соединения
- Карбоциклические соединения
- Ациклические соединения
- Функциональные производные углеводородов:
- Спирты, Фенолы
- Простые эфиры
- Альдегиды, Кетоны
- Карбоновые кислоты
- Сложные эфиры
- Жиры
- Углеводы
- Моносахариды
- Олигосахариды
- Полисахариды
- Мукополисахариды
- Амины
- Аминокислоты
- Белки
- Нуклеиновые кислоты
- Углеводороды
Алифатические соединения[править | править код]
Алифатические соединения — органические вещества, не содержащие в структуре ароматических систем.
Углеводороды — Алканы — Алкены — Диены или Алкадиены — Алкины — Галогенуглеводороды — Спирты — Тиолы — Простые эфиры — Альдегиды — Кетоны — Карбоновые кислоты — Сложные эфиры — Углеводы или сахара — Нафтены — Амиды — Амины — Липиды — Нитрилы
Ароматические соединения[править | править код]
Ароматические соединения, или арены, — органические вещества, в структуру которых входит одна (или более) ароматическая циклическая система (см. Ароматизация).
Бензол-Толуол-Ксилол-Анилин-Фенол-Ацетофенон-Бензонитрил-
Галогенарены-Нафталин-Антрацен-Фенантрен-Бензпирен-Коронен-Азулен-Бифенил-Ионол.
Гетероциклические соединения[править | править код]
Гетероциклические соединения — вещества, в молекулярной структуре которых присутствует хотя бы один цикл с одним (или несколькими) гетероатомом.
Пиррол-Тиофен-Фуран-Пиридин
Полимеры[править | править код]
Полимеры представляют собой особый вид веществ, также известный как высокомолекулярные соединения. В их структуру обычно входят многочисленные сегменты (соединения) меньшего размера. Эти сегменты могут быть идентичны, и тогда речь идёт о гомополимере. Полимеры относятся к макромолекулам — классу веществ, состоящих из молекул очень большого размера и массы.
Полимеры могут быть органическими (полиэтилен, полипропилен, плексиглас и т. д.) или неорганическими (силикон); синтетическими (поливинилхлорид) или природными (целлюлоза, крахмал).
Структурный анализ[править | править код]
В настоящее время существует несколько методов характеристики органических соединений:
- Кристаллография (рентгеноструктурный анализ) — наиболее точный метод, требующий, однако, наличия высококачественного кристалла достаточного размера для получения высокого разрешения. Поэтому пока этот метод не используется слишком часто.
- Элементный анализ — деструктивный метод, использующийся для количественного определения содержания элементов в молекуле вещества.
- Инфракрасная спектроскопия (ИК): используется главным образом для доказательства наличия (или отсутствия) определённых функциональных групп.
- Масс-спектрометрия: используется для определения молекулярных масс веществ и способов их фрагментации.
- Спектроскопия ядерного магнитного резонанса ЯМР.
- Ультрафиолетовая спектроскопия (УФ): используется для определения степени сопряжения в системе.
См. также[править | править код]
- Неорганические вещества
- Органическая химия
Примечания[править | править код]
История развития органической химии
В истории развития органической химии выделяют два периода: эмпирический (с середины XVII до конца XVIII века), в который познание органических веществ, способов их выделения и переработки происходило опытным путем и аналитический (конец XVIII – середина XIX века), связанный с появлением методов установления состава органических веществ. В аналитический период было установлено, что все органические вещества содержат углерод. Среди, других элементов, входящих в состав органических соединений были обнаружены водород, азот, сера, кислород и фосфор.
Важное значение в истории органической химии имеет структурный период (вторая половина XIX – начало XX века), ознаменовавшийся рождением научной теории строения органических соединений, основоположником которой был А.М. Бутлеров.
Основные положения теории строения органических соединений:
- атомы в молекулах соединены между собой в определенном порядке химическими связями в соответствии с их валентностью. Углерод во всех органических соединениях четырехваленнтен;
- свойства веществ зависят не только от их качественного и количественного состава, но и от порядка соединения атомов;
- атомы в молекуле взаимно влияют друг на друга.
Порядок соединения атомов в молекуле описывается структурной формулой, в которой химические связи изображаются черточками.
Характерные свойства органических веществ
Существует несколько важных свойств, которые выделяют органические соединения в отдельный, ни на что не похожий класс химических соединений:
- Органические соединения обычно представляют собой газы, жидкости или легкоплавкие твердые вещества, в отличие неорганических соединений, которые в большинстве своём представляют собой твердые вещества с высокой температурой плавления.
- Органические соединения большей частью построены ковалентно , а неорганические соединения — ионно.
- Различная топология образования связей между атомами, образующими органические соединения (прежде всего, атомами углерода), приводит к появлению изомеров — соединений, имеющих один и тот же состав и молекулярную массу, но обладающих различными физико-химическими свойствами. Данное явление носит название изомерии.
- Явление гомологии — существование рядов органических соединений, в которых формула любых двух соседей ряда (гомологов) отличается на одну и ту же группу — гомологическую разницу CH2. Органические вещества горят.
Классификация органических веществ
В классификации принимают за основу два важных признака – строение углеродного скелета и наличие в молекуле функциональных групп.
В молекулах органических веществ атомы углерода соединяются друг с другом, образуя т.н. углеродный скелет или цепь. Цепи бывают открытыми и замкнутыми
(циклическими), открытые цепи могут быть неразветвленными (нормальными) и разветвленными:

По строению углеродного скелета различают:
— алициклические органические вещества, имеющие открытую углеродную цепь как разветвленную, так и неразветвленную. Например,
СН3-СН2-СН2-СН3 (бутан)
СН3-СН(СН3)-СН3 (изобутан)
— карбоциклические органические вещества, в которых углеродная цепь замкнута в цикл (кольцо). Например,

— гетероциклические органические соединения, содержащие в цикле не только атомы углерода, но и атомы других элементов, чаще всего азота, кислорода или серы:

Функциональная группа – атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определенному классу. Признаком, по которому органическое вещество относят к тому или иному классу, является природа функциональной группы (табл. 1).
Таблица 1. Функциональные группы и классы.

Соединения могут содержать не одну, а несколько функциональных групп. Если эти группы одинаковые, то соединения называют полифункциональными, например хлороформ, глицерин. Соединения, содержащие различные функциональные группы, называют гетерофункциональными, их можно одновременно отнести к нескольким классам соединений, например молочную кислоту можно рассматривать, как карбоновую кислоту и как спирт, а коламин – как амин и спирт.
Примеры решения задач
Вопрос 1. Каковы основные положения атомно — молекулярного учения?
1) Все вещества состоят из молекул.
2) Молекулы состоят из атомов. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида.
3) Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4) При взаимодействии атомов образуются молекулы: гомоядерные — при соединении атомов одного вида (например, H2, O2), образующиеся при этом вещества называются простыми; гетероядерные — при взаимодействии атомов разного вида (например, H2O, H2SO4), образующиеся при этом вещества называются сложными.
5) При физических явлениях молекулы сохраняются, при химических — разрушаются (или образуются новые). Атомы же и при физических, и при химических реакциях остаются неизменными.
6) Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Вопрос 2. Что такое химические элементы? Как устроены атомы разных химических элементов?
Химический элемент — совокупность атомных частиц (электронейтральных атомов и одноатомных ионов) с одинаково положительным зарядом ядра.
Атомы чрезвычайно малы, их диаметр колеблется в пределах 0,2 — 0,5 нм (1 нм = 10 — 9 м). Массы атомов составляют порядка 10 — 24 — 10 — 22 г. Атомы имеют сложное строение и состоят из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Вопрос 3. Что такое валентные электроны?
Валентные электроны — это такие электроны, которые участвуют в образовании химических связей.
Вопрос 4. Чем различаются свойства химических элементов главных и побочных подгрупп из левой и правой частей таблицы Менделеева?
Главное отличие в особенности заполнения электронами орбиталей и, соответственно, различие химических свойств.
Химические свойства, например, у s — элементов 1 группы — валентность 1, степень окисления — +1. А у d — элементов — переменная валентность и степень окисления, т.к у них есть свободные орбитали для заполнения электронами. К примеру, представлены электронно — графические схемы Na и Fe.
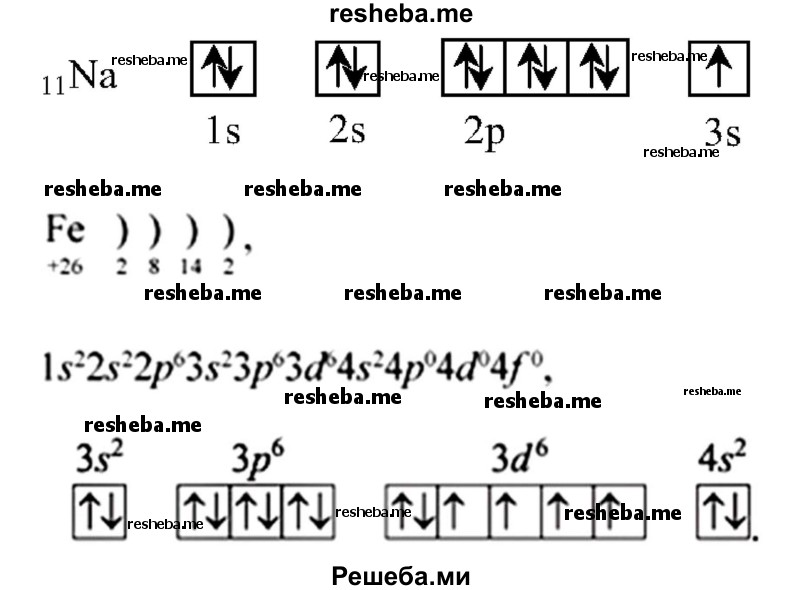
Вопрос 5. Какие химические элементы относят к группе макроэлементов и почему?
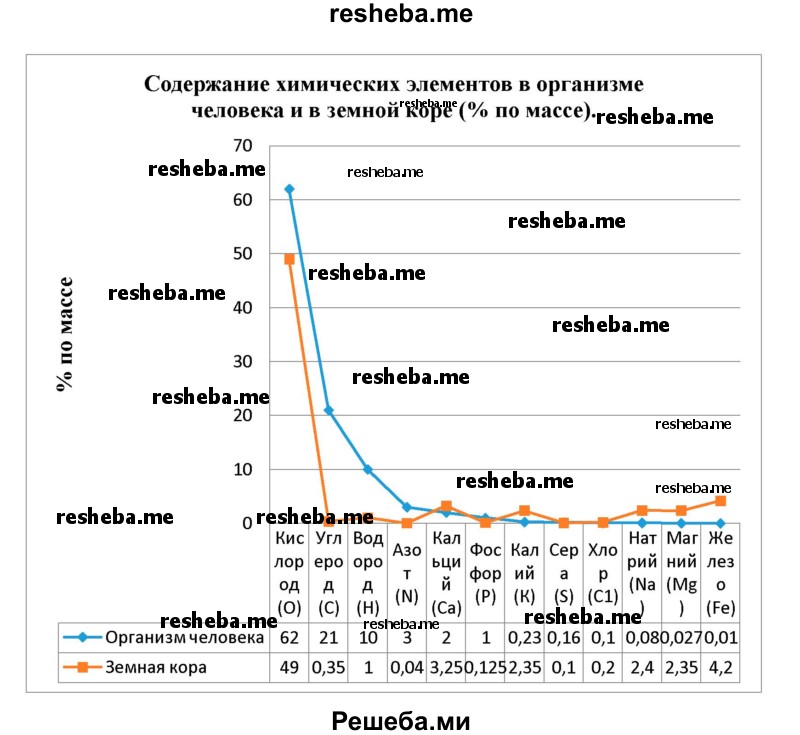
К группе макроэлементов относят химические элементы, содержание которых в живых организмах превышает 0,01 %. В значительных количествах встречаются 4 хим. элемента (кислород, углерод, водород и азот) (в сумме около 96 %) и ещё 8: кальций, фосфор, калий, сера, хлор, натрий, магний и железо.
Вопрос 6. Из чего состоят молекулы различных веществ? Что лежит в основе образования их структуры?
Молекулы состоят из атомов различных химических элементов. в основе образования их структуры обеспечивается возникновением химической связи между входящими в их состав атомами. Эти связи возникают вследствие объединения электронных оболочек атомов, которые образуют молекулу.
Вопрос 7. Что лежит в основе разделения веществ на органические и неорганические?
В основе разделения веществ на органические и неорганические лежит происхождение и наличие углерода в составе этих веществ (СО, СО2, Н2СО3 и карбонаты — это неорганические вещества).
Вопрос 8. Какие особенности атомов углерода обусловливают многообразие органических веществ в природе?
Очень важной особенностью атома углерода является его способность образовывать связи сразу с четырьмя другими такими же атомами. Благодаря этой способности атомы углерода могут образовывать каркасы огромного количества разнообразных биологических молекул, что способствует появлению многообразных органических веществ в природе.
Вопрос 9. Какие органические вещества являются биополимерами? Приведите примеры известных вам регулярных и нерегулярных полимеров, гомо — и гетерополимеров.
Биополимеры — высокомолекулярные органические соединения, входящие в состав живых организмов (белки, полисахариды, нуклеиновые кислоты).
Пример регулярных полимеров: крахмал, полисахариды, целлюлоза, гликоген.
Пример нерегулярных полимеров: белки, нуклеиновые кислоты.
Пример гомополимеров: крахмал, полисахариды, целлюлоза, гликоген.
Пример гетерополимеров: белки, нуклеиновые кислоты.
Вопрос 10. Используя данные таблицы 1, постройте диаграмму, отражающую содержание указанных в ней химических элементов в организме человека и в земной коре (% по массе).
Вопрос 11. Прочитайте статью «Химические связи в молекулах веществ». Составьте схему образования молекул известных вам веществ: водорода (Н2), кислорода (02), воды (Н20), хлорида натрия (NaCl) и метана (СН4). Подпишите на схеме названия типов химических связей, участвующих в образовании этих веществ.

В молекуле воды между атомами водорода и кислорода — ковалентная полярная связь. А водородная связь возникает МЕЖДУ МОЛЕКУЛАМИ ВОДЫ (а не В МОЛЕКУЛЕ воды).
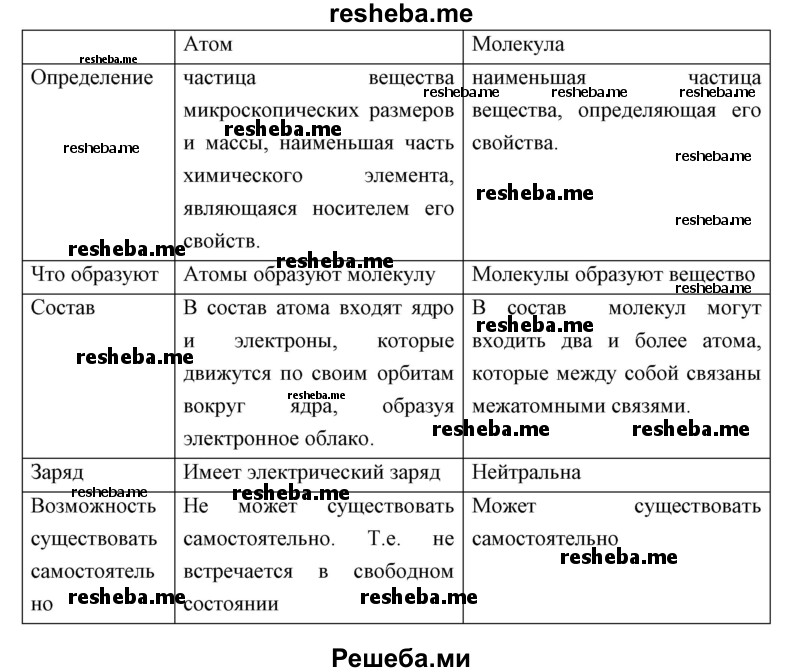
Вопрос 12. Используя материалы Википедии (https://ru.wikipedia.org), обобщите собственные представления о строении атома и молекул. Оформите их в виде таблицы.
Вопрос 13. Используя доступные информационные источники, найдите и рассмотрите периодическую таблицу химических элементов Д. И. Менделеева. Найдите в ней элементы, относящиеся к микро — и макроэлементам. Атомы нескольких химических элементов обладают строением, сходным со строением атомов углерода. Назовите эти элементы. Могли бы они заменить углерод в структуре органических веществ? Ответ обоснуйте и подкрепите известными вам примерами.
К макроэлементам относятся 12 химических элементов: кислород, углерод, водород и азот, кальций, фосфор, калий, сера, хлор, натрий, магний и железо. Всего в живых организмах найдено более 80 химических элементов, однако содержание большинства из них крайне мало — это микроэлементы (медь, йод, цинк, кобальт, кремний, марганец, литий и др.).
Макроэлементы обозначены красным, а микроэлементы — синим.
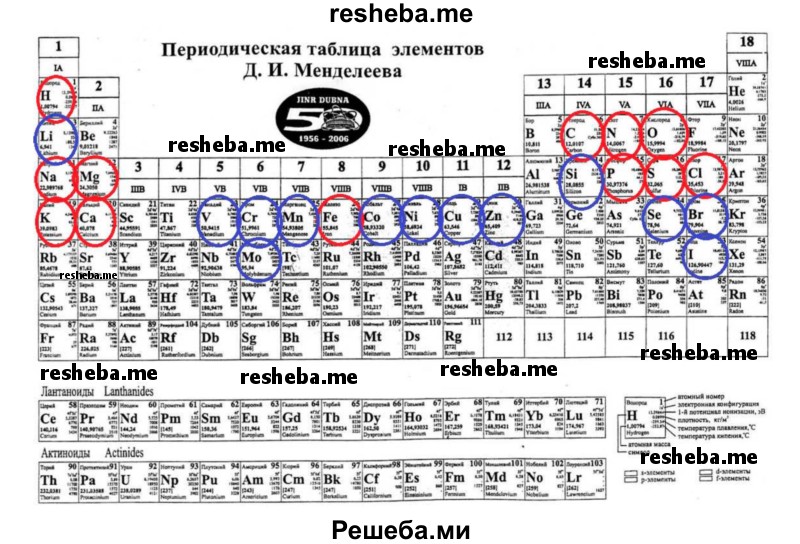
Кремний, бор и азот обладают строением, сходным со строением атомов углерода. Но они не могут заменить углерод в структуре органических веществ, потому что:
1. Заполненный внешний электрический слой.
2. Обладает низкой окислительной способностью.
3. Строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем — два.
4. Возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами.
5. Полимерные молекулы способны образовывать в большей степени углерод, сера, фосфор, селен и теллур, а в меньшей — кремний, германий, бор, мышьяк (As), олово (Sn) и сурьма (Sb). Способность образовывать достаточно прочные гомоцепные полимеры зависит от прочности связей атомов данного элемента друг с другом (у углерода этот показатель самый высокий — 80 ккал/моль, смотрите табл.)
Табл. Энергия некоторых связей в гомоцепных полимерах.
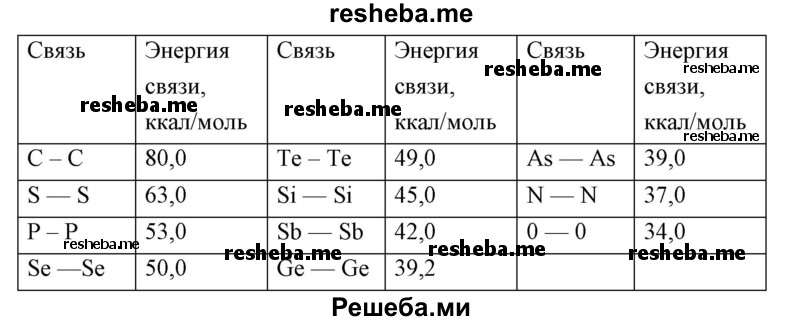
Среди всех элементов периодической системы углерод выделяется своей уникальной способностью образовывать необычайно длинные цепи полимеров.
6. Атомы бора, кремния, фосфора и др., также образуют прочные цепи из атомов этих элементов (в элементарном состоянии). Но уникальность углерода обусловлена в значительной степени тем обстоятельством, что образуемые им углерод — углеродные связи прочны и в тех случаях, когда атомы углерода одновременно связаны с другими элементами. Например, углерод — водородные и углерод — фторные соединения высоко стабильны и в химическом отношении относительно мало реакционноснособны, а соответствующие производные бора, кремния, фосфора и т. д. либо не могут быть получены, либо являются крайне реакционноснособными веществами.
7. Атомы углерода могут связываться по — разному, называясь при этом аллотропами углерода.
Вопрос 14. Основные макроэлементы, в первую очередь углерод, водород и азот, присутствуют в живых организмах в больших количествах, чем в неживой природе. Почему? Что из этого следует?
Потому что все органические соединения получены соединением этих элементов. Это связано в основном с их валентностью, равной соответственно 1, 4 и 3, а также с их способностью образовывать более прочные ковалентные связи, нежели связи, образуемые другими элементами той же валентности. Атомы углерода способны образовывать цепочки и кольца, создавая гигантское разнообразие органических молекул. Вода — вещество с уникальными свойствами, способное растворять огромное разнообразие веществ, а также стабилизировать температуру за счет высокой теплоемкости, теплоты замерзания и теплоты испарения. Азот входит в состав аминокислот. Все эти элементы входят в обменные процессы клеток и являются жизненно необходимыми химическими компонентами живых организмов.
Присутствие в живых организмах этих химических элементов в больших количествах, чем в неживой природе, наталкивает на мысль: химические соединения, содержащие углерод, водород, кислород и азот (наиболее распространенные в живой природе элементы) были отобраны из неживой природы в ходе эволюции благодаря их особой приспособленности для участия в процессах жизнедеятельности.
Вопрос 15. Какую проблему необходимо учитывать учёным в связи с разработкой и внедрением в производство новых искусственно созданных органических веществ? Обсудите это с учителем и одноклассниками.
Здесь можно выделить не одну, а несколько проблем.
1. Уменьшение количества отходов с целью уменьшения вредного воздействия на окружающую природу.
В экологическом отношении коксохимическое производство является одним из наиболее опасных. На всех его стадиях выделяется значительная масса загрязнителей. На долю коксохимического производства приходится более 70% канцерогенов от их общего количества, образующегося в металлургии (бензол, каменноугольная смола и др.).
Добыча, переработка и транспортировка нефти сопряжены с загрязнением окружающей среды (в первую очередь загрязнение Мирового океана).
2. Сохранение невозобновляемых источников сырья.
3. Увеличение эффективности переработки сырья.
Например, при переработке нефти выход наиболее ценных продуктов (бензина) недостаточен и обычно не превышает 15%, что не может покрыть все возрастающий спрос народного хозяйства на этот и другие виды моторного топлива. Увеличения их выхода достигают применением химических процессов переработки, резко увеличивающих выход бензина (до 70% массы сырья).
4. Снижение энергоёмкости производств.
5. И др.
