Какие вещества обладают окислительными свойствами

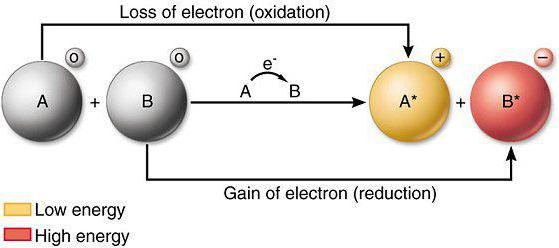
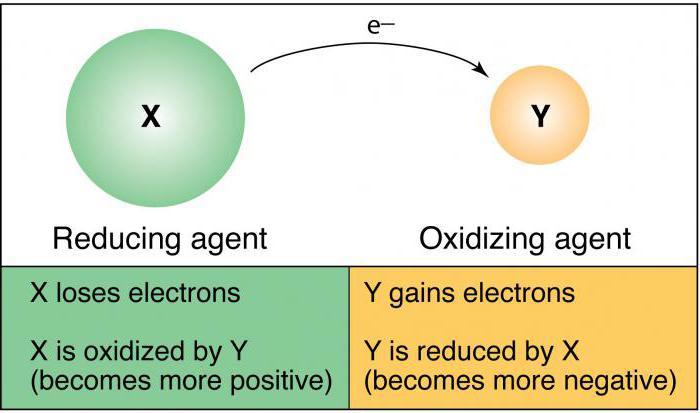
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
- Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
Распространённые окислители и их продукты[править | править код]
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2кислород | Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) +0,401 (в щелочной среде) | |
| O3озон | Разные, включая кетоны и альдегиды | +2,07 (в кислой среде) | |
| Пероксиды | Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | ||
| Hal2галогены | Hal−; окисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 | |
| ClO−гипохлориты | Cl− | ||
| ClO3−хлораты | Cl− | ||
| HNO3азотная кислота | с активными металлами, разбавленная с активными металлами, концентрированная с тяжёлыми металлами, разбавленная c тяжёлыми металлами, концентрированная | NH3, NH4+ NO NO NO2 | |
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами с активными металлами | SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы S H2S | |
| Шестивалентный хром | Cr3+ | +1,33 | |
| MnO2оксид марганца(IV) | Mn2+ | +1,23 | |
| MnO4−перманганаты | кислая среда нейтральная среда сильнощелочная среда | Mn2+ MnO2 MnO42− | +1,51 +1,695 +0,564 |
| Катионы металлов и H+ | Me0 H2 | См. Электрохимический ряд активности металлов |
Зависимость степени окисления от концентрации окислителя[править | править код]
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление.
В качестве примера — реакция азотной кислоты с цинком:
- Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
- 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
- 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
- 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
- 4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Сильные окислители[править | править код]
Сильными окислительными свойствами обладает «царская водка» — смесь одного объёма азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
NOCl=NO + Cl
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе.
Царская водка окисляет даже благородные металлы — золото и платину.
Селеновая кислота — одна из немногих неорганических кислот, в концентрированном виде способная окислять золото. Более сильный окислитель даже в умеренно разбавленном растворе, чем серная кислота. Способна к окислению соляной кислоты по уравнению:
При этом продуктами реакции являются селенистая кислота, свободный хлор и вода. В то же время концентрированная серная кислота не способна окислять HCl.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
С6H5-CH2-CH3 + [O] → C6H5COOH + …
C6H6 + [O] → HOOC-(CH2)4-COOH
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
К сильным окислителям относятся также оксид меди(III), озонид цезия, надпероксид цезия, все фториды ксенона.
Очень сильные окислители[править | править код]
Условно к «очень сильным окислителям» относят вещества, превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, фторид серебра(II), катионная форма Ag2+, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
См. также[править | править код]
- Окислительно-восстановительные реакции
Ñîåäèíåíèÿ ìàêñèìàëüíîé ñòåïåíè îêèñëåíèÿ, êîòîðîé îáëàäàåò äàííûé ýëåìåíò, ìîãóò â îêèñëèòåëüíî-âîññòàíîâèòåëüíûõ ðåàêöèÿõ ÿâëÿòüñÿ òîëüêî îêèñëèòåëÿìè, à ñòåïåíü îêèñëåíèÿ ýëåìåíòà â äàííîì ñëó÷àå áóäåò òîëüêî ïîíèæàòüñÿ. Àòîìû ýëåìåíòîâ îòäàëè ñâîè âàëåíòíûå ýëåêòðîíû è ïîýòîìó ìîãóò òîëüêî ïðèíèìàòü ýëåêòðîíû.
Ìàêñèìàëüíàÿ ñòåïåíü îêèñëåíèÿ ýëåìåíòà ðàâíà íîìåðó ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû.
Ñîåäèíåíèÿ ìàêñèìàëüíîé ñòåïåíè îêèñëåíèÿ ìîãóò áûòü òîëüêî âîññòàíîâèòåëÿìè, à ñòåïåíü îêèñëåíèÿ ýëåìåíòà áóäåò ïîâûøàòüñÿ.
 ñëó÷àå, åñëè ýëåìåíò íàõîäèòñÿ â ïðîìåæóòî÷íîé ñòåïåíè îêèñëåíèÿ, òî åãî àòîìû ìîãóò êàê ïðèíèìàòü, òàê è îòäàâàòü ýëåêòðîíû. Ýòî çàâèñèò îò óñëîâèé ðåàêöèè è âåùåñòâà, ñ êîòîðûì ïðîèñõîäèò âçàèìîäåéñòâèå.
Ñïîñîáíîñòü âñòóïàòü â ðåàêöèè, êàê ñ îêèñëèòåëÿìè, òàê è ñ âîññòàíîâèòåëÿìè íàçûâàåòñÿ îêèñëèòåëüíî-âîññòàíîâèòåëüíîé äâîéñòâåííîñòüþ.
Âåùåñòâà, îáëàäàþùèå îêèñëèòåëüíî-âîññòàíîâèòåëüíîé äâîéñòâåííîñòüþ ñïîñîáíû ê ðåàêöèè ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ. Ïðè ýòîì ÷àñòü àòîìîâ ýëåìåíòà ñ ïðîìåæóòî÷íîé ñòåïåíüþ îêèñëåíèÿ îòäàåò ýëåêòðîíû, à äðóãàÿ ÷àñòü èõ ïðèíèìàåò.
Ïðèìåð ðåàêöèè ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ:
Cl20 + 2NaOH = Na+1Cl-1 + Na+1Cl+1O-2 + H20O-2,
 äàííîì ñëó÷àå õëîð ÿâëÿåòñÿ è îêèñëèòåëåì è âîññòàíîâèòåëåì.
Ðåàêöèþ ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ íàçûâàþò ðåàêöèåé äèñïðîïîðöèîíèðîâàíèÿ.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Îêèñëåíèå. | |
| Îêèñëåíèå − ýòî ïðîöåññ ïåðåäà÷è ýëåêòðîíîâ âåùåñòâîì, êîòîðûé ñîïðîâîæäàåòñÿ ïîâûøåíèåì ñòåïåíè îêèñëåíèÿ ýëåìåíòà. | |
| Îêèñëåíèå. | |
Ðåàêöèè ñ èçìåíåíèåì ñòåïåíè îêèñëåíèÿ. | |
| Õèìè÷åñêèå ðåàêöèè, ïðîòåêàþùèå ñ èçìåíåíèÿ ñòåïåíè îêèñëåíèÿ , ò.å. ðåàêöèÿ ïðîèñõîäèò ñ èçìåíåíèåì ÷èñëà ýëåêòðîíîâ, ïåðåìåùåííûõ îò îäíîãî àòîìà âçàèìîäåéñòâóþùåãî ýëåìåíòà. | |
| Ðåàêöèè ñ èçìåíåíèåì ñòåïåíè îêèñëåíèÿ. | |
Что такое окислитель
![]() Окислителями могут быть нейтральные атомы или положительно заряженные ионы.
Окислителями могут быть нейтральные атомы или положительно заряженные ионы.
Нейтральные атомы. Окислителями могут быть только те из нейтральных атомов, которые, принимая электроны, переходят в отрицательно заряженные ионы, т. е. только нейтральные атомы неметаллов.
Рис. Перекись водорода окислитель.
Самые сильные окислители — атомы галогенов, так как они могут принимать только один электрон. Самые слабые окислители— атомы неметаллов четвертой группы.
В группах (4 — 7) окислительные свойства падают с возрастанием величин радиусов нейтральных атомов. Следовательно, из нейтральных атомов самый сильный окислитель — фтор, а самый слабый — свинец. Неметаллы могут быть не только окислителями, т. е. принимать электроны, но и отдавать электроны, т. е. быть восстановителями.
Положительно заряженные ионы как металлов, так и неметаллов также могут быть окислителями, так как они принимают электроны от других атомов или ионов. В процессе реакции они переходят: а) в положительные ионы низшей зарядности, б) в нейтральные атомы и в) в отрицательно заряженные ионы. Например:
а) Sn+4 + 2ē → Sn+2;
б) Cu+2 + 2ē → Cu;
в) N+5+8ē → N-3.
Чем больше энергии было затрачено на отрыв электронов, тем сильнее они будут притягиваться образовавшимися ионами. Поэтому к сильным окислителям относятся, например, ионы „благородных» металлов, их ионизационные потенциалы довольно высокие: Au — 9,18 V, Ag — 7,54 V, Pd —8,3 V, Pt —8,88 V.
Многозарядные положительные ионы обычно являются более сильными окислителями сравнительно с малозарядными ионами тех же атомов, так как на отрыв большего числа электронов у них затрачено большее количество энергии. Так, N+5 более сильный окислитель, чем N+3, Fe+6 более сильный окислитель, чем Fe+8, и т. д.
Необходимо заметить, что, хотя такие многозарядные положительные ионы в растворе существуют только в виде сложных анионов типов ЭO‘3, ЭO»4, ЭO‘4 и др., это, однако, нисколько не понижает их окислительной способности. Они являются сильными окислителями. К наиболее сильным окислителям принадлежат: фтор, озон, двуокись свинца, ионы «благородных» металлов и многовалентные положительные ионы.
Применяемые окислители в технике и лабораторной практике делятся на нейтральные, кислые и щелочные.
Нейтральные окислители
1. Кислород применяется для интенсификации производственных процессов в металлургической и химической промышленности (например, в доменном процессе, в производстве серной и азотной кислоты и т. д.). В нейтральной среде реакция окисления кислородом протекает по уравнению: O2 + 2Н2O + 4ē ⇄4OН‘, а в кислой среде:
O2 + 4H• + 4ē ⇄ 2Н2O
2. Озон отличается от кислорода более сильной окислительной способностью: он многие красящие вещества обесцвечивает, металлы (за исключением Au, Pt и др.) окисляет, аммиак окисляет в азотистую и азотную кислоты, сернистые соединения — в сернокислые и т. д. В нейтральной среде реакция окисления озоном протекает по уравнению: O3 + H2O + ē → O2 + 2H‘, в кислой среде: O3 + 2Н• + 2ē → O2 + Н2O.
3. Электрический ток широко используется в технике не только как восстановитель, но и как окислитель для получения различных химически чистых веществ.
Кислые окислители
1. Хромовая и двухромовая кислоты известны только в растворе, поэтому вместо свободных кислот пользуются их устойчивыми солями (К2Сr2O7 и К2СrO4), которые и применяются в промышленности и лабораторной практике для окисления различных веществ. Обычно пользуются для этой цели смесью бихроматов калия или натрия с серной кислотой (60 ч. К2Сr2O7 +80 ч. конц. H2SO4 + 270 ч. Н2O).
2. Азотная кислота—один из сильнейших окислителей. Она окисляет очень многие металлы. Ею относительно легко окисляются и многие неметаллы, например: сера (при кипячени) до H2SO4, фосфор —до Р3РО4 углерод —до СО2 и т. д.
3.Азотистая кислота хотя и является окислителем, но при взаимодействии с более сильными окислителями сама проявляет восстановительные свойства, окисляясь до азотной кислоты. Азотистая кислота и её соли (KNО2 и NaNО2) применяются в качестве окислителей главным образом в производстве органических красителей.
4. Серная кислота концентрированная—сравнительно сильный окислитель, особенно при высокой температуре. Она окисляет С до СО2, S до SO2, HJ и НВr (частично) до свободных галогенов (J2 и Вr2). Серная кислота окисляет также многие металлы: Cu, Ag, Hg и др. Однако такие металлы, как Au, Pt, Ru, Os и др., устойчивы по отношению к ней. Проявляя окислительные свойства, H2SO4 обычно восстанавливается до SO2, с более сильными восстановителями— до S и даже до H2S. Разбавленной серной кислотой окисляются только активные металлы, стоящие в ряду напряжений выше пары водорода.
5. Хлорноватая кислота — в растворе является энергичным окислителем. Так, например, 40% водный раствор её окисляет горючие вещества (например, бумагу и др.) с воспламенением. Соли её, хлорноватокислые или хлораты, в растворе окислительных свойств не проявляют, но, будучи в кристаллическом состоянии при сплавлении, являются сильными окислителями. Наиболее важной солью из них является хлорноватокислый калий (бертолетова соль).
6. Перекись водорода, являясь сильным окислителем, используется в тех случаях, когда требуется окислить вещество, сравнительно легко разрушающееся от других окислителей. В технике Н2O2 применяется для отбеливания тканей, слоновой кости, соломы, мехов, перьев и т. д. Разрушая красящие вещества, перекись водорода почти не затрагивает отбеливаемого материала. В медицине Н2O2, сильно разбавленная, применяется для полоскания горла и промывки ран. Она применяется также для обновления потускневших картин, написанных масляными красками. В реакциях с более сильными окислителями Н2O2 сама проявляет восстановительные свойства. Она способна также к реакциям самоокисления-самовосстановления.
7. Двуокись марганца в кислой среде применяется при получении хлора из соляной кислоты, в стекольной промышленности, для окисления различных сернистых соединений и производных железа, при изготовлении гальванических элементов типа Лекланше и т. д.
8. Двуокись свинца является исключительно сильным окислителем. Она широко применяется в работе свинцовых аккумуляторов.
Щелочные окислители
1. Марганцовокислый калий (перманганат калия)— сильный окислитель, применяется для окисления многих органических соединений. Перманганат калия в кислой среде окисляет соли двухвалентного олова и железа в соли четырёх- и трёхвалентные. Он также окисляет: сульфиты — в сульфаты, нитриты — в нитраты, йодистый калий — до свободного йода, соляную кислоту — до хлора, перекись водорода— до кислорода и т. д. Характер восстановления КМnO4 зависит от среды, в которой протекает реакция.
2. Хлорная (или белильная) известь относится к числу наиболее сильных окислителей, широко применяется
для отбелки тканей и бумаги, для дезинфекции и т. д. В военное время хлорная известь используется для дегазации местности, заражённой отравляющим веществом.
3. Растворы гипохлорита калия и натрия
2KOH + Cl2 = KOCl + KCl + H2O
2NaOH + Cl2 = NaOCl + NaCl + H2O
применяются для отбелки тканей, главным образом хлопчатобумажных и льняных, а также бумаги.
Особое место занимают ионы так называемой промежуточной зарядности, которые в зависимости от условий реакции могут быть как окислителями, так и восстановителями. Таковы, например:
S+4 в соединении Na2SO3; N+3 „ , KNO2; Мn+4 „ „ МnO2; Cl+1 „ „ NaOCl.
Следовательно, подразделение веществ на восстановители и окислители имеет до некоторой степени условный характер и преследует цель — указать на преобладание окислительных или восстановительных свойств у данного вещества в определённых условиях.
Статья на тему Окислитель
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
— S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
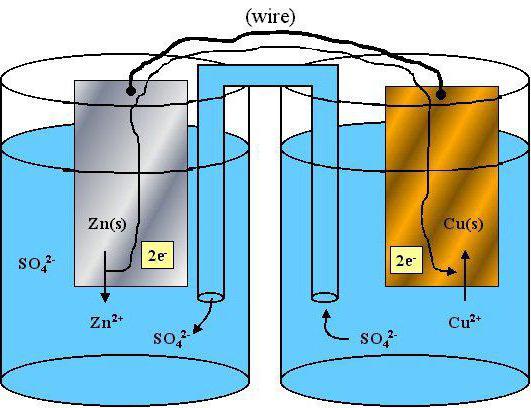
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn+7 принимает 5 e = Mn+2 2 является окислителем,
— 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
— Mn+7 принимает 5 e= Mn+2 2,
— S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
— нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
— Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
— 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
