Какие вещества могут проявлять восстановительные свойства
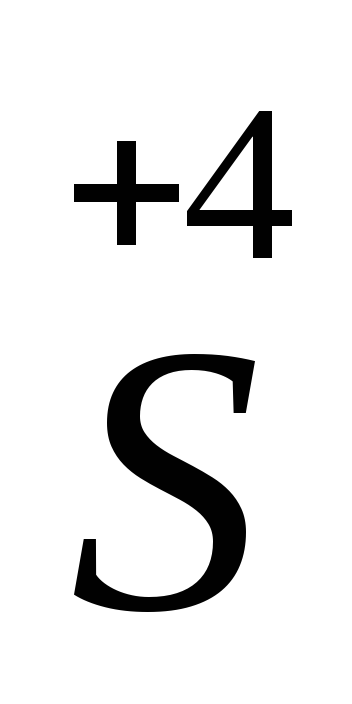
Ñîåäèíåíèÿ ìàêñèìàëüíîé ñòåïåíè îêèñëåíèÿ, êîòîðîé îáëàäàåò äàííûé ýëåìåíò, ìîãóò â îêèñëèòåëüíî-âîññòàíîâèòåëüíûõ ðåàêöèÿõ ÿâëÿòüñÿ òîëüêî îêèñëèòåëÿìè, à ñòåïåíü îêèñëåíèÿ ýëåìåíòà â äàííîì ñëó÷àå áóäåò òîëüêî ïîíèæàòüñÿ. Àòîìû ýëåìåíòîâ îòäàëè ñâîè âàëåíòíûå ýëåêòðîíû è ïîýòîìó ìîãóò òîëüêî ïðèíèìàòü ýëåêòðîíû.
Ìàêñèìàëüíàÿ ñòåïåíü îêèñëåíèÿ ýëåìåíòà ðàâíà íîìåðó ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû.
Ñîåäèíåíèÿ ìàêñèìàëüíîé ñòåïåíè îêèñëåíèÿ ìîãóò áûòü òîëüêî âîññòàíîâèòåëÿìè, à ñòåïåíü îêèñëåíèÿ ýëåìåíòà áóäåò ïîâûøàòüñÿ.
 ñëó÷àå, åñëè ýëåìåíò íàõîäèòñÿ â ïðîìåæóòî÷íîé ñòåïåíè îêèñëåíèÿ, òî åãî àòîìû ìîãóò êàê ïðèíèìàòü, òàê è îòäàâàòü ýëåêòðîíû. Ýòî çàâèñèò îò óñëîâèé ðåàêöèè è âåùåñòâà, ñ êîòîðûì ïðîèñõîäèò âçàèìîäåéñòâèå.
Ñïîñîáíîñòü âñòóïàòü â ðåàêöèè, êàê ñ îêèñëèòåëÿìè, òàê è ñ âîññòàíîâèòåëÿìè íàçûâàåòñÿ îêèñëèòåëüíî-âîññòàíîâèòåëüíîé äâîéñòâåííîñòüþ.
Âåùåñòâà, îáëàäàþùèå îêèñëèòåëüíî-âîññòàíîâèòåëüíîé äâîéñòâåííîñòüþ ñïîñîáíû ê ðåàêöèè ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ. Ïðè ýòîì ÷àñòü àòîìîâ ýëåìåíòà ñ ïðîìåæóòî÷íîé ñòåïåíüþ îêèñëåíèÿ îòäàåò ýëåêòðîíû, à äðóãàÿ ÷àñòü èõ ïðèíèìàåò.
Ïðèìåð ðåàêöèè ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ:
Cl20 + 2NaOH = Na+1Cl-1 + Na+1Cl+1O-2 + H20O-2,
 äàííîì ñëó÷àå õëîð ÿâëÿåòñÿ è îêèñëèòåëåì è âîññòàíîâèòåëåì.
Ðåàêöèþ ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ íàçûâàþò ðåàêöèåé äèñïðîïîðöèîíèðîâàíèÿ.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Îêèñëåíèå. | |
| Îêèñëåíèå − ýòî ïðîöåññ ïåðåäà÷è ýëåêòðîíîâ âåùåñòâîì, êîòîðûé ñîïðîâîæäàåòñÿ ïîâûøåíèåì ñòåïåíè îêèñëåíèÿ ýëåìåíòà. | |
| Îêèñëåíèå. | |
Ðåàêöèè ñ èçìåíåíèåì ñòåïåíè îêèñëåíèÿ. | |
| Õèìè÷åñêèå ðåàêöèè, ïðîòåêàþùèå ñ èçìåíåíèÿ ñòåïåíè îêèñëåíèÿ , ò.å. ðåàêöèÿ ïðîèñõîäèò ñ èçìåíåíèåì ÷èñëà ýëåêòðîíîâ, ïåðåìåùåííûõ îò îäíîãî àòîìà âçàèìîäåéñòâóþùåãî ýëåìåíòà. | |
| Ðåàêöèè ñ èçìåíåíèåì ñòåïåíè îêèñëåíèÿ. | |
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 декабря 2017;
проверки требуют 30 правок.
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором) .
Историческая справка[править | править код]
Издавна учёные полагали, что окисление — потеря флогистона (особого невидимого горючего вещества, термин которого ввел Иоганн Бехер), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание[править | править код]
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление[править | править код]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии у веществ в результате отдачи электронов увеличивается степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление[править | править код]
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара[править | править код]
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций[править | править код]
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных
веществ, например:
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
Примеры[править | править код]
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полу-реакции:
1) Окисление:
2) Восстановление:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
Примечания[править | править код]
- ↑ В этом, как и во многих других случаях водород рассматривают как помещённый в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется в виду в том числе и валентности.
- ↑ ОВР методом полуреакций (недоступная ссылка). Химия и химическая технология в жизни (10.07.2013). Дата обращения 19 января 2015. Архивировано 19 января 2015 года.
Литература[править | править код]
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углублённый курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
См. также[править | править код]
- Кислотно-основные реакции
Теория
ОВРЭлектрохимические
свойства металлов.
1. Теория овр
К
окислительно-восстановительным реакциям
относятся такие, которые сопровождающиеся
перемещением электронов от одних частиц
к другим. При рассмотрении закономерностей
протекания окислительно-восстановительных
реакций используется понятие степени
окисления.
Степень окисления
Понятие
степени
окисления
введено для характеристики состояния
элементов в соединениях. Под степенью
окисления понимается
условный заряд атома в соединении,
вычисленный исходя из предположения,
что соединение состоит из ионов.
Степень окисления обозначается арабской
цифрой со знаком плюс при смещении
электронов от данного атома к другому
атому и цифрой со знаком минус при
смещении электронов в обратном
направлении. Цифру со знаком “+” или
“-“ ставят над символом элемента.
Степень окисления указывает состояние
окисления атома и представляет собой
всего лишь удобную форму для учета
переноса электронов: ее не следует
рассматривать ни как эффективный заряд
атома в молекуле (например, в молекуле
LiF эффективные заряды Li и F равны
соответственно + 0,89 и -0,89, тогда как
степени окисления +1 и -1), ни как валентность
элемента (например, в соединениях CH4,
CH3OH,
HCOOH,
CO2
валентность углерода равна 4, а степени
окисления соответственно равны -4, -2,
+2, +4). Численные значения валентности и
степени окисления могут совпадать по
абсолютной величине лишь при образовании
соединений с ионной структурой.
При
определении степени окисления используют
следующие правила:
Атомы
элементов, находящихся в свободном
состоянии или в виде молекул простых
веществ, имеют степень окисления, равную
нулю, например Fe, Cu, H2,
N2
и т.п.
Степень
окисления элемента в виде одноатомного
иона в соединении, имеющем ионное
строение, равна заряду данного иона,
+1
-1 +2 -2 +3 -1
например,
NaCl,
Cu S, AlF3.
Водород
в большинстве соединений имеет степень
окисления +1, за исключением гидридов
металлов (NaH, LiH), в которых степень
окисления водорода равна -1.
Наиболее
распространенная степень окисления
кислорода в соединениях -2 , за исключением
пероксидов (Na2O2,
Н2О2),
в которых степень окисления кислорода
равна –1 и F2O,
в котором степень окисления кислорода
равна +2.
Для
элементов с непостоянной степенью
окисления ее значение можно рассчитать,
зная формулу соединения и учитывая, что
алгебраическая сумма степеней окисления
всех элементов в нейтральной молекуле
равна нулю. В сложном ионе эта сумма
равна заряду иона. Например, степень
окисления атома хлора в молекуле HClO4,
вычисленная исходя из суммарного заряда
молекулы [1 + x
+ 4(-2)] = 0, где х – степень окисления атома
хлора), равна +7. Степень окисления атома
серы в ионе (SO4)2-
[х + 4(-2) = -2] равна +6.
Окислительно-восстановительные свойства веществ
Любая
окислительно-восстановительная реакция
состоит из процессов окисления и
восстановления. Окисление
— это
процесс отдачи электронов атомом, ионом
или молекулой реагента. Вещества,
которые отдают
свои
электроны в процессе реакции и при этом
окисляются, называют
восстановителями.
Восстановление
– это процесс принятия электронов
атомом,ионом или молекулой реагента.
Вещества,
которые принимают электроны и при этом
восстанавливаются, называют окислителями.
Реакции
окисления-восстановления всегда
протекают как единый процесс, называемый
окислительно-восстановительной
реакцией.
Например, при взаимодействии
металлического цинка с ионами меди
восстановитель
(Zn)
отдает свои электроны окислителю
–
ионам меди (Cu2+):
Zn
+ Cu2+
![]()
Zn2+
+ Cu
Медь
выделяется на поверхности цинка, а ионы
цинка переходят в раствор.
Окислительно-восстановительные
свойства элементов связаны со строением
их атомов и определяются положением в
периодической системе Д.И. Менделеева.
Восстановительная способность элемента
обусловлена слабой связью валентных
электронов с ядром. Атомы металлов,
содержащие на внешнем энергетическом
уровне небольшое число электронов
склонны к их отдаче, т.е. легко окисляются,
играя роль восстановителей. Самые
сильные восстановители – наиболее
активные металлы.
Критерием
окислительно-восстановительной
активности элементов может служить
величина их относительной
электроотрицательности:
чем она выше, тем сильнее выражена
окислительная способность элемента, и
чем ниже, тем ярче проявляется его
восстановительная активность. Атомы
неметаллов (например, F,
O)
обладают высоким значением сродства к
электрону и относительной
электроотрицательности, они легко
принимают электроны, т.е. являются
окислителями.
Окислительно-восстановительные
свойства элемента зависят от степени
его окисления. У одного и того же элемента
различают низшую,
высшую и промежуточные степени окисления.
В
качестве примера рассмотрим серу S и ее
соединения H2S,
SO2
и SO3.
Связь между электронной структурой
атома серы и его окислительно-восстановительными
свойствами в этих соединениях наглядно
представлена в таблице 1.
В
молекуле H2S
атом серы имеет устойчивую октетную
конфигурацию внешнего энергетического
уровня 3s23p6
и
поэтому не может больше присоединять
электроны, но может их отдавать.
Состояние
атома, в котором он не может больше
принимать электроны, называется низшей
степенью окисления.
В
низшей степени окисления атом теряет
окислительную способность и может быть
только восстановителем.
Таблица.1.
Формула | Электронная | Окислительно-восстановительные | |
|
1s22s22p63s23p6 |
| |
| 1s22s22p63s23p4 | окислитель | восстановитель |
| 1s22s22p63s23po | окислитель |
|
| 1s22s22p63so3p0 | окислитель | |
В
молекуле SO3
все внешние электроны атома серы смещены
к атомам кислорода. Следовательно, в
этом случае атом серы может только
принимать электроны, проявляя окислительные
свойства.
Состояние
атома, в котором он отдал все валентные
электроны, называется высшей степенью
окисления. Атом,
находящийся в высшей степени окисления,
может быть только окислителем.
В
молекуле SO2
и
элементарной сере S атом серы находится
в промежуточных
степенях окисления,
т.е., имея валентные электроны, атом
может их отдавать, но, не имея завершенного
р
— подуровня,
может и принимать электроны до его
завершения.
Атом
элемента, имеющий промежуточную степень
окисления, может проявлять как
окислительные, так и восстановительные
свойства, что определяется его ролью
в конкретной реакции.
Так,
например роль сульфит — аниона SO![]() в следующих реакциях различна:
в следующих реакциях различна:
5Na2SO3
+2KMnO4
+
3H2SO4
2MnSO4
+ 5Na2SO4
+
K2SO4+
3H2O
(1)
H2SO3
+ 2 H2S
3 S + 3 H2O
(2)
В
реакции (1) сульфит-анион SO![]() в присутствии сильного окислителяKMnO4
в присутствии сильного окислителяKMnO4
играет роль восстановителя; в реакции
(2) сульфит-анион SO![]() —
—
окислитель, так как H2S
может проявлять только восстановительные
свойства.
Таким
образом, среди сложных веществ
восстановителями
могут быть:
1.
Простые вещества, атомы которых обладают
низкими значениями энергии ионизации
и электроотрицательности (в частности,
металлы).
2.
Сложные вещества, содержащие атомы в
низших степенях окисления:
-1
-2 — 3
HCl,H2S,NH3
3.
Сложные вещества, содержащие атомы в
промежуточных степенях окисления:
+4
+2 +2
Na2SO3,
FeCl2,
Sn(NO3)2.
Окислителями
могут
быть:
1.
Простые вещества, атомы которых обладают
высокими значениями сродства к электрону
и электроотрицательности — неметаллы.
2.
Сложные вещества, содержащие атомы в
высших степенях окисления:
+7 +6 +7
KMnO4,
K2Cr2O7,
HClO4.
3.
Сложные вещества, содержащие атомы в
промежуточных степенях окисления:
+4
+4 +2
Na2SO3,
MnO2,
MnSO4.
Соседние файлы в папке лекции по ТД
- #
- #
- #
