Какие свойствами обладают аминокислоты

Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) |  цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) |  фенилаланин
тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
![]()
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с основаниями:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
![]()
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
![]()
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
![]()
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
![]()
Например, глицин разлагается при нагревании:
![]()
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
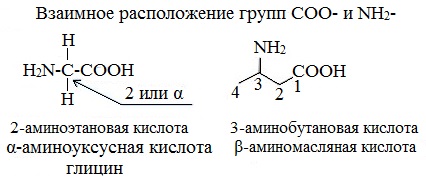
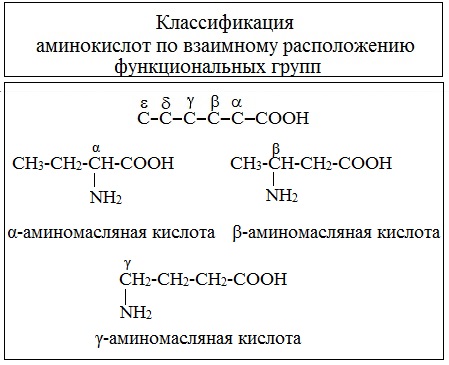
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
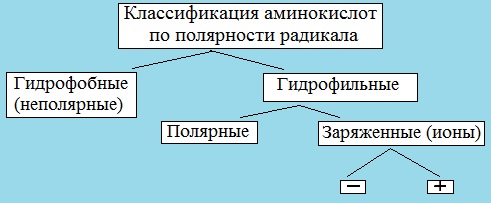
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
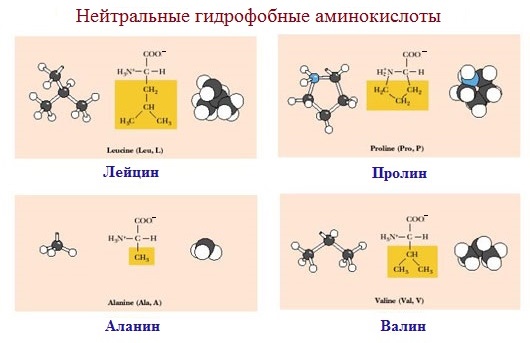
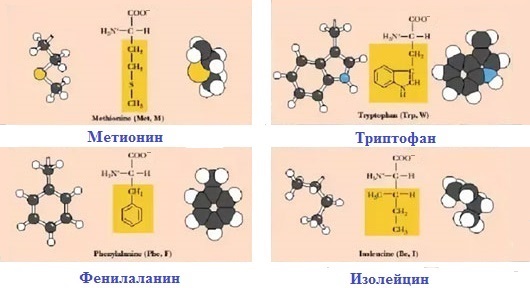
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
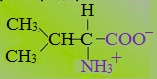
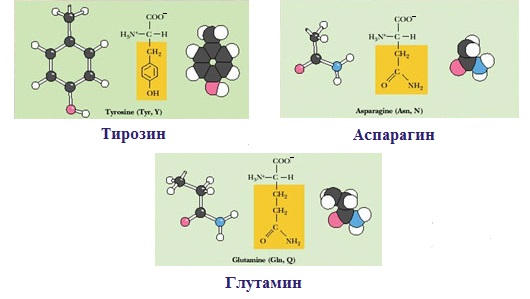
2. Полярные незаряженные
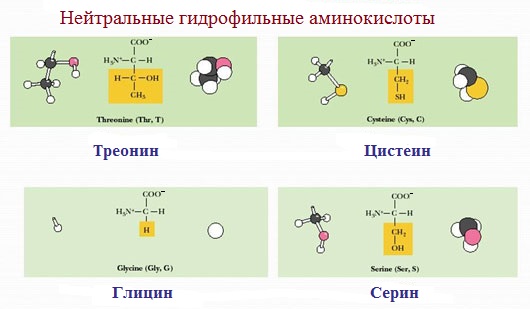
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
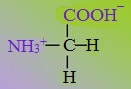
3. Заряженные отрицательно при рН-7 (кислые)
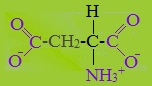
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.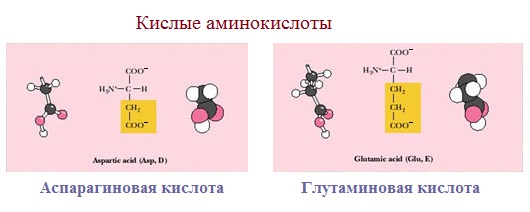
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.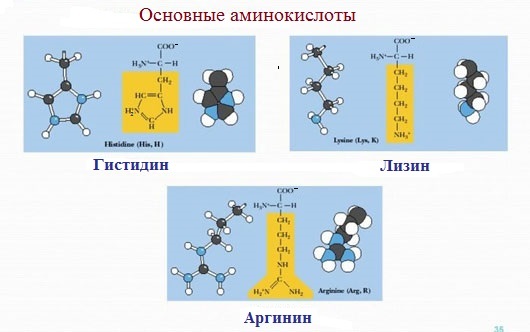
В ионизированном виде они имеют суммарный положительный заряд:
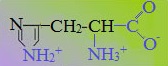
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
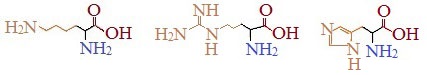
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
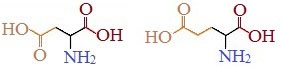
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 сентября 2018;
проверки требует 61 правка.
21 протеиногенная α-аминокислота эукариот, сгруппированные согласно радикалам.
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Для разных видов организмов список незаменимых аминокислот различен. Все белки, синтезируемые организмом, собираются в клетках из 20 базовых аминокислот, только часть из которых может синтезироваться организмом. Невозможность сборки определённого белка организмом приводит к нарушению его нормальной работы, поэтому необходимо поступление незаменимых аминокислот в организм с пищей.
[1]
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин; также часто к незаменимым относят гистидин[2][3]; (F V T W M L I K H). Для детей также незаменимым является аргинин.
6 других аминокислот (R C G Q P Y) считаются условно незаменимыми в питании человека, что означает ограниченные возможности их синтеза в зависимости от состояния организма, например у новорожденных и больных людей.[4].
5 аминокислот (A D N E S) — заменимые у человека, означает что они могут синтезироваться в достаточных количествах в организме.[4]
Роль незаменимых для человека аминокислот[править | править код]
В результате дефицита необходимых аминокислот в организме человека нарушается синтез белков, что приводит к ослаблению функций памяти и умственных способностей, снижению иммунитета (сопротивляемости организма болезням). В то же время избыток потребления несбалансированного белка приводит к перегрузке работы органов, в первую очередь печени и почек. Ценность потребляемого с пищей белка для человека определяется его сбалансированностью по содержанию незаменимых аминокислот.[1]
Рекомендованная суточная норма[править | править код]
Рассчитать требования к рекомендованной суточной норме достаточно сложно; эти значения претерпели значительные изменения за последние 20 лет. Следующая таблица представляет список рекомендованных ВОЗ и Национальной библиотекой медицины США суточных норм для взрослого человека.[5][6]
| Аминокислота(ы) | ВОЗ мг на 1 кг веса тела | ВОЗ мг для веса 70 кг | США мг на 1 кг веса тела | Кодирующий кодон генетического кода |
|---|---|---|---|---|
| H Гистидин | 10 | 700 | 14 | CAU, CAC |
| I Изолейцин | 20 | 1400 | 19 | AUU, AUC, AUA |
| L Лейцин | 39 | 2730 | 42 | UUA, UUG, CUU, CUC, CUA, CUG |
| K Лизин | 30 | 2100 | 38 | AAA, AAG |
| M Метионин + C Цистеин | 10,4 + 4,1 (15 всего) | 1050 всего | 19 всего | Метионин: AUG; Цистеин: UGU, UGC. |
| F Фенилаланин + Y Тирозин | 25 (всего) | 1750 всего | 33 всего | Фенилаланин: UUU, UUC; Тирозин: UAU,UAC . |
| T Треонин | 15 | 1050 | 20 | ACU, ACC, ACA, ACG |
| W Триптофан | 4 | 280 | 5 | UGG |
| V Валин | 26 | 1820 | 24 | GUU, GUC, GUA, GUG |
Рекомендованная суточная норма для детей от 3 лет и старше на 10-20 % выше, чем для взрослого.[5][7]
Продукты с повышенным содержанием отдельных незаменимых аминокислот[править | править код]
- Валин: зерновые, бобовые, арахис, грибы, молочные продукты, мясо.
- Изолейцин: миндаль, кешью, турецкий горох (нут), чечевица, рожь, большинство семян, соя, яйца, куриное мясо, рыба, печень, мясо.
- Лейцин: чечевица, орехи, большинство семян, овёс, бурый (неочищенный) рис, рыба, яйца, курица, мясо.
- Лизин: пшеница, орехи, амарант, гречиха, молочные продукты, рыба, мясо, горох.
- Метионин: бобы, фасоль, чечевица, соя, гречиха, молоко, яйца, рыба, мясо.
- Треонин: орехи, бобы, молочные продукты, яйца.
- Триптофан: бобовые, овёс, сушёные финики[источник не указан 2074 дня], арахис, кунжут, кедровые орехи, молоко, йогурт, творог, рыба, курица, индейка, мясо.
- Фенилаланин: бобовые, орехи, говядина, куриное мясо, рыба, яйца, творог, молоко. Также образуется в организме при распаде синтетического сахарозаменителя — аспартама, активно используемого в пищевой промышленности.
- Аргинин (частично-заменимая аминокислота, образуется из аминокислот, поступающих с пищей, не путать с условно-заменимыми, которые образуются из незаменимых кислот, не поступающих с пищей): семена тыквы, арахис, кунжут, йогурт, швейцарский сыр, свинина, говядина, горох.
- Гистидин (частично-заменимая аминокислота): соевые бобы, арахис, чечевица, тунец, лосось, куриные грудки, свиная вырезка, говяжье филе.
Компенсация незаменимых аминокислот[править | править код]
Несмотря на то, что самостоятельно организм не способен синтезировать незаменимые аминокислоты, их недостаток в некоторых случаях все же может быть частично компенсирован. Так, например, недостаток поступающего вместе с пищей незаменимого фенилаланина может быть частично замещен заменимым тирозином. Гомоцистеин вместе с необходимым количеством доноров метильных групп снижает потребности в метионине, а глутаминовая кислота частично замещает аргинин.
См. также[править | править код]
- Незаменимые жирные кислоты
- Незаменимые пищевые вещества
Примечания[править | править код]
- ↑ 1 2 https://cyberleninka.ru/article/n/metodologiya-otsenki-sbalansirovannosti-aminokislotnogo-sostava-mnogokomponentnyh-pischevyh-produktov.pdf
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/1123426 1975
- ↑ apps.who.int/iris/bitstream/10665/38133/1/9251030979_eng.pdf 1991
- ↑ 1 2 Dietary Reference Intakes: The Essential Guide to Nutrient Requirements Архивировано 5 июля 2014 года.. Institute of Medicine’s Food and Nutrition Board. usda.gov
- ↑ 1 2 FAO/WHO/UNU (2007), PROTEIN AND AMINO ACID REQUIREMENTS IN HUMAN NUTRITION, WHO Press, <https://whqlibdoc.who.int/trs/WHO_TRS_935_eng.pdf>, page 150
- ↑ Institute of Medicine (англ.)русск.. Protein and Amino Acids // Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (англ.). — Washington, DC: The National Academies Press (англ.)русск., 2002. — P. 589—768.
- ↑ Imura K., Okada A. Amino acid metabolism in pediatric patients (неопр.) // Nutrition. — 1998. — Т. 14, № 1. — С. 143—148. — doi:10.1016/S0899-9007(97)00230-X. — PMID 9437700.
Ссылки[править | править код]
- Amino acids / MedlinePlus Encyclopedia, 2015: (англ.) «The 9 essential amino acids are: histidine, isoleucine, leucine, lysine, methionine, phenylalanine, threonine, tryptophan, and valine.»
- https://web.archive.org/web/20150226110517/https://www.uic.edu/classes/phar/phar332/Clinical_Cases/aa%20metab%20cases/PKU%20Cases/essential-nonessential.htm
- ESSENTIAL AMINO ACID REQUIREMENTS: A REVIEW / FAO, 1981
- Recommended Dietary Allowances: 10th Edition., National Research Council (US), National Academies Press 1989. Chapter 6 «Protein and Amino Acids» (англ.)

Биоорганическая химия
Аминокислоты.
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные
(-COOH) и аминные группы (-NH2).
Строение аминокислот можно выразить приведённой ниже общей формулой,
(где R – углеводородный радикал, который может содержать и различные
функциональные группы).

Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены
на аминные группы (-NH2).
В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту или аланин:

Химические свойства аминокислот
Аминокислоты – амфотерные соединения, т.е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства.
За счёт карбоксильной группы (-COOH) они образуют соли с основаниями.
За счёт аминогруппы (-NH2) образуют соли с кислотами.
Ион водорода, отщепляющийся при диссоциации от карбоксила (-ОН) аминокислоты, может переходить к её аминогруппе с образованием
аммониевой группировки (NH3+).

Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей).
Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию.
Альфа-аминокислоты
Из молекул аминокислот строятся молекулы белковых веществ или белков, которые при полном гидролизе под влиянием минеральных кислот,
щелочей или ферментов распадаются, образуя смеси аминокислот.
Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки.
Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот.
Альфа-аминокислоты – кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Это свойство нашло
отражение в названии первого гомолога в ряду альфа-аминокислот – глицина, явившегося также первой альфа-аминокислотой, обнаруженной
в природном материале.
Ниже приведена таблица с перечнем альфа-аминокислот:
Название | Формула | Название остатка |
|---|---|---|
| Аминокислоты с алифатическими радикалами | ||
| Глицин |
| Ala |
| Аланин |
| Gly |
| Валин |
| Val |
| Лейцин |
| Leu |
| Изолейцин |
| Ile |
| Аминокислоты с радикалами, содержащими ОН-группу | ||
| Серин |
| Ser |
| Треонин |
| Thr |
| Аминокислоты с радикалами, содержащими COОН-группу | ||
| Аспарагиновая кислота |
| Asp |
| Глутаминовая кислота |
| Glu |
| Аминокислоты с радикалами, содержащими NH2CO-группу | ||
| Аспарагин |
| Asn |
| Глутамин |
| Gln |
| Аминокислоты с радикалами, содержащими NH2-группу | ||
| Лизин |
| Lys |
| Аргинин |
| Arg |
| Аминокислоты с радикалами, содержащими cеру | ||
| Цистеин |
| Cys |
| Метионин |
| Met |
| Аминокислоты с ароматическими радикалами | ||
| Фенилаланин |
| Phe |
| Тирозин |
| Tyr |
| Аминокислоты с гетероциклическими радикалами | ||
| Триптофан |
| Trp |
| Гистидин |
| His |
| Пролин |
| Pro |
Незаменимые аминокислоты
Основным источником альфа-аминокислот для животного организма служат пищевые белки.
Многие альфа-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков альфа-аминокислоты в организме
не синтезируются и должны поступать извне, с продуктами питания. Такие аминокислоты называют незаменимыми. Вот их список:
Название аминокислоты | Название продуктов питания |
|---|---|
| Валин |




















