Какие свойства у спиртов

Спирты — органические соединения, в состав молекул которых входит одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
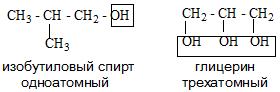
По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные трехатомные и т. д.
| Одноатомные спирты: | Двухатомный спирт: | Трехатомный спирт: | |
| CH3—OH метанол (метиловый спирт) | CH3CH2—OH этанол (этиловый спирт) | HO—CH2—CH2—OH этандиол-1,2 (этиленгликоль) | пропантриол-1,2,3 (глицерин) |
Одноатомные спирты
Общая формула одноатомных спиртов — R—OH.
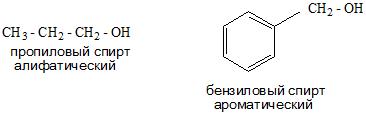
По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
| Предельный спирт: | Непредельный спирт: | Ароматический спирт: |
| CH3CH2CH2—OH пропанол-1 (пропиловый спирт) | CH2=CH—CH2—OH пропенол-2,1 (аллиловый спирт) | C6H5—CH2—OH фенилметанол (бензиловый спирт) |
Общая формула предельных одноатомных спиртов — CnN2n+1—OH.
Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH — гидроксобензол (фенол).
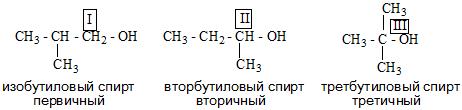
По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R’) и третичные (RR’R»C—OH) спирты.
CnN2n+2O — общая формула и предельных одноатомных спиртов, и простых эфиров.
Предельные одноатомные спирты изомерны простым эфирам — соединениям с общей формулой R—O—R’.
| г о м о л о г и | CH3OH метанол | |||||
| CH3CH2OH этанол | CH3OCH3 диметиловый эфир | |||||
| CH3CH2CH2OH пропанол-1 | пропанол-2 | CH3OCH2CH3 метилэтиловый эфир | ||||
| CH3(CH2)3OH бутанол-1 | бутанол-2 | 2-метил-пропанол-2 | 2-метил-пропанол-1 | CH3OCH2CH2CH3 метилпропиловый эфир | CH3CH2OCH2CH3 диэтиловый эфир | |
| и з о м е р ы | ||||||
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия.
Алгоритм составления названий одноатомных спиртов
- Найдите главную углеродную цепь — это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
- Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей:
С этим же связана и хорошая растворимость в воде низших спиртов.
Простейшие спирты — жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных — больше, чем у третичных. Метанол крайне ядовит.
Химические свойства спиртов
- Горение:
C2H5OH + 3O2 2CO2 +3H2O + Q
- Реакции с щелочными и щелочноземельными металлами («кислотные» свойства):
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов («замещаться» на них).2Na + 2H—O—H 2NaOH + H2
2Na + 2R—O—H 2RONa + H2Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд (+). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей.
Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать на себя электронную пару связи RO.
Атом кислорода как бы «насыщается», и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды (+ на атоме водорода меньше, чем в молекуле воды).
В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее.
Иногда, основываясь на этом, говорят, что кислотные свойства спиртов выражены слабее, чем кислотные свойства воды.
Из-за влияния радикала кислотные свойства спиртов убывают в ряду
метанол первичные спирты вторичные спирты третичные спирты
С твердыми щелочами и с их растворами спирты не реагируют.
- Реакции с галогеноводородами:
C2H5OH + HBr C2H5Br + H2O
- Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH C2H4 + H2O
- Межмолекулярная дегидратация (t oС, образуются простые эфиры):
2C2H5OH C2H5OC2H5 + H2O
- Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO CH3—CHO + Cu + H2O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный «фруктовый» запах альдегида).
Получение спиртов
- Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH C2H5OH + NaCl.
- Гидратация алкенов: C2H4 + H2O C2H5OH.
- Брожение глюкозы : C6H12O6 2C2H5OH + 2CO2.
- Синтез метанола: CO + 2H2 CH3OH
Многоатомные спирты
Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль)
HO—CH2—CH2—OH
и трехатомный спирт пропантриол-1,2,3 (глицерин)
HO—CH2—CH(OH)—CH2—OH.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее.
Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na2[Cu(C3H6O3)2].
Фенолы
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия — гидроксибензол, оксибензол) C6H5—OH.
Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
Химические свойства
- Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na 2C6H5ONa + H2 фенолят натрия C6H5OH + NaOH C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
- Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто— и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
а) Реакция с бромной водой (качественная реакция):
Образуется 2,4,6-трибромфенол — осадок белого цвета.
б) Нитрование (при комнатной температуре):
C6H5—OH + HNO3(разб.) H2O + O2N—C6H4—OH (смесь орто— и пара-изомеров)
По вторй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
- Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
- Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
Задачи и тесты по теме «Тема 4. «Спирты. Фенолы».»
Рекомендации к теме
Изучив тему, Вы должны усвоить понятия: функциональная группа, спирты, фенолы, одноатомные спирты, многоатомные спирты, предельные спирты, ароматические спирты.
Проверьте, знаете ли вы общие формулы одноатомных предельных спиртов и простых эфиров. Проверьте, знаете ли вы формулы метанола, этанола, фенола, этиленгликоля, глицерина. Проверьте, знаете ли вы правила номенклатуры одноатомных предельных спиртов; объяснение растворимости спиртов в воде и значительно более высокие температуры кипения по сравнению с соответствующими углеводородами; в чём выражаются кислотные свойства спиртов и фенолов; качественные реакции на многоатомные спирты, фенол, этанол.
Проверьте, умеете ли Вы производить расчеты по уравнениям реакций с учетом выхода продукта.
Пример. Определите объем этилена, который можно получить при дегидратации 92 г этилового спирта, если выход продукта составляет 50 %.
Ответ: 22,4 л
Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:
- О. С. Габриелян и др. Химия 10 кл. М., Дрофа, 2002;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 кл. М., Просвещение, 2001.
- Г. Г. Лысова. Опорные конспекты и тесты по органической химии. М., ООО «Глик плюс», 1999.
Слово «спирт» знакомо всем, но далеко не все знают, что на латыни оно происходит от слова «Дух» – «Spiritus». Такое необычное и немного пафосное название дали спирту его первооткрыватели, алхимик Жа-бир и александриец Зосим де Панополис, работающие при дворе египетского халифа. Именно им впервые удалось выделить спирт из вина при помощи дистилляционного аппарата. Эти ученые древности свято верили, что им удалось получить сам дух вина. С тех пор многие ученые (сперва алхимики, а потом и просто химики) разных исторических эпох занимались изучением спирта и его физических и химических свойств. Так что в наше время спирты занимают видное и важное место в органической химии, и о них наша сегодняшняя статья.
Спирты являются важными органическими и кислородосодержащими соединениями, которые содержат гидроксильную группу OH. Также все спирты делятся на одноатомные и многоатомные. Значение спиртов в химии, да и не только в ней просто таки огромно, спирты активно применяются в химической, косметической и пищевой промышленности (да-да, и для создания алкогольных напитков в том числе, но и далеко не только для них).
История открытия спирта
История спирта уходят корнями в глубокую древность, ведь согласно археологическим находкам уже 5000 лет тому назад люди умели делать алкогольные напитки: вино и пиво. Делать то умели, но не до конца понимали, какой же такой волшебный элемент имеется в этих напитках, который делает их хмельными. Тем не менее, пытливые умы ученых прошлого не раз пытались выделить из вина этот волшебный компонент, отвечающий за его алкогольность (или крепость, как мы говорим сейчас).
И вскоре обнаружилось, что спирт можно выделить при помощи процесса дистилляции жидкости. Дистилляция спирта это такой химический процесс в ходе, которого летучие компоненты (пары) испаряются, а из перебродившей смеси и получается спирт. К слову сам процесс дистилляции впервые был описан великим ученым и натурфилософом Аристотелем. На практике же получить спирт при помощи дистилляции удалось алхимикам Жа-биру и Зосим де Панополису, именно они, как мы уже писали вначале, и дали спирту его название – «spiritus vini» (дух вина), который со временем стал просто спиртом.
Алхимики более поздних времен усовершенствовали процесс дистилляции и получения спирта, например французский врач и алхимик Арно де Вильгерр в 1334 году разработал удобную технологию получения винного спирта. А уже с 1360 года его наработки переняли итальянские и французские монастыри, которые начали активно производить спирт, называемый ими «Aqua vita» – «живая вода».

В 1386 году «живая вода» впервые попала в Россию (точнее Московию, как тогда называли это государство). Привезенный генуэзским посольством в качестве презента царскому двору спирт очень понравился тамошним боярам (впрочем, и не только боярам). А «живая вода» впоследствии стала основой всем известного алкогольного напитка (употреблять который мы вам, однако, решительно не рекомендуем).
Но вернемся к химии.
Классификация спиртов
На самом деле существует множество разных видов спиртов, которых химики делят в зависимости от:
- Количества функциональных групп в молекуле. Есть одноатомные и многоатомные спирты. К многоатомным спиртам относятся алкоголи и гликоли.
- Алкоголи в свою очередь делятся на первичные, вторичные и третичные.
- И в зависимости от строения углеводородного радикала существуют алифатические и ароматические спирты, а также предельные и непредельные соединения.
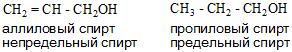
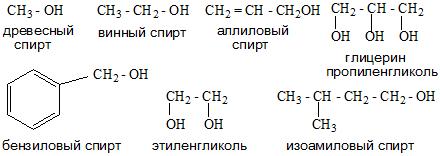
Номенклатура спиртов
Номенклатура одноатомных спиртов, как и многоатомных, зависит от названия окружающих радикалов и строения их молекул. Например:
- Тривиальная.
- Систематическая. Она основана на характеристике радикала и выборе углеродной цепи.
- Карбинольная. В основе ее фигурирует название карбинол. На данный момент является устаревшей.

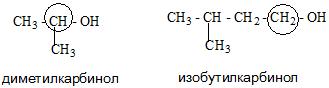
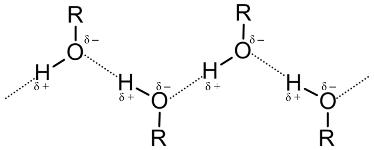
Физические свойства спиртов
Низкомолекулярный спирт – это обычно бесцветная жидкость, имеющая при этом резкий и характерный запах. Температура кипения спирта выше, нежели у других органических соединений. Это обусловлено тем, что в молекулах спиртов имеется особый вид взаимодействий – водородные связи. Вот как они выглядят.
Химические свойства спиртов
По причине своего строения спирты проявляют амфотерные свойства: основные и кислотные, далее детально на них остановимся:
- Кислотные свойства спиртов проявляются в способности отщепления протона гидроксигруппы. По мере роста длины углеродной цепи, объема ее радикала, а также степени разветвления и наличия в молекуле доноров, кислотность уменьшается.
- Основные свойства спиртов являются обратными к их кислотным свойствам, так как они выражаются в их способности, наоборот, присоединить протон.
Алкоголи и гликоли имеют особенность вступать в химические реакции замещения, отщепления и окисления. Опишем их детальнее:
- Реакции замещения протекают с образованием солей (алкоголятов и гликолятов металлов), а также сложных эфиров и галогенопроизводных.
- Реакции отщепления происходят по внутримолекулярному или межмолекулярному типу с отщеплением воды и получением алкенов и простых эфиров.
- Во время реакций окисления спиртов образуются оксосоединения (альдегиды и кетоны).
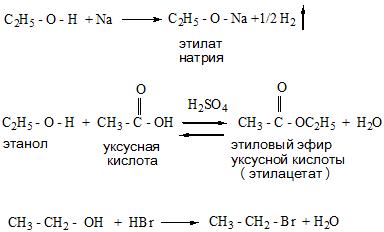
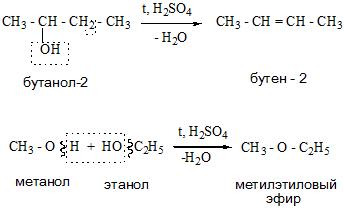
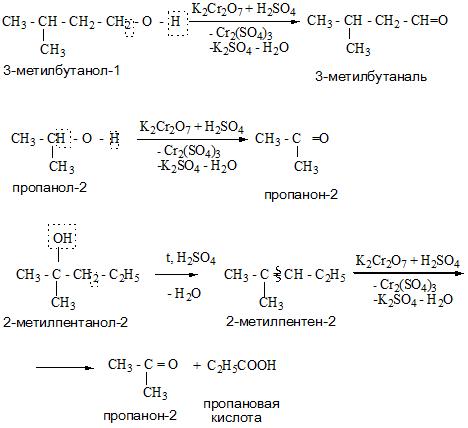
Получение спиртов
Одноатомные спирты можно получить из алкенов, сложных эфиров, оксосоединений, карбоновых кислот и галогенопроизводных.
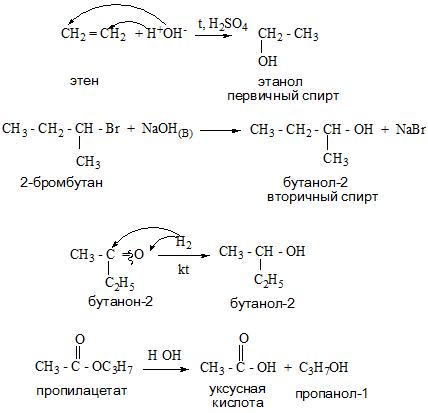
А вот спирт этанол можно получить при помощи брожения сахаристых веществ, химическая реакция будет иметь такой вид.

Многоатомные спирты образуются из многоосновных кислот, сложных эфиров, алкенов и оксосоединений.
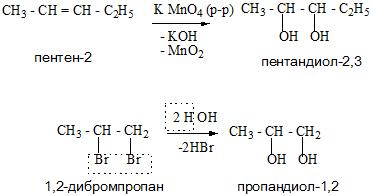
А для получения глицерина можно применить гидролиз в кислой среде триацилглицеринов – основных компонентов липидной фракции жиров и растительных масел.
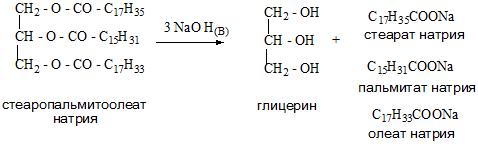
Применение спиртов
Помимо алкогольных напитков разной крепости спирты применяются в косметологии при создании разных косметических средств (например, тех же одеколонов), и, разумеется, в медицине, как при создании разных лекарств, эфиров, так и в бытовом применении спирт может служить дезинфицирующим средством.
Спирты, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Îäíîàòîìíûå ñïèðòû – ýòî ïðîèçâîäíûå óãëåâîäîðîäîâ, â êîòîðûõ îäèí àòîì âîäîðîäà çàìåùåí íà ãèäðîêñè- ãðóïïó. Îáùàÿ ôîðìóëà ñïèðòîâ – CnH2n+1OH.
Êëàññèôèêàöèÿ îäíîàòîìíûõ ñïèðòîâ.
 çàâèñèìîñòè îò ïîëîæåíèÿ, ãäå ðàñïîëîæåíà ÎÍ-ãðóïïà, ðàçëè÷àþò:
— ïåðâè÷íûå ñïèðòû:

— âòîðè÷íûå ñïèðòû:

— òðåòè÷íûå ñïèðòû:
 .
.
Èçîìåðèÿ îäíîàòîìíûõ ñïèðòîâ.
Äëÿ îäíîàòîìíûõ ñïèðòîâ õàðàêòåðíà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà è èçîìåðèÿ ïîëîæåíèÿ ãèäðîêñè-ãðóïïû.
Ôèçè÷åñêèå ñâîéñòâà îäíîàòîìíûõ ñïèðòîâ.
Ñïèðòû ñ êîëè÷åñòâîì àòîìîâ óãëåðîäà ìåíüøå 15 ïðåäñòàâëÿþò ñîáîé æèäêîñòè, à ñ áîëüøèì êîëè÷åñòâîì – òâåðäûå âåùåñòâà.
Ìåòàíîë, ýòàíîë è ïîïàíîë -2 õîðîøî ñìåøèâàþòñÿ ñ âîäîé â íåîãðàíè÷åííûõ êîëè÷åñòâàõ, ÷åãî íå ìîãóò ñïèðòû ñ áîëüøåé àòîìíîé ìàññîé è áîëüøèì óãëåâîäîðîäíûì ðàäèêàëîì. Ñïèðòû èìåþò âûñîêèå òåìïåðàòóðû êèïåíèÿ è ïëàâëåíèÿ, ÷òî ãîâîðèò îá îáðàçîâàíèè âîäîðîäíûõ ñâÿçåé.
Ïîëó÷åíèå îäíîàòîìíûõ ñïèðòîâ.
1. Ãèäðàòàöèÿ àëêåíîâ (ïðîìûøëåííûé ñïîñîá). Ðåàêöèÿ ïðîòåêàåò ïîä âîçäåéñòâèåì ôîñôîðíîêèñëîãî êàòàëèçàòîðà è ïðè ïðîïóñêàíèè ÷åðåç ïàðû âîäû:

Ðåàêöèÿ èäåò ïî ïðàâèëó Ìàðêîâíèêîâà, ïîýòîìó èç ïåðâè÷íûõ àëêåíîâ ìîæíî ïîëó÷èòü òîëüêî ïåâè÷íûé ñïèðò.
2. Ãèäðîëèç àëêèëãàëîãåíèäîâ ïðè âîçäåéñòâèè âîäíûõ ðàñòâîðîâ ùåëî÷åé:

3. Âîññòàíîâëåíèå êàðáîíèëüíûõ ñîåäèíåíèé. Ïðè âîññòàíîâëåíèè àëüäåãèäîâ ïîëó÷àþòñÿ ïåðâè÷íûå ñïèðòû, êåòîíîâ – âòîðè÷íûå:

Ðåàêöèÿ ïðîòåêàåò â ïðèñóòñòâèå íèêåëåâîãî êàòàëèçàòîðà.
4. Ýòàíîë ìîæíî ïîëó÷èòü â ðåçóëüòàòå ñïèðòîâîãî áðîæåíèÿ ãëþêîçû:

Õèìè÷åñêèå ñâîéñòâà îäíîàòîìíûõ ñïèðòîâ.
Õèìè÷åñêèå ñâîéñòâà îáóñëàâëèâàþò ãèäðîêñèëüíûå ãðóïïû. Ðåàêöèè ìîãóò ïðîòåêàòü â 2õ íàïðàâëåíèÿõ:
Ðåàêöèè ñ ðàçðûâîì Î-Í ñâÿçè:
À) äåéñòâèå íà ñïèðòû ìèíåðàëüíûõ è îðãàíè÷åñêèõ êèñëîò, â ðåçóëüòàòå ÷åãî îáðàçóþòñÿ ñëîæíûå ýôèðû:

Ñïåöèôè÷åñêàÿ îñîáåííîñòü îäíîàòîìíûõ ñïèðòîâ: àòîì âîäîðîäà îòùåïëÿåòñÿ îò ñïèðòà, à ãèäðîêñè-ãðóïïà – îò êèñëîòû.
Á) Íèçøèå ñïèðòû âçàèìîäåéñòâóþò ñ ùåëî÷íûìè ìåòàëëàìè î÷åíü áóðíî, à ñ ùåëî÷àìè íå ðåàãèðóþò. Ñ ðîñòîì ðàäèêàëà ñêîðîñòü ðåàêöèè ïàäàåò:

Â) Ïîä äåéñòâèåì ïåðìàíãàíàòà èëè äèõðîìàòà êàëèÿ ñïèðòû îêèñëÿþòñÿ, ïðè÷åì ïåðâè÷íûå – äî àëüäåãèäîâ, à âòîðè÷íûå ïðåâðàùàþòñÿ â êåòîíû:


Òðåòè÷íûå ñïèðòû îêèñëÿþòñÿ ñ ðàçðûâîì Ñ-Ñ ñâÿçè.
Ðåàêöèè ñ ðàçðûâîì Ñ-Î ñâÿçè:
À) äåãèäðàòàöèÿ. Ðåàêöèÿ èäåò ïðè íàãðåâàíèè è ïðè ó÷àñòèè âîäîîòíèìàþùåãî àãåíòà äî îáðàçîâàíèÿ àëêåíà:

Åñëè íàãðåâ ñëàáûé, òî ïðîèñõîäèò âíóòðèìîëåêóëÿðíàÿ äåãèäðàòàöèÿ, â ðåçóëüòàòå ÷åãî îáðàçóþòñÿ ïðîñòûå ýôèðû:

Á) Ñïèðòû ìîãóò ðåàãèðîâàòü ñ ãàëîãåíâîäîðîäàìè, ïðè÷åì òðåòè÷íûå ñïèðòû ðåàãèðóþò î÷åíü áûñòðî, à ïåðâè÷íûå è âòîðè÷íûå — ìåäëåííî:

Ïðèìåíåíèå îäíîàòîìíûõ ñïèðòîâ.
Ñïèðòû èñïîëüçóþò ïðåèìóùåñòâåííî â ïðîìûøëåííîì îðãàíè÷åñêîì ñèíòåçå, â ïèùåâîé ïðîìûøëåííîñòè, â ìåäèöèíå è ôàðìàöèè.
