Какие свойства теплового движения молекул газа отражает распределение максвелла
Пусть имеется n тождественных молекул, находящихся в состоянии беспорядочного теплового движения при определенной температуре. После каждого акта столкновения между молекулами, их скорости меняются случайным образом. В результате невообразимо большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным.
В результате каждого столкновения проекции скорости молекулы испытывают случайное изменение на Δυx, Δυy, Δυz, причем изменения каждой проекции скорости независимы друг от друга. Будем предполагать, что силовые поля на частицы не действуют. Найдем в этих условиях, каково число частиц dn из общего числа n имеет скорость в интервале от υ до υ+Δυ. При этом мы не можем ничего определенного сказать о точном значении скорости той или иной частицы υi, поскольку за столкновениями и движениями каждой из молекул невозможно проследить ни в опыте, ни в теории. Такая детальная информация вряд ли имела бы практическую ценность.
Распределение молекул идеального газа по скоростям впервые было получено знаменитым английским ученым Дж. Максвеллом в 1860 году с помощью методов теории вероятностей.
 | Максвелл Джеймс Клерк (1831 – 1879) – английский физик. Работы посвящены электродинамике, молекулярной физике, общей статике, оптике, механике, теории упругости. Установил статистический закон, описывающий распределение молекул газа по скоростям. Самым большим достижением Максвелла является теория электромагнитного поля, которую он сформулировал в виде системы нескольких уравнений, выражающих все основные закономерности электромагнитных явлений. |
Вывод формулы функции распределения молекул по скоростям есть в учебнике Ю.И Тюрина и др. (ч. 1) или И.В. Савельева (т. 1). Мы воспользуемся результатами этого вывода.
Скорость – векторная величина. Для проекции скорости на ось х (x-й составляющей скорости) из (2.2.1) имеем
тогда
| (2.3.1) |
где А1 – постоянная, равная
Графическое изображение функции показано на рисунке 2.2. Видно, что доля молекул со скоростью не равна нулю. При , (в этом физический смысл постоянной А1).

Рис. 2.2
Приведённое выражение и график справедливы для распределения молекул газа по x-компонентам скорости. Очевидно, что и по y— и z-компонентам скорости также можно получить:
Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x-компонента скорости лежит в интервале от υх до υх+dυх; y-компонента, в интервале от υy до υy+dυy; z-компонента, в интервале от υz до υz+dυz будет равна произведению вероятностей каждого из условий (событий) в отдельности:
где , или
| (2.3.2) |
Формуле (2.3.2) можно дать геометрическое истолкование: dnxyz – это число молекул в параллелепипеде со сторонами dυx, dυy, dυz, то есть в объёме dV=dυxdυydυz(рис. 2.3), находящемся на расстоянии от начала координат в пространстве скоростей.
Эта величина (dnxyz) не может зависеть от направления вектора скорости . Поэтому надо получить функцию распределения молекул по скоростям независимо от их направления, то есть по абсолютному значению скорости.
Если собрать вместе все молекулы в единице объёма, скорости которых заключены в интервале от υ до υ+dυ по всем направлениям, и выпустить их, то они окажутся через одну секунду в шаровом слое толщиной dυ и радиусом υ (рис. 2.4). Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше.
 | |||
| Рис. 2.3 | Рис. 2.4 | ||
Объём этого шарового слоя
Общее число молекул в слое, как следует из (2.3.2)
Отсюда следует закон распределения молекул по абсолютным значениям скоростей Максвелла:
| (2.3.3) |
где – доля всех частиц в шаровом слое объема dV, скорости которых лежат в интервале от υ до υ+dυ.
При dυ = 1 получаем плотность вероятности, или функцию распределения молекул по скоростям:
| (2.3.4) |
Эта функция обозначает долю молекул единичного объёма газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость.
Обозначим: тогда из (2.3.4) получим:
| (2.3.5) |
График этой функции показан на рисунке 2.5.

Рис. 2.5
Выводы:
- Вид распределения молекул газа по скоростям для каждого газа зависит от рода газа (m) и от параметра состояния (Т). Давление P и объём газа V на распределение молекул не влияют.
- В показателе степени стоит отношение , т.е. кинетической энергии, соответствующей данной скорости υ к (kТ) – средней энергии теплового движения молекул при данной температуре, значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при данной температуре иметь именно такое значение кинетической энергии).
Рассмотрим пределы применимости классического описания распределения частиц по скоростям. Для этого воспользуемся соотношением неопределенностей Гейзенберга. Согласно этому соотношению координаты и импульс частицы не могут одновременно иметь определенное значение. Классическое описание возможно, если выполнены условия:
Здесь – постоянная Планка – фундаментальная константа, определяющая масштаб квантовых (микроскопических) процессов.
Таким образом, если частица находится в объеме , то в этом случае возможно описание ее движения на основе законов классической механики.
Наиболее вероятная, среднеквадратичная
и средняя арифметическая скорости молекул газа
Рассмотрим, как изменяется с абсолютной величиной скорости число частиц, приходящихся на единичный интервал скоростей, при единичной концентрации частиц.
График функции распределения Максвелла
| , |
приведен на рисунке 2.6.

Рис. 2.6
Из графика видно, что при «малых» υ, т.е. при , имеем ; затем достигает максимума А и далее экспоненциально спадает .
Величину скорости, на которую приходится максимум зависимости , называют наиболее вероятной скоростью.
Найдем эту скорость из условия равенства производной .
| , | (2.3.6) |
– наиболее вероятная скорость одной молекулы.
Для одного моля газа:
| . | (2.3.7) |
Среднюю квадратичную скорость найдем, используя соотношение :
| . | – для одной молекулы; | (2.3.8) |
| . | – для одного моля газа. | (2.3.9) |
Средняя арифметическая скорость:
| . | . |
где – число молекул со скоростью от υ до υ+dυ. Если подставить сюда f(υ) и вычислить, то получим:
| . | – для одной молекулы; | (2.3.10) |
| . | – для одного моля газа. | (2.3.11) |
Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
Формула Максвелла для относительных скоростей
Для решения многих задач удобно использовать формулу Максвелла, где скорость выражена в относительных единицах.
Относительную скорость обозначим через u:
| (2.3.12) |
где . Тогда из (2.3.3), получим
| . | (2.3.13) |
Это уравнение универсальное. В таком виде функция распределения не зависит ни от рода газа, ни от температуры.
На рисунке 2.7 показано максвелловское распределение частиц f(υ), имеющих скорости от υ до υ+dυ. За единицу скорости здесь взята наиболее вероятная скорость.
Полезно знать, что .

Рис. 2.7
Зависимость функции распределения Максвелла от массы молекул и температуры газа
На рисунке 2.8 показана зависимость f(υ) при различных температурах и массах молекул газа.

Рис. 2.8
Из рисунка 2.8 можно проследить за изменением f(υ) при изменении m и T. В данном случае (при T = const ) или (при m = const). Площадь под кривой величина постоянная, равная единице (), поэтому важно знать как будет изменяться положение максимума кривой:
Максвелловский закон распределения по скоростям и все вытекающие следствия справедливы только для газа в равновесной системе. Закон статистический, и выполняется тем лучше, чем больше число молекул.
Определение 1
С помощью закона распределения молекул по скоростям мы можем описать, как именно в макроскопической системе происходит распределение частиц (при условии ее нахождения в термодинамическом равновесии). Такое распределение называется стационарным, и воздействия внешних сил на систему при этом не происходит.
Данный закон распространяется как на жидкости, так и на газы, если на них действуют законы классической механики. Если мы знаем, как именно распределяются молекулы по своим скоростям, значит, мы можем ответить, какой объем молекул имеет определенную скорость в условиях заданной температуры в равновесном состоянии.
Чтобы лучше объяснить данный вопрос, начнем с введения такого понятия, как пространство скоростей. Оно изображено схематически на рисунке 1.
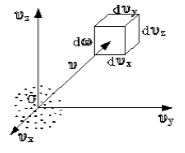
Рисунок 1
Мы видим, что в декартовой системе координат здесь отмечены именно проекции скоростей, а не координаты. Тогда исходный вопрос можно переформулировать так: «Как именно будут распределяться молекулы в пространстве скоростей»?
Очевидно, что данное распределение не будет равномерным. Если в пространстве мы выделим параллелепипед, имеющий объем dω=dυxdυydυz, то в нем окажется dNυ молекул. Обозначим буквой N число молекул газа, тогда f(v) будет некоторой функцией скорости.
Распределение Максвелла
Поскольку, как мы уже отмечали, газ находится в равновесном состоянии, то направления движений частиц являются равноправными. Значит, допустимо считать, что в пространстве скоростей распределение молекул является симметричным и имеет сферическую форму.
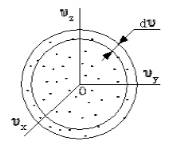
Рисунок 2
Определим, из скольких молекул состоит шаровой слой dυ. Разделим найденное выше число на количество частиц (N) и получим вероятность dWυ того, что пределы модуля скорости молекулы равны υ — υ+dv.
Здесь F(v) является функцией распределения вероятности значения v. Впервые данная функция теоретически была получена Д. Максвеллом.
Определение 2
Таким образом, закон распределения молекул по модулям скоростей имеет следующий вид:
dNυ=N4πm02πkT32exp-m0υ22kTυ2dυ.
Здесь υ=υx2+υy2+υz2, масса молекулы равна m0, а k – постоянная Больцмана.
По проекциям скоростей распределение Максвелла может быть записано так:
dN=Nfυxfυyfυzdυxdυydυz.
Важно учесть, что:
fυi=m02πkT12exp-m0υi22kT (i=x,y,z).
Параметры υx, υy, υz означают проекции скоростей молекул на оси координат.
Также возможен следующий вариант записи распределения Максвелла:
dN=N4πυver3exp-υυver2υ2dυ.
Здесь υυer обозначает наиболее вероятную скорость движения молекулы.
Как выглядит распределение Максвелла на графике
Кривая распределения молекул по скоростям на графике выглядит так:
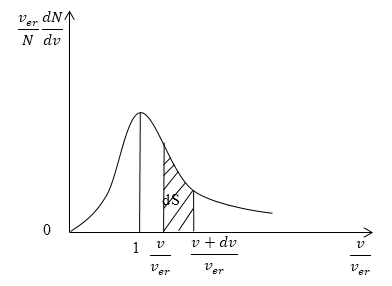
Рисунок 3
При этом доля тех молекул, которые движутся со скоростями в интервале от υ до υ+dυ будет пропорциональна площади dS, которая на графике обозначена штриховкой.
Определение 3
Скорости всех молекул принадлежат интервалу от нуля до плюс бесконечности, значит, будет верным равенство:
∫0∞f(υ)dυ=1.
Оно называется условием нормировки функции распределения.
Следовательно, распределение Максвелла по скоростям имеет зависимость от температуры газа и массы его молекул. Объем и давление можно не учитывать.
Пример 1
Условие: вычислите, какова будет наиболее вероятная скорость молекул газа при температуре Т в равновесном состоянии.
Решение
Нам потребуется распределение Максвелла (распределение по модулям скоростей).
dNυ=N4πm02πkT32exp-m0υ22kTυ2dυ.
Максимум функции будет соответствовать самой вероятной скорости. Дифференциация выражения по скорости и сравнение ее с нулем даст нам следующий результат:
dNυdυ=N4πm02πkT322υυerexp-m0υυer22kT-υυer2m02υυer2kTexp-m0υυer22kT=0;
2υυer-υυer2m02υυer2kT=0→1-υυer2m02kT=0→υυer2=2kTm0.
υυer=2kTm0.
Ответ: наиболее вероятно, что скорость газа будет равна υυer=2kTm0.
Пример 2
Условие: изобразите кривые распределения скоростей молекул газа при росте температуры Т.
Решение
Возьмем формулу наиболее вероятной скорости из предыдущей задачи.
υυer=2kTm0
Понятно, что чем больше будет температура, тем выше будет скорость молекул, т.е. произойдет смещение максимума в сторону больших скоростей. Поскольку площадь под кривой распределения является постоянной величиной, кривые на графике будут показаны следующим образом:
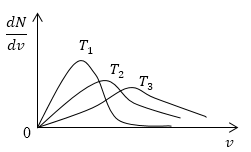
Рисунок 4
Пример 3
Условие: дан график функции, по которой молекулы будут распределяться с учетом проекций скорости υx. Сопоставьте количества молекул, проекции скорости которых будут принадлежать интервалам от нуля до υx1 и от υx1 до υx2.
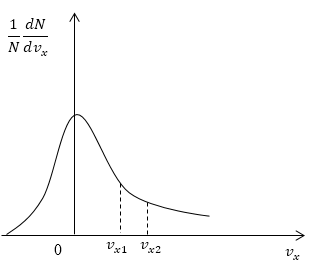
Рисунок 5
Решение
Как мы уже указывали ранее, доля молекул газа, скорости которых лежат в первом интервале, будет пропорциональна площади фигуры, образуемой кривой распределения, вертикальной осью 0 1NdNdυx и вертикальным пунктиром, перпендикулярным оси проекций. Во втором интервале нужная доля будет пропорциональна площади фигуры, ограниченной кривой распределения и вертикальной прямой, параллельной оси ох и проходящей через точку υx1. Очевидно, что площадь первой фигуры будет меньше площади второй. Значит, и молекул, проекции скоростей которых лежат в первом интервале, будет меньше, чем во втором.
Ответ: молекул, имеющих проекции скорости в интервалах: от 0 до υx1 меньше, чем молекул, имеющих проекции скорости в интервалах: от υx1 до υx2.
Вывод формулы функции распределения молекул по скоростям есть в учебнике Ю.И Тюрина и др. (ч. 1) или И.В. Савельева (т. 1). Мы воспользуемся результатами этого вывода.
Скорость – векторная величина. Для проекции скорости на ось х (x-й составляющей скорости) из (2.2.1) имеем
тогда
| (2.3.1) |
где А1 – постоянная, равная
Графическое изображение функции показано на рисунке 2.2. Видно, что доля молекул со скоростью не равна нулю. При , (в этом физический смысл постоянной А1).
Рис. 2.2
Приведённое выражение и график справедливы для распределения молекул газа по x-компонентам скорости. Очевидно, что и по y— и z-компонентам скорости также можно получить:
Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x-компонента скорости лежит в интервале от υх до υх+dυх; y-компонента, в интервале от υy до υy+dυy; z-компонента, в интервале от υz до υz+dυz будет равна произведению вероятностей каждого из условий (событий) в отдельности:
где , или
| (2.3.2) |
Формуле (2.3.2) можно дать геометрическое истолкование: dnxyz – это число молекул в параллелепипеде со сторонами dυx, dυy, dυz, то есть в объёме dV=dυxdυydυz(рис. 2.3), находящемся на расстоянии от начала координат в пространстве скоростей.
Эта величина (dnxyz) не может зависеть от направления вектора скорости . Поэтому надо получить функцию распределения молекул по скоростям независимо от их направления, то есть по абсолютному значению скорости.
Если собрать вместе все молекулы в единице объёма, скорости которых заключены в интервале от υ до υ+dυ по всем направлениям, и выпустить их, то они окажутся через одну секунду в шаровом слое толщиной dυ и радиусом υ (рис. 2.4). Этот шаровой слойскладывается из тех параллелепипедов, о которых говорилось выше.
| Рис. 2.3 | Рис. 2.4 | ||
Объём этого шарового слоя
Общее число молекул в слое, как следует из (2.3.2)
Отсюда следует закон распределения молекул по абсолютным значениям скоростей Максвелла:
| (2.3.3) |
где – доля всех частиц в шаровом слое объема dV, скорости которых лежат в интервале от υ до υ+dυ.
При dυ = 1 получаем плотность вероятности, или функцию распределения молекул по скоростям:
| (2.3.4) |
Эта функция обозначает долю молекул единичного объёма газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость.
Обозначим: тогда из (2.3.4) получим:
| (2.3.5) |
График этой функции показан на рисунке 2.5.
Рис. 2.5
Выводы:
- Вид распределения молекул газа по скоростям для каждого газа зависит от рода газа (m) и от параметра состояния (Т). Давление P и объём газа V на распределение молекул не влияют.
- В показателе степени стоит отношение , т.е. кинетической энергии, соответствующей данной скорости υ к (kТ) – средней энергии теплового движения молекул при данной температуре, значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при данной температуре иметь именно такое значение кинетической энергии).
Рассмотрим пределы применимости классического описания распределения частиц по скоростям. Для этого воспользуемся соотношением неопределенностей Гейзенберга. Согласно этому соотношению координаты и импульс частицы не могут одновременно иметь определенное значение. Классическое описание возможно, если выполнены условия:
Здесь – постоянная Планка – фундаментальная константа, определяющая масштаб квантовых (микроскопических) процессов.
Таким образом, если частица находится в объеме , то в этом случае возможно описание ее движения на основе законов классической механики.
Наиболее вероятная, среднеквадратичная и средняя арифметическая скорости молекул газа
Рассмотрим, как изменяется с абсолютной величиной скорости число частиц, приходящихся на единичный интервал скоростей, при единичной концентрации частиц.
График функции распределения Максвелла
| , |
приведен на рисунке 2.6.
Рис. 2.6
Из графика видно, что при «малых» υ, т.е. при , имеем ; затем достигает максимума А и далее экспоненциально спадает .
Величину скорости, на которую приходится максимум зависимости , называют наиболее вероятной скоростью.
Найдем эту скорость из условия равенства производной .
| , | (2.3.6) |
– наиболее вероятная скорость одной молекулы.
Для одного моля газа:
| . | (2.3.7) |
Среднюю квадратичную скорость найдем, используя соотношение :
| . | – для одной молекулы; | (2.3.8) |
| . | (2.3.9) |
Средняя арифметическая скорость:
| . | . |
где – число молекул со скоростью от υ до υ+dυ. Если подставить сюда f(υ) и вычислить, то получим:
| . | – для одной молекулы; | (2.3.10) |
| . | (2.3.11) |
Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
Формула Максвелла для относительных скоростей
Для решения многих задач удобно использовать формулу Максвелла, где скорость выражена в относительных единицах.
Относительную скорость обозначим через u:
| (2.3.12) |
где . Тогда из (2.3.3), получим
| . | (2.3.13) |
Это уравнение универсальное. В таком виде функция распределения не зависит ни от рода газа, ни от температуры.
На рисунке 2.7 показано максвелловское распределение частиц f(υ), имеющих скорости от υ до υ+dυ. За единицу скорости здесь взята наиболее вероятная скорость.
Полезно знать, что .
Рис. 2.7
Зависимость функции распределения Максвелла от массы молекул и температуры газа
На рисунке 2.8 показана зависимость f(υ) при различных температурах и массах молекул газа.
Рис. 2.8
Из рисунка 2.8 можно проследить за изменением f(υ) при изменении m и T. В данном случае (при T = const ) или (при m = const). Площадь под кривой величина постоянная, равная единице (), поэтому важно знать как будет изменяться положение максимума кривой:
Максвелловский закон распределения по скоростям и все вытекающие следствия справедливы только для газа в равновесной системе. Закон статистический, и выполняется тем лучше, чем больше число молекул.
