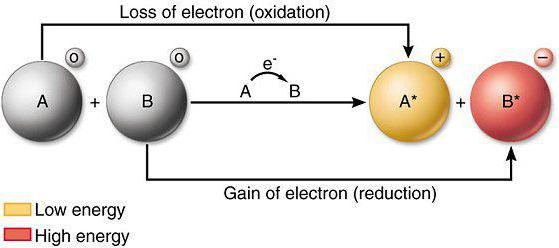
Какие свойства проявляют металлы восстановительные или окислительные

Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

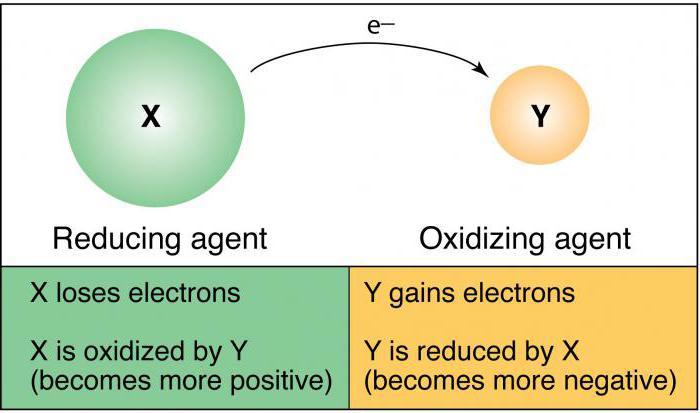
Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
— S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn+7 принимает 5 e = Mn+2 2 является окислителем,
— 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
— Mn+7 принимает 5 e= Mn+2 2,
— S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
— нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
— Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
— 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Положение в
периодической системе
1. Типичные металлы – s- элементы: IА-IIА группы (искл.Н)
2. Нетипичные металлы: р-элементы: IIIА гр. (кроме
В), IV гр – Ge, Sn,Pb; Vгр.- Sb,Bi; VI гр.-Po.
3. Переходные металлы: d-элементы – все элементы побочных
подгрупп; f- элементы: лантоноиды,
актиноиды.
У атомов металлов небольшое количество электронов (ē) на внешнем
энергетическом уровне и большие радиусы атомов (R)
Кристаллическая
решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов,
внутри-общие электроны– «электронный газ».
Тип
химической связи – металлическая.
Металлические
(восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома, иэлектроны легче
отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего
уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba,
Ca, Na, Mg, Al, Mn, Cr, Zn,
Fe, Cd, Co, Sn,
Ni, Pb, H2, Cu, Ag,
Hg, Pt, Au
Физические свойства
Наличие
свободных электронов обуславливает:
- Металлический
блеск (непрозрачность)-ē отражают световые лучи, большинство металлов в порошкообразном состоянии теряют свой блеск, за исключением алюминия и магния. - Цвет Большинство металлов светло-серого цвета (Исключение: золото — желтое, медь- красная, цезий — светло-желтый)
- Электропроводность
(свободные ē приобретают направленное движение) Лучшие проводники электричества: Cu, Ag, далее Au,Al,Fe. С повышением
температуры – электропроводность понижается, т.к. усиливаются колебания атомов, электронам трудно
перемещаться. - Теплопроводность
- Пластичность
- Плотность ( Самый легкий — Li, самые тяжелые — Os и Ir)
- Температура плавления ( самый легкоплавкий — Hg −39 °C , самый тугоплавкий – W 3410 °C )
- Твердость (щелочные металлы можно резать ножом, самый твердый – Cr) Большинство металлов твердые, за исключением ртути и ,условно, франция.
Получение
·
Пирометаллургия- получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
Cu2O+C=2Cu+CO; WO3+3H2= W+3H2O;
Fe3O4+ 4CO=3Fe+4CO2
· Металлотермия—
восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
Cr2O3
+ 2Al= 2Cr + Al2O3
· Гидрометаллургия— соединения
металлов переводят в раствор и восстанавливают:
CuO+H2SO4=CuSO4+Н2О;
CuSO4+Fe =Cu+ FeSO4
·
Электрометаллургия – электролиз
растворов и расплавов:
В расплаве: 2NaCl→2Na +Cl2;
В растворе: 2NaCl + 2 H2O→2NaOH + H2↑+Cl2↑;
NiSO4+2Н2О→Ni +Н2↑+Н2SO4+
О2↑;
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na3AlF6
2Al2O3 → 4Al + 3O2
Химические свойства
Металлы — это хорошие восстановители. Из-за небольшого числа электронов и большого радиуса, они легко отдают электроны: Ме – ē → Ме+n .
1. Взаимодействие с простыми веществами неметаллами:
Большинство металлов образуют основные или амфотерные оксиды.
С кислородом
кроме золота и платиныС галогенами С серой
кроме золота и платиныС азотом
только самые активныеС другими неметаллами 2Mg+О2 = 2MgO (t0);
4Li + O2 = 2Li2O
Запомнить:
2Na + O2 = Na2O2 (t0); (пероксид натрия Nа –O – O –Na);
K+ O2 = KO2 (надпероксид калия)
3Fe + 2 O2= Fe3O4Mg + Cl2 = MgCl2
2 Fe + 3 Cl2 = 2 FeCl3Fe + S = FeS 3Li + N2 = Li3N (взаимодействуют при обычных условиях, в отличии от всех остальных металлов) Ca + H2 = CaH2
2. Со сложными веществами
а) Взаимодействие металлов с водой (см ряд акт. Ме)
с активными металлами до Mn образуется соответствующий гидроксид: 2Na + 2H2O = 2NaOH + H2↑
с металлами средней активности — оксид: Zn + H2O = ZnO + H2↑
неактивные металлы с водой не взаимодействуют: Cu +H2O ≠
б) Взаимодействие с кислотами (см.
ряд напряжений): Zn +2HCl = ZnCl2 + H2 ↑
Запомнить: Металлы никогда не вытесняют из НNО3(к) H2SO4(к) водород; они пассивируют Al,Cr,Fe
H2SO4 (р-р — H2;
конц- H2S; S; SО2, ); Cu + 2H2SO4
= Cu SO4 + SO2 ↑+ 2Н2О.
НNО3 (NН3; NН4NО3;N2;;NO; NO2), но не H2; 4HNO3(конц) +Сu = Сu( NO3)2
+ 2NO2 + 2H2O
в) Взаимодействие с солями (более активные металлы вытесняют менее активные из растворов их солей)
CuCl2 + Fe = FeCl2
+ Cu;
— но
если металл взаимодействует с водой, то
CuCl2+2К +2H2 O = 2КCl+Cu(ОН)2↓+
Н2↑; т.к.: 1) 2К + 2H2O = 2КОН+ Н2
2) CuCl2 +2КОН= Cu(ОН)2↓+ 2КCl
г)Взаимодействуют с
оксидами металлов и неметаллов:Fe2O3 + 2Al = Al2O3
+2Fe (t0);2Mg + SiO2
= Si +2MgО(t0);2Mg+CO2=С+2MgО(t0)
д) Металлы, оксиды и
гидроксиды которых проявляют амфотерные свойства взаимодействуют с основаниями:2NaOH+Zn=Na2ZnO2+H2↑(сплав);
2NaOHконц.+Zn+2H2O=Na2[Zn(OH﴿4]+H2↑
е)Другое:
Между собой
образуют интерметаллические соединения, сплавы: Na2Sb
С
органическими веществами (со спиртами, фенолами, карбоновыми кислотами и др.)2СН3СН2ОН+2Na →2 СН3СН2ОNa +H2↑;
2СН3СООН+ Zn → (СН3СОО)2Zn + H2;
2СН3СН2Cl + 2Na → 2NaCl + СН2СН2
СН2СН3 – реакция Вюрца- удлинение цепи.
Химия
9 класс
В химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н+ и катионы других металлов.
С кислородом воздуха легко взаимодействуют щелочные и щёлочноземельные металлы (поэтому их хранят под керосином):

Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:

Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды и т. д., например:

Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:

Менее активные металлы, например железо, взаимодействуют с водой только в раскалённом виде:
3Fe + 4Н2O = Fe3O4 + 4Н2↑.
При этом, как и при горении железа, получается оксид состава Fe3O4 (железная окалина), который представляет собой смесь двух оксидов FeO • Fe2O3.
По восстановительной способности, как вы уже знаете, металлы располагают в ряд, который называют электрохимическим рядом напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
В этот ряд помещён и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н+.
Как вы, очевидно, помните из курса химии 8 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот (рис. 35), а стоящие правее, как правило, не вытесняют водород из растворов кислот:


Рис. 35. Взаимодействие цинка с соляной кислотой
Известно, что золото, ртуть и серебро не реагируют с соляной кислотой. Напомним, что это правило имеет ряд поправок:
- правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
- концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;
- на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).
2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например (рис. 36):


Рис. 36.
Взаимодействие меди с раствором нитрата серебра
Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно — правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.
Лабораторный опыт № 12
Взаимодействие растворов кислот и солей с металлами
Налейте в две пробирки по 2 мл раствора сульфата меди (II), поместите в одну кусочек железа, в другую — гранулу цинка. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной формах. Рассмотрите окислительно-восстановительные процессы.
Задания для самостоятельной работы
- Восстановительные свойства металлов.
- Взаимодействие металлов с кислородом и другими неметаллами.
- Электрохимический ряд напряжений.
- Правила применения электрохимического ряда напряжений при определении возможности взаимодействия металлов с растворами кислот и солей.
- Поправки к правилам применения электрохимического ряда напряжений.
Вопросы и задания
- Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины.
- Вычислите объём воздуха (н. у.), который потребуется для сжигания 36 г магния. (Напоминаем, что объёмная доля кислорода в воздухе равна 0,21.)
- Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80% от теоретически возможного.
- Почему щелочные и щёлочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?
- Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого:

Какой ион проявляет в этой реакции окислительные свойства?
- Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?
- Методом электронного баланса определите коэффициенты в уравнении реакции, схема которой:

Какое вещество проявляет в этой реакции восстановительные свойства?
