Какие свойства проявляют металлы а какие неметаллы

Статьи
Основное общее образование
Линия УМК Лунина. Вводный курс (7)
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Неметаллы – вещества, обладающие неметаллическими свойствами и находящиеся в правом верхнем углу таблицы Менделеева. Открытие неметаллов произошло сравнительно недавно, в отличии от металлов, которые издавна известны человеку. В настоящее время открыто 22 неметаллических элемента.
11 апреля 2019
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.

Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
Неметаллы образуют кислотные или несолеобразующие оксиды.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
Химики разделили все простые вещества на металлы и неметаллы. Они сильно различаются по строению, физическим и химическим свойствам. Многие из них легко отличить визуально, например медь – металл, а бром – неметалл. Однако чтобы не допустить ошибку при классификации элементов, лучше опираться на знание четких признаков, свойственных металлам и неметаллам.
Определение
Элементы, отдающие электроны с внешнего энергетического уровня, называют металлами
. Металлы – это, как правило, твердые вещества (особняком стоит ртуть, которая при нормальных условиях является жидкостью).
Элементы, принимающие электроны на внешний энергетический уровень, являются неметаллами
. Они находятся в различных агрегатных состояниях. Кислород и азот – это газы, бром – жидкость, а к твердым веществам относятся, например, мышьяк, углерод и бор.
Сравнение
Все металлы наделены металлическим блеском, они превосходные проводники электрического тока и тепла. Большинство из них пластичны, при физическом воздействии металлы легко меняют форму. Неметаллы, наоборот, плохие проводники тепла и электрического тока.
Строение металлов и неметаллов – главная отличительная характеристика. Неметаллы – обладатели большего числа неспаренных электронов, размещающихся на внешних уровнях. Металлы имеют металлическую кристаллическую решетку. А неметаллам присущи молекулярные (к примеру, кислороду, хлору и сере) и атомарные (углероду, образующему алмаз) кристаллические решетки.
У металлов маленькая электроотрицательность, а значит и окислительно-восстановительный потенциал невелик. Они, как правило, принимают электроны и окисляются, проявляя восстановительные свойства. Неметаллы, наделенные большой электроотрицательностью и значительным окислительно-восстановительным потенциалом, могут выступать как в качестве окислителей, так и в качестве восстановителей (такое возможно в присутствии наиболее мощного окислителя).
У металлов есть весьма интересное свойство – амфотерность. Амфотерным металлам присущи свойства и металлов, и неметаллов. Например, цинк, находясь в состоянии высшей степени окисления, ведет себя как неметалл.
Выводы сайт
- В физических свойствах.
- В строении атомов.
- В кристаллических решетках.
- В химических свойствах.
- В способности проявлять окислительно-восстановительные свойства.
- В амфотерности металлов.
НЕМЕТАЛЛЫ
природные соединения
применения продуктов их переработки
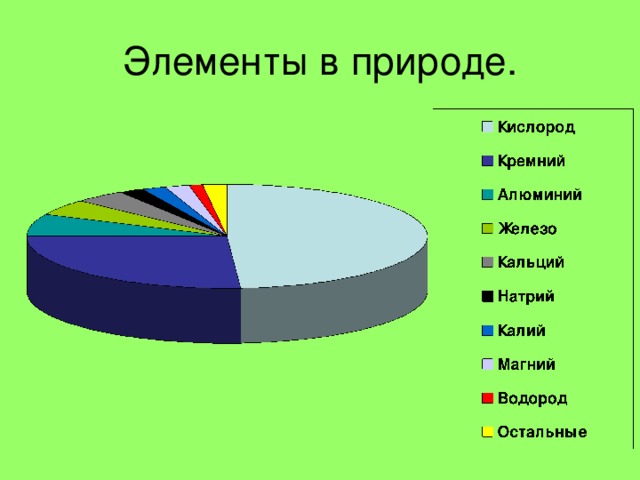

Нахождение в природе
.
Самородные элементы
Азот и кислород, инертные газы в составе воздуха
Сера
Графит С
Алмаз С

Нахождение в природе
←
Апатиты Р
Галит
NaCl →
←
FeS
2
пирит
Кварц
SiO
2
→

Неметаллы
—
это химические элементы, которые могут проявлять свойства как
окислителя
(принимают электроны), так и
восстановителя
(отдают электроны).
НеМ
– элементы с высокой ОЭО (2 — 4)
Исключения:
фтор
– только окислитель,
инертные газы
– могут только отдавать электроны.
Гелий, неон и аргон
– соединений не образуют.
![]()
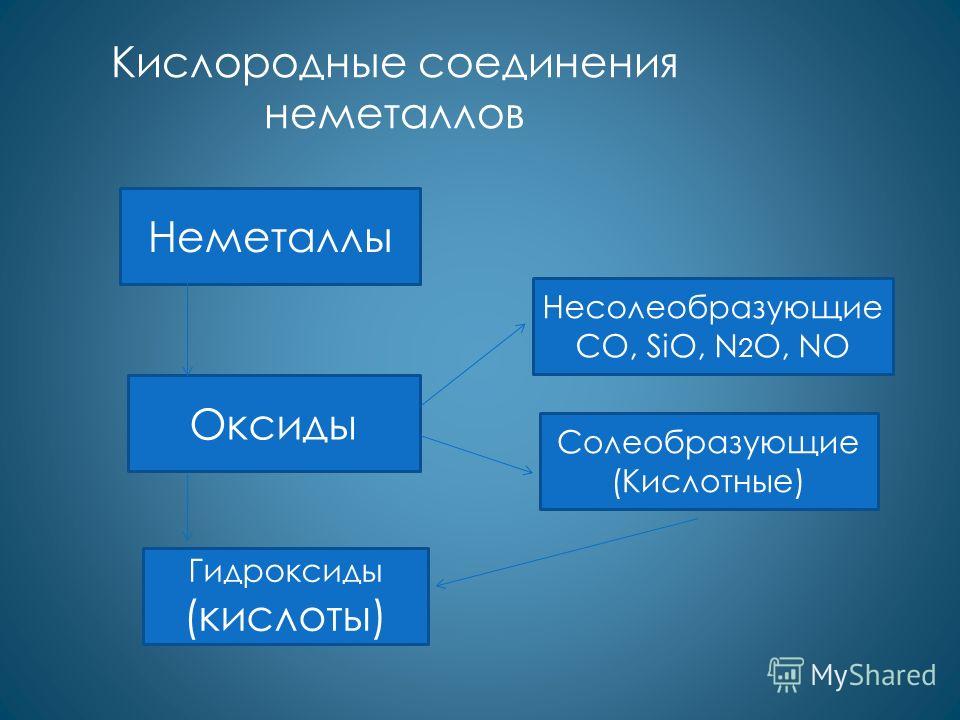
Соединения неметаллов.
- Оксиды – только
кислотные
SO
3
, SO
2
, CO
2
и другие.
- (кроме
NO
и
CO
–безразличные)
- Гидроксиды – только
кислоты
H
2
SO
4
, H
2
SO
3
,H
2
CO
3
и другие
Образуют летучие соединения с водородом
HCl, NH
3
…
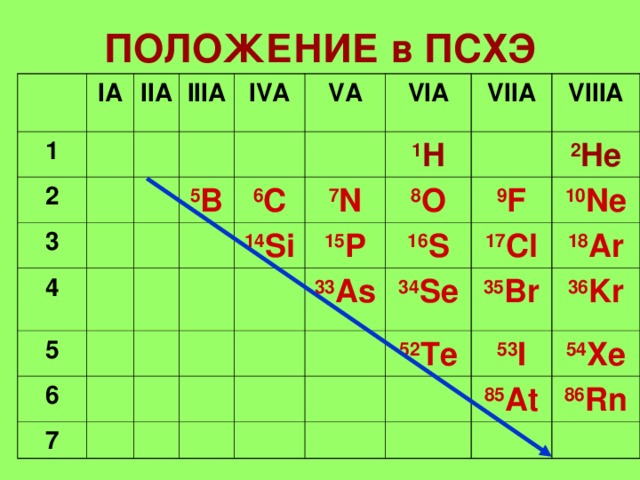
ПОЛОЖЕНИЕ в ПСХЭ
I
А
II
А
III
А
IV
А
V
А
5
B
VI
А
6
C
VII
А
14
Si
1
H
7
N
VIII
А
15
P
8
O
16
S
2
He
9
F
33
As
34
Se
10
Ne
17
Cl
35
Br
52
Te
18
Ar
36
Kr
53
I
54
Xe
85
At
86
Rn

ЭЛЕМЕНТЫ
—
IA,IIIA,IVA

ПНИКТОГЕНЫ
-VA

ХАЛЬКОГЕНЫ —
VIA

ГАЛОГЕНЫ —
VIIA

ИНЕРТНЫЕ ГАЗЫ-
VIIIA

Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2. На последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
4. Неметаллические свойства
В периоде – увеличиваются
В группе — уменьшаются

Строение атомов НеМ
- 5. Высокая электроотрицательность.
- 6. Принимают электроны и отдают.
- 7. НеМ → кислотный оксид→кислота
- 8. Летучие водородные соединения
(кислоты, основания и безразличные)

- Агрегатное состояние
.
- Газообразные – азот, кислород, хлор, инертные газы, водород.
- Жидкий – бром,
- Твёрдые – сера, фосфор, углерод…
- Растворимость в воде.
- Нерастворимы.
- Отношение к электрическому току.
- Неэлектропроводные: сера, кислород…
- Проводники: графит
- Полупроводники: кремний

Строение неметаллов
.
- Молекулярное (НеМ), где
- Инертные газы He, Ar, Ne…
- H 2 , Cl 2 , N 2 …
- P 4 белый
- P n красный
- Атомное строение
- (С) n -алмаз, графит;
- (Si) n кремний;
- (B) n бор


Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Красный фосфор
Углерод (уголь)

Неметаллы малорастворимы в воде
Уголь
Фосфор
Сера не смачивается водой

- 1. Реагируют с металлами.
- 2. С кислородом.
- 3. С водородом.
- 4. С кислотами.
- 5. Со щелочами.
- 6. С солями.
Элементы с неметаллическими свойствами находятся в IIIA-VIIA — группах Периодической системы:
| Период | IIIA | IVA | VA | VIA | VIIA |
| B | C | N | O | F | |
| Si | P | S | Cl | ||
| As | Se | Br | |||
| Te | I | ||||
| At |
Обычно среди неметаллов рассматривают также водород Н, хотя это не совсем точно, поскольку водороду присущи как неметаллические, так и металлические химические свойства.
Общая электронная формула
атомов неметаллов ns
2 np
1−5 , этому соответствует большое разнообразие степеней окисления
неметаллов в соединениях.Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению высокой окислительной активности
. Вот почему значения электроотрицательности
у них велики. Отсюда многообразие в химических свойствах и способах получения неметаллов.
Другая характерная особенность неметаллов — стремление образовывать ковалентные связи
с атомами других неметаллов и амфотерных элементов. Поэтому и простые вещества и соединения неметаллов имеют ковалентное строение.
В свободном виде встречаются газообразные
вещества — F 2 , Cl 2 , O 2 , N 2 и Н 2 , твердые
— I 2 , At, S, Te, P, As, C, Si и В, при комнатной температуре известен один жидкий
неметалл — бром Br 2 .
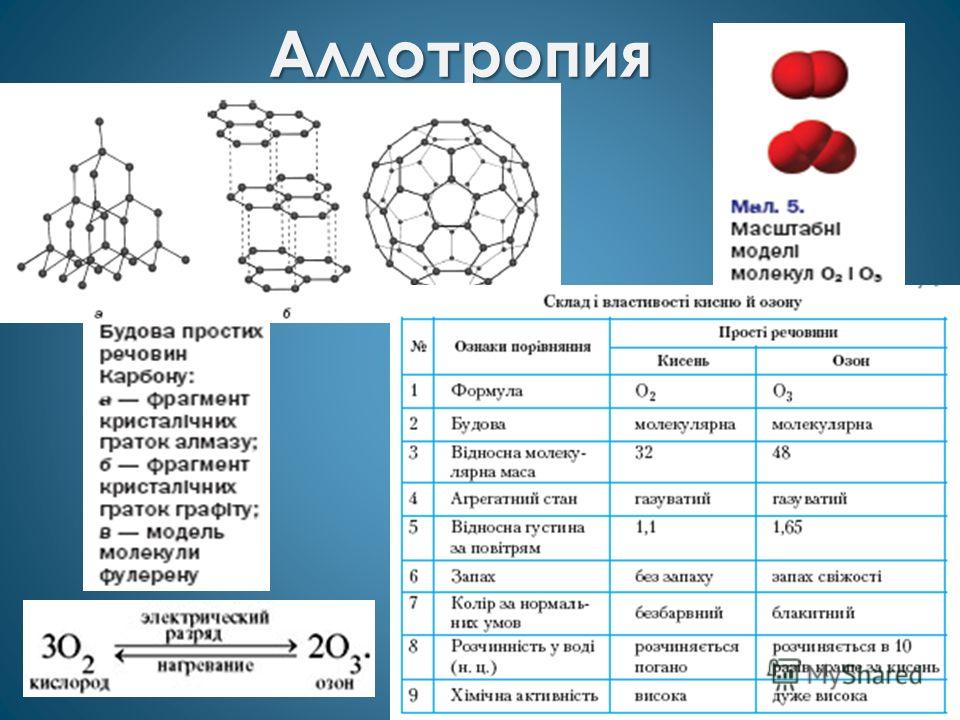
Нередко для неметаллов наблюдается аллотропия
, например у кислорода (О 2 и О 3) и углерода (графит, алмаз, карбин, фуллерен).
В природе встречаются самородные неметаллы
— N 2 и O 2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода
и растворенные в ней соли
, затем — минералы
и горные породы
(например, различные силикаты
, алюмосиликаты
, фосфаты
, бораты
, сульфаты
и карбонаты
).
По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).
Галогены
В подгруппу галогенов входят фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе в виде различных соединений. Астат получен только искусственным путем, радиоактивен. Это р-элементы VII группы периодической системы Д. И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5
(см. табл. 1).
Этим объясняется общность их свойств. Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением атомов, которое у атома фтора можно представить схемой:
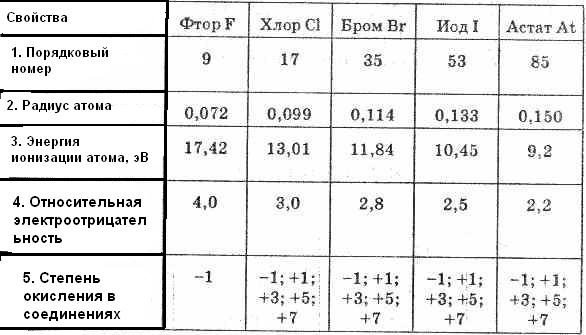
Таблица 1. Свойства элементов подгруппы галогенов
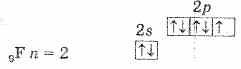
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-уровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а его степень окисления всегда -1.
Электронное строение атома хлора выражается схемой:
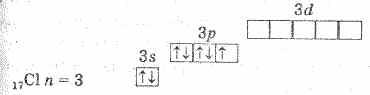
У атома хлора один неспаренный электрон на 3р-подуровне, и в обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеются еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов.
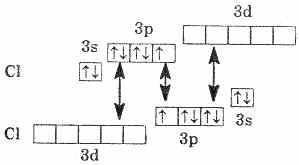
В возбужденном состоянии атома электроны хлора переходят с3p- и3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся на одной орбитали, увеличивает валентность на две единицы. Очевидно, что хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1,3,5,7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора.
В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к электрону.
Внутри подгруппы галогенов переход от фтора к иоду сопровождается увеличением радиуса атома.
Элементы Подгруппы относятся к неметаллам; с увеличением заряда ядра от F к At неметаллические признаки ослабевают, o чем свидетельствуют уменьшение потенциалов ионизации и сродство к электрону.
Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от F к I. В ряду F, Cl, Br, I наибольшим радиусом атома (и, следовательно, наименьшим сродством к электрону) обладает I, поэтому он характеризуется менее выраженными окислительными свойствами, чем Br, Cl, F. Следовательно, окислительные свойства нейтральных атомов в подгруппе галогенов уменьшаются от F к I, а восстановительные усиливаются:

Связь Гал-Гал в молекулах простых веществ ковалентная неполярная. Длина связи в молекуле от F 2 к I 2 закономерно увеличивается. Энергия же связи изменяется следующим образом.
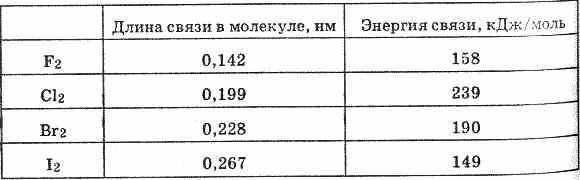
Энергия связи в молекуле F2 менее прочная, чем в молекуле Сl2. Это объясняется образованием в молекуле Сl2 и соответственно Br2 и I2 даттивной связи: когда общее энергетическое облако образуется за счет не только спаривания р-электронов, но и за счет уже имеющихся спаренных р-электронов одного атома и вакантной d-орбитали другого атома.
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: — R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
2
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ АТОМЫ классифицируют на МеталлыНеметаллы имеют Строение атома: — > R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: — R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
title=»ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ АТОМЫ классифицируют на МеталлыНеметаллы имеют Строение атома: — > R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
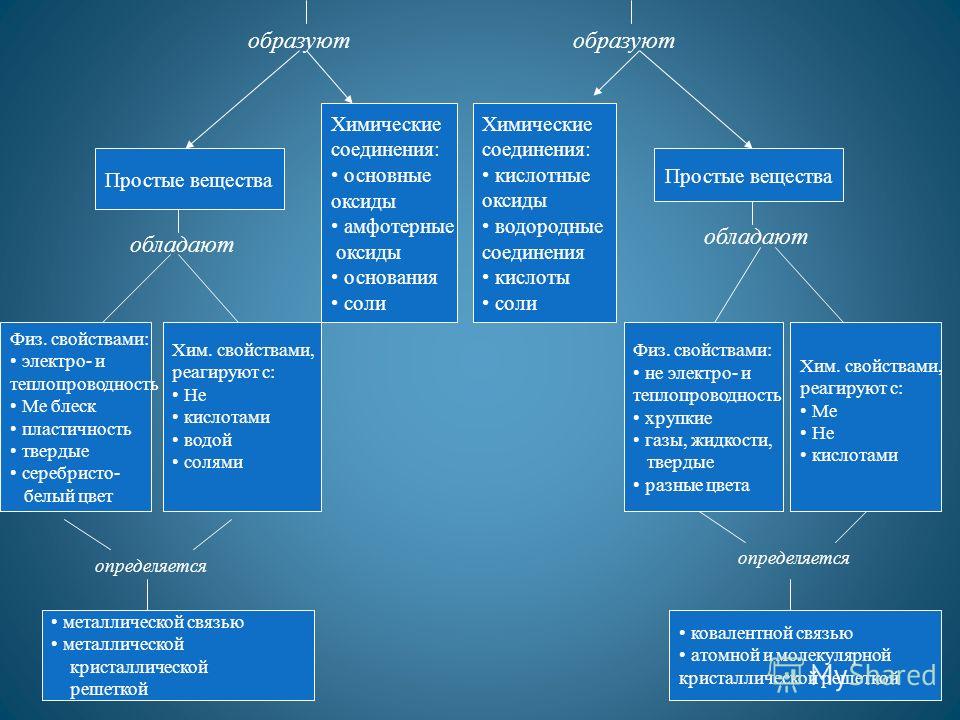
Образуют Простые вещества Химические соединения: основные оксиды амфотерные оксиды основания соли Химические соединения: кислотные оксиды водородные соединения кислоты соли Простые вещества обладают Физ. свойствами: электро- и теплопроводность Ме блеск пластичность твердые серебристо- белый цвет Хим. свойствами, реагируют с: Не кислотами водой солями Физ. свойствами: не электро- и теплопроводность хрупкие газы, жидкости, твердые разные цвета Хим. свойствами, реагируют с: Ме Не кислотами металлической связью металлической кристаллической решеткой ковалентной связью атомной и молекулярной кристаллической решеткой определяется
![]()


Строение: атомное (Si, В), молекулярное (Н 2, N 2, Br 2) Агрегатное состояние: – газы – H 2, O 2, O 3, N 2, F 2, Cl 2 ; – жидкость – Br 2 ; – твердые вещества – модификации серы, фосфора,кремния, углерода и др Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
![]()
Аллотропия

Соотнесите: Среди пар веществ выбери «лишнюю»: а) белый и красный фосфор б) кислород и озон в) кремнезём и кварц г) алмаз и графит Неметаллические свойства наиболее выражены у простого вещества, образованного атомами: а) Фтор б) Кислород в) Кремний г) Азот Простое вещество 1. медь2. сера3. алмаз 4. Белый фосфор Кристаллическ ая решётка А) молекулярная Б) атомнаяВ)металлическ ая

Водородные соединения неметаллов B 2 H 6 диборан CH 4 метан NH 3 аммиак H 2 O вода HF фтороводород SiH 4 силан PH 3 фосфин H 2 S сероводород HCl хлороводород GeH 4 герман AsH 3 арсин H 2 Se селеноводород HBr бромоводород H 2 Te теллуроводород HI йодоводород

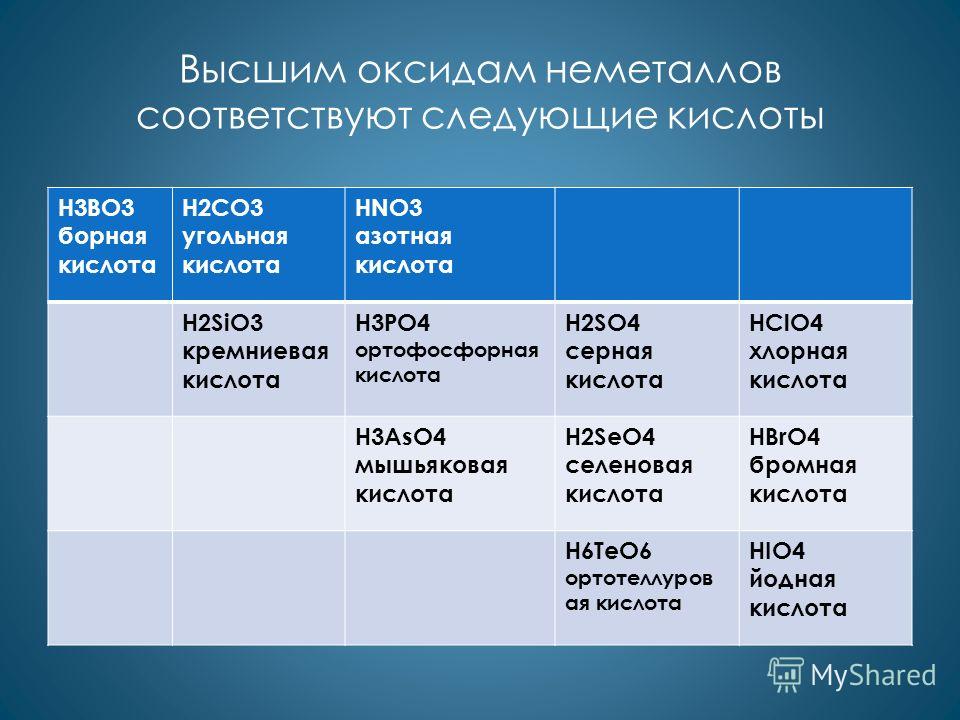
Высшим оксидам неметаллов соответствуют следующие кислоты H3BO3 борная кислота H2CO3 угольная кислота HNO3 азотная кислота H2SiO3 кремниевая кислота H3PO4 ортофосфорная кислота H2SO4 серная кислота HClO4 хлорная кислота H3AsO4 мышьяковая кислота H2SeO4 селеновая кислота HBrO4 бромная кислота H6TeO6 ортотеллуров ая кислота HIO4 йодная кислота

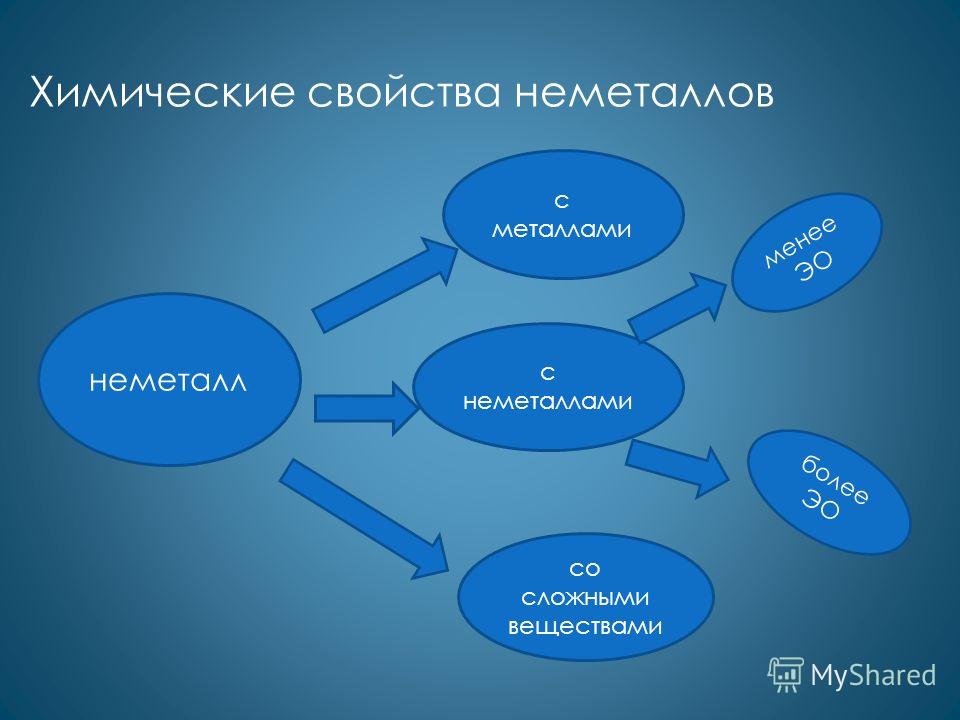
Характерными для большинства неметаллов являются окислительные свойства. Как окислители они реагируют с металлами: Ca + Cl 2 = CaCl 2 4Li + O 2 = 2Li 2 O 2Na + S = Na 2 S с менее электротрицательными неметаллами: H 2 + S = H 2 S P 4 + 5O 2 = 2P 2 O 5 2P + 5Cl 2 = 2PCl 5 со сложными веществами: 2FeCl 2 + Cl 2 = 2FeCl 3 CH 4 + Br 2 = CH 3 Br + HBr

Менее характерны для неметаллов восстановительные свойства. Как восстановители они реагируют с более электротрицательными неметаллами: Si + 2F 2 = SiF 4 C + O 2 = CO 2 C + 2S = CS 2 со сложными веществами: H 2 + HCHO = CH 3 OH 6P + 5KClO 3 = 5KCl + 3P 2 O 5


ВеществаОбщие свойстваОтличительные свойства Простые вещества – неметаллы 1. С металлами 2. С неметаллами 1. Галогены вытесняют друг друга с растворов солей. 2. Кислород реагирует со сложными веществами 3. Углерод реагирует с оксидами металлов 4. Углерод реагирует с углекислым газом 5. Кремний реагирует с растворами щелочей Химические свойства неметаллов и некоторых соединений

ВеществаОбщие свойстваОтличительные свойства Кислотные оксиды 1. С водой (кроме оксида кремния) 2. С основными оксидами 3. Со щелочами 1. Углекислый газ и оксид кремния реагируют с магнием 2. Оксид кремния реагирует с углеродом 3. Оксид кремния реагирует с солями, вытесняя более летучие оксиды Химические свойства неметаллов и некоторых соединений

ВеществаОбщие свойстваОтличительные свойства Кислоты 1. Изменяют окраску индикаторов 2. Реагируют с металлами 3. Реагируют с основными и амфотерными оксидами 4. С основаниями и амфотерными гидроксидами 5. С солями 1. Плавиковая кислота реагирует с оксидом кремния 2. Азотная и концентрированная серная кислоты по особому реагируют с металлами 3. При нагревании разлагаются азотная, угольная, кремниевая кислоты Химические свойства неметаллов и некоторых соединений

ВеществаОбщие свойстваОтличительные свойства Соли 1. С растворами солей 2. С кислотами 3. Со щелочами 1. При нагревании разлагаются нитраты, соли аммония, карбонаты (кроме карбонатов щелочных металлов) Химические свойства неметаллов и некоторых соединений

Урок по химии, 9класс.(О.С.Габриелян)
НЕМЕТАЛЛЫ. ОБЩАЯ ХАРАКТЕРИСТИКА. АЛЛОТРОПИЯ.
Цель:
Используя противопоставление с металлами, рассмотреть положение неметаллов в ПСМ и особенности строения атомов, вспомнить ряд электроотрицательности. Повторить понятие аллотропия и кристаллическое строение неметаллов, а следовательно, рассмотреть их физические свойства. Рассмотреть состав воздуха. Роль неметаллов в живой и неживой природе.
Оборудование
: мультимедийная установка, электронная библиотека «Просвещение», аэрозольные упаковки с бытовыми ядохимикатами, дезодоранты, лаки, кристаллические решетки алмаза и графита, алюминиевая и медная проволока.
Тип урока
:комбинированный.
План урока
Ӏ
.Мотивационно-ориентировочный этап
1)Актуализация знаний, полученных на предыдущем уроке
2)Постановка целей урока
ӀӀ
.Операционно-исполнительский этап
1)Положение неметаллов в таблице Д.И. Менделеева
2)Агрегатное состояние
3)Аллотропия
4)Состав воздуха
5)Области применения неметаллов
ӀӀӀ.
Оценочно-рефлексивный этап
Контроль и самоконтроль: работа с тестами
Выводы
Домашнее задание.
Ӏ. Все химические элементы делятся на металлы и неметаллы в зависимости от строения и свойств их атомов. На металлы и неметаллы делятся и простые вещества, образованные этими элементами исходя из физических и химических свойств. С металлами вы уже познакомились. А сегодня, используя противопоставление с металлами, рассмотрим свойства неметаллов.
ӀӀ.Заполнить таблицу, используя таблицу Менделеева и диск по химии.(у каждого на парте образец пустой таблицы)
Сравнительная характеристика металлов и неметал
лов.
характеристика
металлы
неметаллы
Строение атома
От 1до 3-х электронов
Более 4-хэлектронов
радиус
большой
Маленький
Химические свойства
восстановители
Окислители. Фтор самый сильный окислитель
Агрегатное состояние
Твердые(исключение ртуть)
Твердые, жидкие, газы
цвет
Серебристо-серые(искл.золото,медь)
Спектр цветов
блеск
металлический
Нет
электропроводность
Проводят ток
Не проводят(искл.графит)
Смотрите таблицу, и сделайте вывод.
Вывод:
Неметаллы –это химические элементы, которые образуют простые вещества, не обладающие свойствами металлов.
Температура плавления от 3800(графит) до — 210(азот). Такой широкий диапозон объясняется двумя видами кристаллических решеток: молекулярная (О
2
, О
3
) и атомная(графит, алмаз).
Если металлы –простые вещества образованы металлической связью, то для неметаллов –простых веществ характерна ковалентная неполярная химическая связь.
Разным строением кристаллических решеток
объясняется явление аллотропия.
Дайте определение аллотропии.
Красный фосфор
-атомная решетка(применяется в производстве спичек и удобрений)
Белый фосфор
– молекулярная(Р
4
) в производстве удобрений, в военном деле: дымовые шашки, ядохимикаты.
Графит-атомная (показать решетку). Ногинский графитовый рудник
Алмаз –атомная (Якутия).
Вторая причина аллотропии
-разное количество атомов(кислород и озон).Это газы сильные окислители. Ультрафиолетовое солнечное излучение расщепляет часть молекул кислорода на отдельные атомы, которые взаимодействуют с кислородом и образуется озон. На высоте 25км находится озоновый слой. Он действует как экран, защищает Землю от жесткого УФ излучения. Выхлопные газы самолетов, некоторые аэрозоли вещества, используемые в холодильных агрегатах(фреон) разрушают озоновый слой. От появления дыры в озоновом слое страдают растения, и увеличивается риск заболеваний раком кожи.
Озон образуется после грозы, в сосновом лесу, на морском побережье.
Откройте учебник на стр.90. Давайте сравним простые вещества кислород и озон
кислород
озон
Бесцветный
Светло-синий
Без запаха
С сильным запахом
Малорастворим в воде
Растворим в воде
Не ядовит
Ядовит в больших концентрациях
Содержание в воздухе 21%
2×10
-10
Поддерживает горение, дыхание
Применяется для обеззараживания, для отбеливания тканей
Молодцы!
Озон относится к переменным составляющим воздуха. А что такое воздух?
Диск:
Состав воздуха. Записать состав в тетрадь. Молярная масса воздуха -29.
Применение газов, входящих в состав воздуха(В аквалангах водолазов-смесь кислорода и гелия, т.к. азот под давлением опасен) гелий используется при изготовлении лазеров, дающий устойчивый световой луч с одной длиной волны.
Вывод: Что на уроке узнали нового о неметаллах?
Работа с тестами 5-6минут, собрать листочки.
Домашнее задание: §15,стр.93 «5»№2,3а),4
«4»-№2,3б)
«3»- №6 (как предупредить озоновые дыры)
ТЕСТ.
1.Неметаллы расположены в периодической системе:
А)в начале периода
Б)в конце периода
В)во всех группах
Г)в больших периодах
2.Атомам неметаллов соответствуют электронные формулы
А
)3S
2
3P
1
и
2S
2
2 P
1
Б
)2S
2
2P
1
и
3S
2
3 P
1
В
) 2S
2
2P
1
и
2S
2
2 P
2
Г
) 3S
2
3P
1
и
4S
2
3.Газом среди предложенных неметаллов является:
А)С б) В В)В
r
2
Г)О
3
4. Выберите пары аллотропных модификаций?
А)
S
и Р Б) О
2
и О
3
В) С и
S
Г) В и Р
