Какие свойства проявляет сернистая кислота в
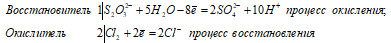
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
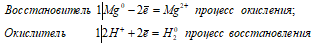
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
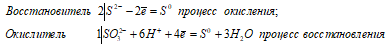
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
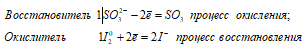
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I—
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
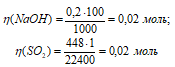
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
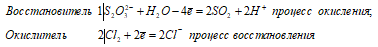
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl—+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
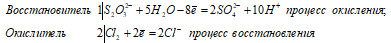
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
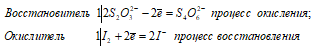
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I—
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
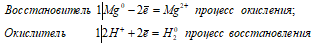
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
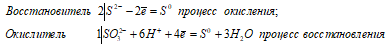
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
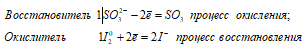
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I—
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
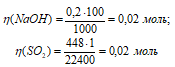
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
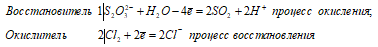
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl—+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
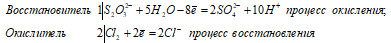
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
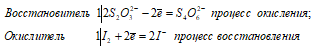
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I—
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Кислотно-основные свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
б) с основными оксидами:
SO2 + CaO = CaSO3
SO2 + K2O = K2SO3
в) с водой:
SO2 + H2O = H2SO3
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
SO2 + 2H2S = 3S↓ + 2H2O
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
2SO2 + O2 = 2SO3
SO2 + Cl2 + 2H2O = H2SO3 + 2HCl
Получение
1) Сернистый газ образуется при горении серы:
S + O2 = SO2
2) В промышленности его получают при обжиге пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
Na2SO3 + H2SO4 = Na2SO4 + H2SO3→SO2↑ + H2O
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17оС превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Кислотно-основные свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
SO3 + NaOH = NaHSO4
SO3 + 2NaOH = Na2SO4 + H2O
б) с основными оксидами:
SO3 + CaO = CaSO4
в) с водой:
SO3 + H2O = H2SO4
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Образование олеума: H2SO4 + nSO3 = H2SO4 ∙ nSO3
Окислительно-восстановительные свойства
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
3SO3 + H2S = 4SO2 + H2O
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
2SO2 + O2 = 2SO3
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.
 Серная кислота
Серная кислота
Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Кислотно-основные свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
а) с основными оксидами:
MgO + H2SO4 = MgSO4 + H2O
б) с основаниями:
H2SO4 + NaOH = Na2SO4 + 2H2O
в) с солями:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Процесс взаимодействия ионов Ва2+ с сульфат-ионами SO42+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной H2SO4 окислителями являются ионы водорода Н+, а в концентрированной – сульфат-ионы SO42+. Ионы SO42+ являются более сильными окислителями, чем ионы Н+ (см.схему).
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Zn + H2SO4 = ZnSO4 + H2↑
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Cu + H2SO4 ≠
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.
 Реакция серной кислоты с цинком
Реакция серной кислоты с цинком
Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S↓ + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Fe + H2SO4 ≠
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
S + 2H2SO4 = 3SO2↑ + 2H2O
C + 2H2SO4 = 2SO2↑ + CO2↑ + 2H2O
Получение и применение
 Реакция серной кислоты с сахаром
Реакция серной кислоты с сахаром
В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
- Получение SO2 путем обжига пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
- Окисление SO2 в SO3 в присутствии катализатора – оксида ванадия (V):
2SO2 + O2 = 2SO3
- Растворение SO3 в серной кислоте:
H2SO4 + nSO3 = H2SO4 ∙ nSO3
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
H2SO4 ∙ nSO3 + H2O = H2SO4
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты
 Железный купорос
Железный купорос
Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000оС, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Na2SO4 ≠
CuSO4 = CuO + SO3
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом»
Производство-серной-кислоты-контактным-способом.docx (52 Загрузки)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Оксид серы (I)[править | править код]
Основная статья: Оксид серы (I)
Оксид серы (I) — S2О — бесцветный газ, неустойчивый при комнатной температуре.
Монооксид серы[править | править код]
Основная статья: Оксид серы (II)
Монооксид серы — SO — бесцветный газ с резким, неприятным запахом. Неустойчив, бурно реагирует с кислородом, превращаясь в диоксид серы, что обуславливает редкость его нахождения в природе.
Диоксид серы. Сернистая кислота[править | править код]
Основная статья: Оксид серы (IV)
Оксид серы (IV) — SO2 (диоксид серы, сернистый газ) представляет собой бесцветный газ с резким характерным запахом. Образуется при сгорании серы:
S + O2 = SO2
Раствор сернистого газа в воде (до 40 объёмов SO2 на 1 объём воды) — неустойчивая двухосновная сернистая кислота, которая существует только в растворе:
SO2 + H2O = H2SO3 (реакция обратима)
Основная статья: Сернистая кислота
Сернистая кислота является слабой кислотой, в водных растворах она диссоциирует ступенчато с образованием гидросульфит- и сульфит-ионов
H2SO3 = H+ + HSO3-
HSO3 = H+ + SO32-
Сернистая кислота проявляет химические свойства, общие для кислот: взаимодействует с основными оксидами, основаниями, вступает в реакцию обмена с солями других кислот.
Триоксид серы[править | править код]
Основная статья: Оксид серы(VI)
Оксид серы (VI) — SO3 — высший оксид серы.
Получают, окисляя оксид серы (IV) в присутствии катализатора при температуре около 5000 C. При обычных условиях оксид серы(VI) — бесцветная едкая жидкость, которая при температуре ниже 170 C превращается в белое кристаллическое вещество. Это типичный кислотный оксид, который взаимодействует с водой с образованием серной кислоты.
Серная кислота[править | править код]
Основная статья: Серная кислота
Физические свойства[править | править код]
Тяжелая (плотность 1,83г/см3), бесцветная маслянистая жидкость без запаха. Смешивается с водой в любых соотношениях. Разогревание смеси при растворении серной кислоты в воде может сопровождаться её разбрызгиванием. Нельзя приливать воду к кислоте,следует при непрерывном перемешивании раствора вливать кислоту в воду.
Химические свойства[править | править код]
В разбавленных растворах серная кислота является сильным электролитом.
Разбавленная серная кислота проявляет все характерные свойства кислот: взаимодействует с металлами, стоящими в ряду активности до водорода, с основными оксидами, с основаниями и солями. При этом образуются соли: средние — сульфаты, кислые — гидросульфаты. Большинство сульфатов и гидросульфатов хорошо растворимы в воде, многие из них образуют кристаллогидраты. Некоторые кристаллогидраты называют купоросами.
Для качественного обнаружения серной кислоты и её солей в водных растворах используются растворимые соли бария. В результате реакции образуется белый осадок сульфата бария.
Концентрированная серная кислота является более сильным окислителем, чем разбавленная. При взаимодействии концентрированной серной кислоты с металлами водород не выделяется. С металлами, стоящими в ряду активности после водорода (кроме золота и платины), реакция протекает с образованием оксида серы (IV).
С металлами,стоящими в ряду активности до водорода, концентрированная серная кислота восстанавливается до оксида серы(IV), серы или сероводорода в зависимости от активности металла и условий протекания реакции.
Литература[править | править код]
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
Анонимный вопрос · 23 декабря 2018
< 100
Для чего на производствах используют диоксид серы?
Главный редактор издания «Популярный университет», химик по образованию… · popuni.ru
В основном диоксид серы используют как консервант в пищевой промышленности. Он также может применяться в качестве сырья для органического синтеза. Диоксид серы также является промежуточным продуктом при производстве серной кислоты из дисульфида железа (пирита).
Прочитать ещё 3 ответа
Могут ли неорганические кислоты, в частности хлорная, гореть?
Researcher, Institute of Physics, University of Tartu
Да, вполне. Та же хлорная кислота в присутствии CuCl2 при нагревании горит с образованием воды и молекулярного хлора. Другие безкислородные кислоты тоже могут гореть, например, бромоводородная горит по аналогичной реакции с выделением брома и воды, а H2S горит с образованием воды и SO2.
UPDATE: как мне верно говорят, я глупость написал — хлорная кислота (HClO4) гореть не может, я имел в виду хлороводородную кислоту (HCl).
Как можно охарактеризовать физические и химические свойства кислорода?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????Кислород (или Oxygenium)????
Химические свойства:
✅Сильный окислитель
✅Реагирует практически со всеми элементами
✅Образует оксиды
✅Окисляет простые и сложные неорганические вещества
✅Окисляет органические вещества
✅Характерна реакция горения
Физические свойства:
????Газ без цвета и запаха
????Мало растворим в воде
????Немного тяжелее воздуха
????Плотность 1,4г/л
????Температура кипения -183°C
????Температура плавления -216°C
????Атомы кислорода образуют такие вещества,как O ₂(кислород) и О ₃ (озон)
OF2 это несолеобразующий оксид(или нет?),но в учебнике пишут,что к оксидам он не относится.Так что же это за соединение?
Инженер, немного пилот. Физик, химик, электронщик-любитель. Независимый звукореж…
Правильно в учебнике пишут — соединение кислорода и фтора никакой не оксид. И порядок записи элементов в формуле вам на это же намекает. А именно, фтор в этом соединении более электротрицателен, чем кислород, поэтому это вещество не является оксидом, а является фторидом в котором фтор является акцептором электронов (элементом который забирает электроны, окислителем), а кислород принимает очень непривычную для него роль донора, отдающего электроны (восстановителя). Во всех же своих «нормальных» соединениях, кислород является акцептором электронов, окислителем (собственно, в честь кислорода и термин). И даже оказавшись в роли донора, кислород отдаёт электроны фтору очень нехотя — их общее электронное облако находится практически посередине с небольшим перевесом в сторону фтора. Из-за этого, в частности, жидкий фторид кислорода не является полярным растворителем, в отличие от воды, молекула которой устроена и выглядит очень похоже, но в которой кислород бесцеремонно забрал у водорода все электроны, придав себе отрицательный заряд, а водородам — положительный.
Можно ли использовать краску одного бренда, а окислитель — другого?
Теоретически можно. Обратите внимание на качество окислителя, оно не должно уступать по качеству краске. Быть примерно одной ценовой категории. Тем не менее, есть шанс получить не тот оттенок, который вы желали. Парикмахеры же советуют использовать один бренд краски и окислителя во изежание неприятных последствий, таких как пересушивание волос, не тот оттенок или цвет, неожиданная реакция окислителя и красящего пигмента.
Прочитать ещё 1 ответ
