Какие свойства проявляет муравьиная кислота
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 февраля 2020;
проверки требуют 15 правок.
| Муравьиная кислота | |||
|---|---|---|---|
| Систематическое наименование | Метановая кислота | ||
| Традиционные названия | Муравьиная кислота | ||
| Хим. формула | CH2O2 | ||
| Рац. формула | HCOOH | ||
| Состояние | Жидкость | ||
| Молярная масса | 46,025380 г/моль | ||
| Плотность | 1,2196 г/см³ | ||
| Динамическая вязкость | 0,16 Па·с | ||
| Энергия ионизации | 11,05 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | 8,25 °C | ||
| • кипения | 100,7 °C | ||
| • вспышки | 60 °C | ||
| • самовоспламенения | 520 °C | ||
| Пределы взрываемости | 18 ± 1 об.%[1] | ||
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа | ||
| Критическая точка | 588 K (315 °C), 5,81 МПа | ||
| Мол. теплоёмк. | 98,74 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −409,19 кДж/моль | ||
| Давление пара | 120 мм. рт. ст. (16 кПа) при 50 °C | ||
| Константа диссоциации кислоты | 3,75 | ||
| Показатель преломления | 1,3714 | ||
| Дипольный момент | 1,41 (газ) Д | ||
| Рег. номер CAS | 64-18-6 | ||
| PubChem | 284 | ||
| Рег. номер EINECS | 200-579-1 | ||
| SMILES | O=CO | ||
| InChI | 1S/CH2O2/c2-1-3/h1H,(H,2,3) BDAGIHXWWSANSR-UHFFFAOYSA-N | ||
| Кодекс Алиментариус | E236 | ||
| RTECS | LQ4900000 | ||
| ChEBI | 30751 | ||
| ChemSpider | 278 | ||
| Пиктограммы ECB | |||
| NFPA 704 | 2 3 1 ACID | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое[2][3]. Соли и анионы муравьиной кислоты называются формиатами.
Физические и химические свойства[править | править код]
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Константа диссоциации: 1,772⋅10−4.
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода[4]:
Муравьиная кислота реагирует с аммиачным раствором оксида серебра:
Взаимодействие муравьиной кислоты с гидроксидом меди:
Проявляет все свойства одноосновных карбоновых кислот:
Образует формиаты с металлами:
Со спиртами образует сложные эфиры:
Получение[править | править код]
- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола:
- Реакцией монооксида углерода с гидроксидом натрия:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта. - Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность[править | править код]
Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-я жидкая муравьиная кислота может вызывать сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита.
Муравьиная кислота быстро метаболизируется и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
Охрана труда[править | править код]
По данным[5]ПДК в воздухе рабочей зоны равна 1 мг/м3 (максимальная разовая)[6]. Может попадать в организм при вдыхании[7]. Порог восприятия запаха может достигать 453 мг/м3[8].
Нахождение в природе[править | править код]
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название[2][9][10][3].
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию СН3ОН в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение[править | править код]
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные ей, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода.
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования[11].
Производные муравьиной кислоты[править | править код]
Соли и эфиры муравьиной кислоты называют формиатами.
См. также[править | править код]
- Муравьиный спирт
Примечания[править | править код]
- ↑ 1 2 https://www.cdc.gov/niosh/npg/npgd0296.html
- ↑ 1 2 Wray, J. Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants (англ.) // Philosophical Transactions of the Royal Society of London : journal. — 1670. — Vol. 5, no. 57—68. — P. 2063. — doi:10.1098/rstl.1670.0052.
- ↑ 1 2 Вергунова Н.Г. Муравьиная кислота // Химическая энциклопедия: В 5 т / Редкол.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 148—149. — 639 с. — ISBN 5-85270-039-8.
- ↑ Разложение муравьиной кислоты — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ (Роспотребнадзор). № 1272. Метановая кислота (муравьиная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 90. — 170 с. — (Санитарные правила).
- ↑ Будковская Н.Г. Муравьиная кислота // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1981. — Т. 16. Музеи — Нил. — 512 с. — 150 800 экз.
- ↑ МКХБ Международная организация труда. МКХБ № 0485. Муравьиная кислота. Метановая кислота. www.ilo.org/dyn/icsc/ (2018). Дата обращения 12 ноября 2019.
- ↑ Kleinschmidt E.-G. Untersuchungen zum Zusammenhang Zwischen Riechschwelle des Menschen für Einige Substanzen und Deren Chemischer Struktur (нем.) // Wissenschaftliche Zeitschrift der Wilhelm-Pieck-Universitat Rostock. Naturwissenschaften Reihe. — Rostock: The University of Rostock, 1983. — Bd. 32, H. 7. — S. 54-58. — ISSN 0323-4630.
- ↑ W. B.; Johnson. History of the process and present state of animal chemistry (англ.). — 1803.
- ↑ Charles Earle Raven. John Ray, naturalist : his life and works (англ.). — Cambridge University Press, 1986. — ISBN 0521310830.
- ↑ Красильников А. П. Справочник по антисептике. — Мн., 1995.
Муравьиная кислота, получение, свойства, химические реакции.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
Муравьиная кислота, формула, характеристики
Физические свойства муравьиной кислоты
Химические свойства муравьиной кислоты
Получение муравьиной кислоты
Безопасность при обращении с муравьиной кислотой. Требования ГОСТа
Применение муравьиной кислоты
Муравьиная кислота, формула, характеристики:
Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
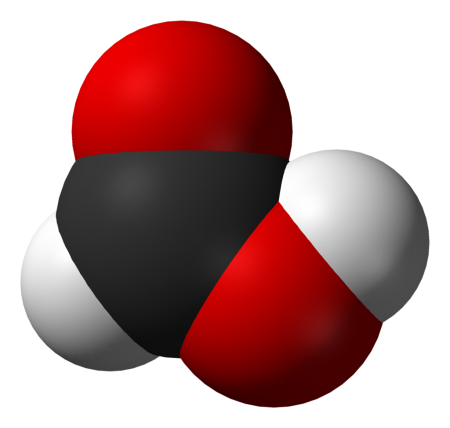
Химическая формула муравьиной кислоты CH₂O₂. Рациональная формула муравьиной кислоты HCOOH. Изомеров не имеет.
Строение молекулы муравьиной кислоты:

Муравьиная кислота (метановая кислота) – простейшая карбоновая кислота, родоначальник класса карбоновых кислот.
Муравьиная кислота – бесцветная жидкость, обладающая резко пахнущим запахом.
Муравьиная кислота – легковоспламеняющаяся жидкость с температурой вспышки 60 °С, температурой самовоспламенения 504 °С.
Водный раствор, содержащий 85% муравьиной кислоты, также является горючей жидкостью с температурой вспышки (в открытом тигле) 71 °С, температурой воспламенения 83 °С.
При температуре выше 69°C муравьиная кислота может образовывать взрывоопасныe смеси пар/воздух.
Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
В качестве пищевой добавки муравьиная кислота зарегистрирована как E236.
Муравьиная кислота своё название получила из-за того, что была впервые выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв.
В природе муравьиная кислота содержится в яде пчел, в крапиве, хвое, выделениях медуз, фруктах (яблоках, малине, клубнике, авокадо и пр.).
Соли и анионы муравьиной кислоты называются формиатами.
Название муравьиной кислоты на английском – formic acid.
Муравьиная кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства муравьиной кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | резкий запах |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,2196 |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1219,6 |
| Температура плавления, °C | 8,25 |
| Температура кипения, °C | 100,7 |
| Тройная точка, °C | 8,25 при 2,2 кПа |
| Критическая точка, °C | 315 при 5,81 МПа |
| Температура вспышки, °C | 60 |
| Температура самовоспламенения, °C | 504 |
| Константа диссоциации | 1,772⋅10-4 |
| Константа диссоциации кислоты | 3,75 |
| Взрывоопасные концентрации смеси с воздухом, % объёмных | от 18 до 57 |
| Удельная теплота сгорания, МДж/кг | 4,58 |
| Молярная масса, г/моль | 46,03 |
Химические свойства муравьиной кислоты:
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные.
Для нее характерны следующие химические реакции:
- 1. реакция муравьиной кислоты с щелочами:
HCOOH + NaOH → HCOONa + H2O,
HCOOH + KOH → HCOOK + H2O.
В ходе данной реакции образуется формиат натрия (формиат калия) и вода.
- 2. реакция муравьиной кислоты с гидроксидами:
HCOOH + 2Cu(OH)2 → CO2 + Cu2O + 3H2O.
В ходе данной реакции образуется углекислый газ, оксид меди и вода.
- 3. реакция разложения муравьиной кислоты при нагревании:
HCOOH → CO + H2O (to, kat = H2SO4 (конц.) или P4O10).
При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота или оксид фосфора, разлагается на моноксид углерода (угарный газ) и воду.
- 4. реакция образования сложных эфиров:
Муравьиная кислота, вступая в реакцию со спиртами, образует сложные эфиры.
HCOOH + СН3ОН→ HCOOCH3 + H2O.
В результате химической реакции муравьиной кислоты с метанолом (метиловым спиртом) образуется метилформиат (метиловый эфир муравьиной кислоты) и вода.
- 5. реакция с аммиачным раствором оксида серебра (реакция серебряного зеркала):
HCOOH + 2[AgNH3)2]ОН→ 2Ag + (NH4)2CO3 + 2NH3 + H2O.
Поскольку муравьиная кислота проявляет свойства альдегидов, то для нее характерна реакция «серебряного зеркала». Реакция «серебряного зеркала» является качественной реакцией на альдегиды. В результате реакции образуется металлическое серебро. Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро осаждается на них в виде тонкой плёнки, образуя зеркальную поверхность. При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка.
Получение муравьиной кислоты:
Муравьиную кислоту получают:
– окислением метанола (СН3ОН);
– как побочный продукт при окислении бутана в производстве уксусной кислоты;
– реакцией монооксида углерода с гидроксидом натрия (основной промышленный способ) в две стадии.
NaOH + CO → HCOONa → HCOOH
На первой стадии получают формиат натрия, затем его обрабатывают серной кислотой;
– разложением глицериновых эфиров щавелевой кислоты.
Безопасность при обращении с муравьиной кислотой. Требования ГОСТа:
Муравьиная кислота относится к веществам 2-го класса опасности (ГОСТ 12.1.007-76). Предельно допустимая концентрация ее в воздухе рабочей зоны производственных помещений (ПДК) составляет 1 мг/м3 (см. ГОСТ 5848-73 Реактивы. Кислота муравьиная. Технические условия (с Изменениями N 1, 2, 3)).
При превышении предельно допустимой концентрации пары муравьиной кислоты действуют раздражающе на слизистую оболочку верхних дыхательных путей и глаз; муравьиная кислота вызывает также ожог кожи.
Муравьиная кислота и ее растворы – легковоспламеняющиеся жидкости. Все работы с муравьиной кислотой следует проводить вдали от огня.
Все помещения, в которых проводятся работы с муравьиной кислотой, должны быть оборудованы общей приточно-вытяжной механической вентиляцией. Анализ муравьиной кислотой следует проводить в вытяжном шкафу лаборатории.
При работе с ней следует применять индивидуальные средства защиты. Не допускать попадания препарата внутрь организма. Первая помощь при ожогах – обильное промывание водой.
Применение муравьиной кислоты:
Муравьиная кислота применяется:
– в медицине,
– в сельском хозяйстве, как консервант сена и силоса,
– в химической промышленности в качестве растворителя,
– в пищевой промышленности в качестве консерванта,
– в текстильной промышленности для окрашивания шерсти,
– в пчеловодстве как средство для борьбы с паразитами.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
Коэффициент востребованности
5 830
| Муравьиная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Метановая кислота |
| Традиционные названия | Муравьиная кислота |
| Хим. формула | CH₂O₂ |
| Рац. формула | HCOOH |
| Состояние | Жидкость |
| Молярная масса | 46,025380 г/моль |
| Плотность | 1,2196 г/см³ |
| Динамическая вязкость | 0,16 Па·с |
| Энергия ионизации | 11,05 ± 0,01 эВ |
| Т. плав. | 8,25 °C |
| Т. кип. | 100,7 °C |
| Т. всп. | 60 °C |
| Т. свспл. | 520 °C |
| Пр. взрв. | 18 ± 1 об.% |
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа |
| Кр. точка | 588 K (315 °C), 5,81 МПа |
| Мол. теплоёмк. | 98,74 Дж/(моль·К) |
| Энтальпия образования | −409,19 кДж/моль |
| Давление пара | 120 мм. рт. ст. (16 кПа) при 50 °C |
| pKa | 3,75 |
| Показатель преломления | 1,3714 |
| Дипольный момент | 1,41 (газ) Д |
| ГОСТ | ГОСТ 5848-73 ГОСТ 1706-78 |
| Рег. номер CAS | 64-18-6 |
| PubChem | 284 |
| Рег. номер EINECS | 200-579-1 |
| SMILES | O=CO |
| InChI | 1S/CH2O2/c2-1-3/h1H,(H,2,3) BDAGIHXWWSANSR-UHFFFAOYSA-N |
| Рег. номер EC | 200-579-1 |
| Кодекс Алиментариус | E236 |
| RTECS | LQ4900000 |
| ChEBI | 30751 |
| ChemSpider | 278 |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами.
Физические и химические свойства
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Константа диссоциации: 1,772⋅10−4.
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода:
HCOOH → H2O + CO
Муравьиная кислота реагирует с аммиачным раствором оксида серебра:
HCOOH + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O
Взаимодействие муравьиной кислоты с гидроксидом меди:
HCOOH + 2Cu(OH)2 → CO2 + Cu2O + 3H2O
Проявляет все свойства одноосновных карбоновых кислот:
Образует формиаты с металлами:
HCOOH + KOH → HCOOK + H2O 2HCOOH + CaCO3 → (HCOO)2Ca + H2O + CO2
Со спиртами образует сложные эфиры:
HCOOH + CH3OH → HCOOCH3 + H2O
Получение
- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола:
CH3OH → HCHO → HCOOH - Реакцией монооксида углерода с гидроксидом натрия:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта. - Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность

Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита.
Муравьиная кислота быстро метаболизируется и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
По данным ПДК в воздухе рабочей зоны равна 1 мг/м3 (максимально-разовая). Может попадать в организм при вдыхании. Порог восприятия запаха может достигать, например, 453 мг/м3. можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию муравьиной кислоты на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от неё следует использовать более эффективные изменение технологии и средства коллективной защиты.

Нахождение в природе
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название.
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию CH3OH в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода.
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования.
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами.
