Какие свойства приписывают идеальному газу
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
- все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
- частицы находятся в непрерывном тепловом движении;
- между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма — частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Объем газа обозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м3.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
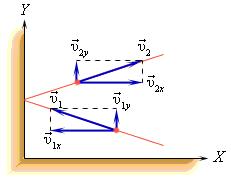
Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.
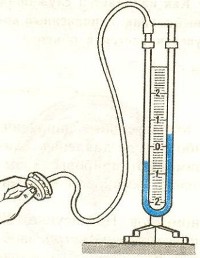
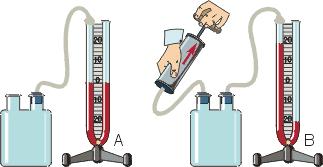
Жидкостные манометры:
- открытый – для измерения небольших давлений выше атмосферного
- закрытый — для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума

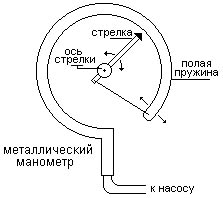
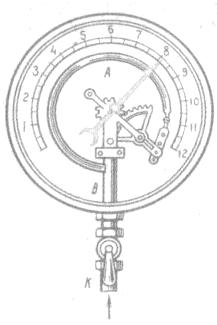
Металлический манометр – для измерения больших давлений.

Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.

Основное уравнение молекулярно-кинетической теории идеального газа.
Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
p = 1/3·m0·n·v2
m0 — масса одной молекулы газа;
n = N/V – число молекул в единице объема, или концентрация молекул;
v2 — средняя квадратичная скорость движения молекул.
Так как средняя кинетическая энергия поступательного движения молекул E = m0*v2/2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v2)/2 = 2/3·E·n
p = 2/3·E·n
Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v2
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
p = nkT
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
![]()
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим ![]() или
или ![]()
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
![]()
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
Уравнение Клайперона можно записать в другой форме.
p = nkT,
учитывая, что
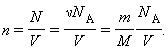
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
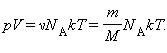
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
Соотношение
![]()
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pSΔh = R
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Таким образом, R = A.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Иногда для изучения газовых систем достаточно знать только
макроскопические параметры, характеризующие состояние всей системы.
Такими параметрами для описания газовой системы, находящейся в тепловом
равновесии, являются объем системы, ее масса, давление и температура.
Равновесным состоянием системы называют такое состояние, при котором все
ее макроскопические параметры сколь угодно долго остаются неизменными,
при этом давление и температура имеют одинаковые значения во всех частях
объема.
Исторически впервые установление связей между равновесными
макроскопическими параметрами газовых систем произведено опытным путем.
Экспериментальные газовые законы формулируются следующим образом:
1. Для данной массы газа при постоянной температуре давление газа изменяется обратно пропорционально объему (закон Бойля-Мариотта):
В соответствии с формулой (5) изотермический процесс представляется на |
2. Для данной массы газа при постоянном давлении объем газа изменяется линейно с температурой (закон Гей-Люссака):
, | (6) |
где — объем газа при 0oС, V — объем газа при температуре , — коэффициент объемного расширения газа.
3. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой (закон Шарля):
, | (7) |
где — давление газа при 0oС, P — давление газа при температуре , — термический коэффициент давления газа.
Оказалось, что для всех газов
.
Согласно формулам (6) и (7), изобарический и изохорический процессы
представляются на графиках прямыми линиями (изобарами и изохорами),
проходящими наклонно к оси температур и пересекающими ее в точке (рис.4, 5).
Точка
принята за начало отсчета (нуль) новой шкалы температур, называемой
термодинамической шкалой или шкалой Кельвина, или абсолютной шкалой.
Температура, отсчитываемая по этой шкале, называется термодинамической;
нуль этой шкалы называется нулем Кельвина.
Если цену деления термодинамической шкалы сохранить той же, что и на шкале Цельсия, то температура Т будет связана с температурой t, измеряемой по шкале Цельсия, формулой
, | (8) |
при этом 0 К = -273oС.
Из формулы (4) следует, что при температуре, равной 0 К,
,
то есть при температуре 0 К вещество исчезает. Этот явно неверный вывод
говорит о том, что экспериментальные газовые законы неприменимы в
области низких температур. При низких температурах, как будет показано
далее, вещество не может существовать в газообразном состоянии: оно
переходит в жидкое или даже твердое состояние.
Нуль шкалы Кельвина — самая низкая из возможных температур вещества,
при 0 К полностью прекращается хаотическое движение молекул в веществе.
Однако это не значит, что в нем прекращается всякое движение.
Сохраняется, например, движение электронов в атоме. В настоящее время
удается охлаждать малые объемы вещества до температуры, близкой к 0 К,
не достигая последнего лишь на несколько тысячных долей Кельвина.
С помощью термодинамической температуры закон Гей-Люссака можно записать в более простом виде:
,
где соответствует 0oС. Следовательно,
. | (9) |
При постоянном давлении объем газа пропорционален термодинамической температуре.
Предложите учащимся самим аналогичным образом преобразовать формулу (7) и получить
. | (10) |
Формулы (9) и (10) представляют собой математическое выражение газовых законов Гей-Люссака и Шарля.
Закон Дальтона. Пусть в некотором объеме находится смесь газов (например, воздух), имеющая давление P. Удалим из объема все газы, кроме одного (например, азота). Тогда он займет весь объем и будет иметь давление P1, называемое парциальным давлением первого газа.
Парциальным давлением газа, входящего в газовую смесь, называется
давление, которое имел бы этот газ, если бы он один занимал весь объем,
предоставленный смеси. Аналогично введем парциальные давления для других
газов, входящих с смесь P2, P3 и т.д.
Для смеси газов справедлив закон Дальтона: давление газовой смеси равно сумме парциальных давлений, входящих в нее газов.
… | (11) |
Закон Авогадро. На основании опытов с различными газами итальянский ученый А.Авогадро установил следующий закон:
При одинаковых температуре и давлении в равных объемах любого газа содержится одинаковое число молекул.
При нормальных условиях, то есть при давлении 1,0133·105 Па и температуре 273,16 К этот объем составляет 0,022414 м3/моль.
Закон Клапейрона. Закон установлен путем объединения законов
Бойля-Мариотта, Гей-Люссака и Шарля и описывает процессы, при которых
одновременно изменяются все три параметра состояния газа:
. | (12) |
Числовое значение постоянной В зависит от массы газа и его природы.
Уравнение Менделеева-Клапейрона. В 1875 г. Д.И. Менделеев,
исходя из законов Клапейрона и Авогадро, получил наиболее общее
выражение уравнения состояния газа, связывающее между собой объем V, давление P, температуру Т, массу m и молярную массу М газа:
. | (13) |
Постоянная
одинакова для всех газов и называется молярной газовой постоянной.
Уравнение Менделеева-Клапейрона является также экспериментальным
законом.
При выводе основного уравнения молекулярно-кинетической теории было показано, что макроскопический параметр Р связан со средней кинетической энергией поступательного движения молекул соотношением
. | (14) |
Можно показать, что и другая макроскопическая характеристика
состояния газа — термодинамическая температура — также зависит от этой
энергии.
Для одного моля газа уравнение (13) перепишем следующим образом:
, .
или
. | (15) |
Уравнение Менделеева-Клапейрона для одного моля газа запишется в виде:
. | (16) |
Сопоставив (13) и (15), получаем
. | (17) |
Где = k — постоянная Больцмана, .
Тогда уравнение (17) примет вид:
. | (18) |
Используя формулы (14) и (18), предложите учащимся получить выражение:
Из этой формулы видно, что при одинаковых температуре и давлении все газы содержат в равных объемах одинаковое число молекул.
Предложите учащимся, используя формулу (19) подсчитать число молекул в 1 м3 газа при нормальных условиях. Еще раз напомним, что нормальные условия: Па, Т = 273 К (0oС). Полученное число называется постоянной Лошмидта м-3.
Уравнение Больцмана (18) имеет очень большое значение в молекулярной
физике. Из него следует, что температура является мерой средней
кинетической энергии поступательного движения молекул.
. | (20) |
Величина
. | (21) |
называется средней квадратичной скоростью хаотического движения молекул.
Уравнение Больцмана получено для модели газа, состоящего из очень
маленьких упругих твердых шариков (ближе всего к этой модели одноатомная
молекула), находящихся в хаотическом движении и обладающих в трехмерном
пространстве тремя степенями свободы. Тогда кинетическая энергия,
приходящаяся на одну степень свободы молекулы, равна
. | (22) |
При подсчете кинетической энергии молекулы, имеющей i степеней свободы, используется формула
. | (23) |
Пример 1. Стенки сосуда, в котором находится газ температуры Т, имеют температуру Тст . В каком случае давление газа на стенки сосуда больше: когда стенки сосуда холоднее газа или когда теплее ?
Решение. Если температура стенок сосуда Тст совпадает с температурой газа Т, то молекула, ударяясь о стенку, меняет нормальную компоненту импульса на . Значит суммарное изменение импульса равно .
Когда температура стенок Тст больше температуры газа Т,
газ нагревается. Это означает, что молекулы газа отскакивают от стенки с
большей скоростью, чем налетают, а, следовательно, и с большим
импульсом. В результате изменение импульса будет больше, чем (рис.6).
Если же ,
то газ охлаждается, то есть молекулы газа отскакивают от стенки с
меньшим импульсом, чем налетают на нее. Ясно, что изменение импульса в
этом случае будет меньше, чем
(рис.7). Так как в соответствии со вторым законом Ньютона изменение
импульса пропорционально средней силе, то давление газа на стенки
больше, когда стенки теплее газа .
Пример 2. Определить среднеквадратичную скорость молекул и при нормальных условиях.
Решение. В этой задаче, несмотря на то, что молекулы являются двухатомными, мы применяем формулу
,
учитывая только 3 поступательные степени свободы. Еще раз напомним, что нормальные условия — Т = 273 К (0oС), Р — 1 атмосфера. Решая в системе СИ, имеем: для водорода , для азота .
Реальные газы. Уравнение Менделеева-Клапейрона описывает
поведение идеального газа, молекулы которого можно рассматривать как
материальные точки, не взаимодействующие друг с другом. Молекулы
реального газа имеют, как мы знаем, некоторый, хотя и очень малый,
размер и связаны между собой силами взаимодействия, правда, тоже малыми.
Однако при низкой температуре или высоком давлении, когда молекулы газа
находятся близко друг от друга, пренебрегать их размерами и силами
взаимодействия уже недопустимо.
В этих случаях уравнение состояния идеального газа оказывается весьма
неточным. Чтобы получить уравнение состояния реального газа,
голландский физик Ван-дер-Ваальс ввел в уравнение Менделеева-Клапейрона
поправки на размер молекул и на действие сил взаимодействия между ними. В
результате уравнение состояния одного моля реального газа приняло вид
. | (24) |
Выражение (24) — уравнение Ван-дер-Ваальса. Здесь а и b — постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
Если мы имеем дело не с одним, а с молями газа объемом V, то в уравнении (24) следует сделать замену:
.
Поправка в первой скобке обусловлена силами притяжения между молекулами. Она имеет размерность давления, и ее часто называют внутренним давлением. На стенку сосуда такой газ оказывает давление Р. Однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку сосуда стало бы . То есть при переходе от идеального газа к реальному давление на стенку уменьшается из-за сил притяжения между молекулами.
Поправка b связана с собственным объемом и ее размерность . При малых давлениях и высоких температурах становится большим, поэтому и ,
то есть поправки в уравнение Ван-дер-Ваальса становятся пренебрежимо
малыми, и оно превращается в уравнение Менделеева-Клапейрона. Вывод
уравнения Ван-дер-Ваальса является упрощенным, но это уравнение дает
возможность хотя бы качественно объяснить широкий круг явлений в газах и
даже в жидкостях.
На рис.8 показаны три наиболее характерные изотермы (1,2,3), соответствующие уравнению (24) при температурах . При достаточно высокой температуре изотерма близка к изотерме идеального газа. Но при температуре на изотерме появляется точка перегиба К. Точку К называют критической точкой. Соответствующие ей давление, температуру и изотерму называют также критическими.
Еще интересней ведет себя изотерма при температуре T1. Она содержит волнообразный участок САВD, между точками А и В |
Таким образом, изотермы, расположенные в области выше критической
изотермы, описывают только газообразное состояние вещества. Чем выше
температура Т3, тем ближе соответствующая изотерма к изотерме идеального
газа.
Из таблицы 1, где приведены критические температура и давление
некоторых веществ, видно, что, например, воздух в нормальных атмосферных
условиях может существовать только в газообразном состоянии, а вода —
как в жидком, так и газообразном состояниях.
Таблица 1
| Вещество | Ткр, К | Pкр, 105 Па | Вещество | Ткр, К | Pкр, 105 Па |
| Вода | 647 | 218 | Воздух (без СО2) | 132 | 38,5 |
| Аммиак | 405 | 112,3 | Азот | 126 | 33,4 |
| Углекислота | 304 | 72,7 | Водород | 33 | 13,2 |
| Кислород | 154 | 49,7 | Гелий | 5 | 2,3 |
