Какие свойства окислительные или восстановительные проявляет серная кислота

Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
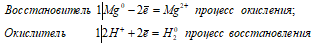
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
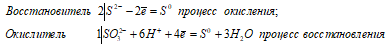
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
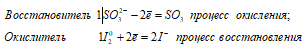
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I—
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
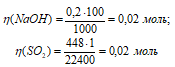
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
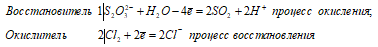
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl—+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
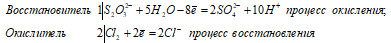
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
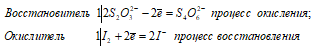
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I—
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
2. Химические свойства соединений серы с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки ЕГЭ, но также являются полезными.
Правило 2.1. Соединения S+4 преимущественно проявляют восстановительные свойства при взаимодействии с большинством окислителей, т.е. довольно легко окисляются до S+6 :
С такими окислителями как кислород, пероксид водорода и оксиды азота:
2SO2 + O2 → 2SO3 (t, kt = V2O5)
SO2 + H2O2 → H2SO4
С солями Fe+3 и Cu+2:
SO2 + 2FeCl3 + 2H2O → 2FeCl2 + H2SO4 + 2HCl
SO2 + 2CuCl2 + 2H2O → 2CuCl + H2SO4+ 2HCl
С растворами галогенов (кроме F2):
SO2 + Cl2 + H2O → H2SO4 + 2HCl
SO2 + Br2 + H2O → H2SO4 + 2HBr
SO2 + I2 + H2O → H2SO4 + 2HI
С раствором перманганата калия в различных средах:
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
Примеры реакций окисления сульфита натрия до сульфата различными окислителями:
Na2SO3 + Cl2 + H2O → Na2SO4 + 2HCl
Na2SO3 + H2O2 → Na2SO4 + H2O
Na2SO3 + H2SO4(к) → Na2SO4 + SO2 + H2O
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
3Na2SO3 + 2KMnO4 + H2O → 2Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + 2KMnO4 + 2KOH → Na2SO4 + 2K2MnO4 + H2O
3Na2SO3 + K2Cr2O7 + 4H2SO4 → 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
3Na2SO3 + K2Cr2O7 + 4H2O → 3Na2SO4 + 2Cr(OH)3 + 2KOH
Только очень сильными восстановителями S+4 восстанавливается до S0:
SO2 + 2H2S → 3S + 2H2O
SO2 + 2C → S + 2CO2
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
Серная кислота (конц.)
Правило 2.2.
- При взаимодействии H2SO4(к) со слабыми восстановителями (неметаллами: S, P, C, средне- и малоактивными металлами: Fe, Cu, Ag, сложными веществами: H2S, сульфидами металлов, солями Fe2+ и т.д.) образуются SO2 и H2O.
- При взаимодействии H2SO4(к) с сильными восстановителями (активными металлами: Li-Zn, некоторыми сложными веществами: HI, KI) образуются H2S или S.
4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S + 4H2O (возможно образование SO2 и S, так как Zn — хороший восстановитель)
+ 4H2O (возможно образование SO2 и S, так как Zn — хороший восстановитель)
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O (только при нагревании)
+ 6H2O (только при нагревании)
Al, Cr, Fe пассивируются холодной концентрированной серной кислотой (т.е. покрываются оксидной пленкой, препятствующей дальнейшей реакции). Реакции идут только при нагревании.
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
+ 2H2O (t)
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
+ 2H2O (t)
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
+ 2H2O (t)
Из галогеноводородов концентрированная серная кислота может окислить только ионы Br– и I– :
HF + H2SO4(конц.) → реакция не идет
HCl + H2SO4(конц.) → реакция не идет
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
+ 2H2O
8HI + H2SO4(конц.) → 4I2 + H2S + 4H2O
+ 4H2O
2CuI + 4H2SO4(конц.) → 2CuSO4 + I2 + 2SO2 + 4H2O
+ 4H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
+ 4HCl + 2H2O
Соли меди восстанавливают кислоту до SO2, тогда как соли активных металлов до H2S:
2CuI + 4H2SO4(конц.) → 2CuSO4 + I2 + 2SO2 + 4H2O
+ 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
+ 4H2O
Примеры реакций с солями (окисляем анион):
4H2SO4(конц., гор.) + CuS → CuSO4 + 4SO2 + 4H2O
+ 4H2O
Примеры реакций с солями (окисляем катион):
2H2SO4(к) + 2FeSO4 → Fe2(SO4)3 + SO2 + 2H2O
+ 2H2O
4H2SO4 + 2CrCl2 → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
+ 4HCl + 2H2O
Правило 2.3. Окисление соединений S–2 до S+6 происходит под действием следующих окислителей: H2O2, Cl2(водн.), HNO3(конц.):
H2S + Cl2 + 4H2O → H2SO4 + 8HCl
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O (образование S будет считаться ошибкой!)
+ 4H2O (образование S будет считаться ошибкой!)
CuS + 8HNO3(конц., гор.) → CuSO4 + 8NO2 + 4H2O
Na2S + 8HNO3(конц, гор.) → Na2SO4 + 8NO2 + 4H2O
С H2SO4(к) при нагревании сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
+ 2H2O (t)
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O (t)
+ 4H2O (t)
CuS + 4H2SO4(конц., гор.) → CuSO4 + 4SO2 + 4H2O
+ 4H2O
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2 + 4H2O
+ 4H2O
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
Без нагревания возможна реакция:
K2S + 2H2SO4 → S + SO2
+ SO2 + K2SO4 + 2H2O
+ K2SO4 + 2H2O
Источник: лекция на youtube.com от разработчиков экзамена «Методические рекомендации по подготовке ЕГЭ по химии», время 49:52.
Правило 2.4. Сера в степени окисления -2 может быть окислена до простого вещества галогенами (Cl2, Br2, I2) или солями Fe+3, Mn+7 и Cr+6 :
1. Реакции с Cl2, Br2 и I2:
H2S + Cl2 (газ) → S + 2HCl
H2S + Br2 → S + 2HBr
H2S + I2 → S + 2HI
2. Реакции с солями Fe+3, Mn+7 и Cr+6:
3H2S + 2FeCl3 → S + 2FeCl2 + 2HCl
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O
3H2S + 2KMnO4 → 3S + 2MnO2 + 2KOH + 2H2O
3H2S + 2KMnO4 + 2CO2 → 3S + 2MnO2 + 2KHCO3 + 2H2O
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3H2S + 2K2CrO4 + 2H2O → 3S + 2Cr(OH)3 + 4KOH
3H2S + 2HMnO → 3S + 2MnO2+ 4H2O
3K2S + 2KMnO4 + 4H2O → 3S + 2MnO2 + 8KOH
3H2S + Na2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + Na2SO4 + 7H2O
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
3(NH4)2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3(NH4)2SO4 + 7H2O.
Согласно разработчикам экзамена (Вебинар «Методические рекомендации по подготовке к ЕГЭ по химии от разработчиков«, время 33:41, ссылка естьв разделе «О проекте»), окисление сульфид-ионов протекает с образованием S0, но образование сульфат-иона (в реакциях с такими сильными окислителями, как KMnO4, K2Cr2O7) также будет засчитано как правильный ответ.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 декабря 2017;
проверки требуют 30 правок.
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором) .
Историческая справка[править | править код]
Издавна учёные полагали, что окисление — потеря флогистона (особого невидимого горючего вещества, термин которого ввел Иоганн Бехер), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание[править | править код]
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление[править | править код]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии у веществ в результате отдачи электронов увеличивается степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление[править | править код]
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара[править | править код]
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций[править | править код]
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных
веществ, например:
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
Примеры[править | править код]
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полу-реакции:
1) Окисление:
2) Восстановление:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
Примечания[править | править код]
- ↑ В этом, как и во многих других случаях водород рассматривают как помещённый в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется в виду в том числе и валентности.
- ↑ ОВР методом полуреакций (недоступная ссылка). Химия и химическая технология в жизни (10.07.2013). Дата обращения 19 января 2015. Архивировано 19 января 2015 года.
Литература[править | править код]
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углублённый курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
См. также[править | править код]
- Кислотно-основные реакции
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
- Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
Распространённые окислители и их продукты[править | править код]
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2кислород | Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) +0,401 (в щелочной среде) | |
| O3озон | Разные, включая кетоны и альдегиды | +2,07 (в кислой среде) | |
| Пероксиды | Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | ||
| Hal2галогены | Hal−; окисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 | |
| ClO−гипохлориты | Cl− | ||
| ClO3−хлораты | Cl− | ||
| HNO3азотная кислота | с активными металлами, разбавленная с активными металлами, концентрированная с тяжёлыми металлами, разбавленная c тяжёлыми металлами, концентрированная | NH3, NH4+ NO NO NO2 | |
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами с активными металлами | SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы S H2S | |
| Шестивалентный хром | Cr3+ | +1,33 | |
| MnO2оксид марганца(IV) | Mn2+ | +1,23 | |
| MnO4−перманганаты | кислая среда нейтральная среда сильнощелочная среда | Mn2+ MnO2 MnO42− | +1,51 +1,695 +0,564 |
| Катионы металлов и H+ | Me0 H2 | См. Электрохимический ряд активности металлов |
Зависимость степени окисления от концентрации окислителя[править | править код]
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление.
В качестве примера — реакция азотной кислоты с цинком:
- Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
- 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
- 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
- 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
- 4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Сильные окислители[править | править код]
Сильными окислительными свойствами обладает «царская водка» — смесь одного объёма азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
NOCl=NO + Cl
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе.
Царская водка окисляет даже благородные металлы — золото и платину.
Селеновая кислота — одна из немногих неорганических кислот, в концентрированном виде способная окислять золото. Более сильный окислитель даже в умеренно разбавленном растворе, чем серная кислота. Способна к окислению соляной кислоты по уравнению:
При этом продуктами реакции являются селенистая кислота, свободный хлор и вода. В то же время концентрированная серная кислота не способна окислять HCl.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
С6H5-CH2-CH3 + [O] → C6H5COOH + …
C6H6 + [O] → HOOC-(CH2)4-COOH
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
К сильным окислителям относятся также оксид меди(III), озонид цезия, надпероксид цезия, все фториды ксенона.
Очень сильные окислители[править | править код]
Условно к «очень сильным окислителям» относят вещества, превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, фторид серебра(II), катионная форма Ag2+, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
См. также[править | править код]
- Окислительно-восстановительные реакции
