Какие свойства металлические или неметаллические характерны для селена


Черный металлические кристаллы селена, образованный на горящем угольном отвале. Ширина изображения — 1,8 мм. Германия, Северный Рейн-Вестфалия, Аахен, Альсдорф, шахта Анна
Селен — хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). Относится к халькогенам. Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. В организме человека содержится 10—14 мг селена, большая его часть сконцентрирована в печени, почках, селезенке, сердце, яичках и семенных канатиках у мужчин. Селен входит в состав белков мышечной ткани, белков миокарда.
СТРУКТУРА
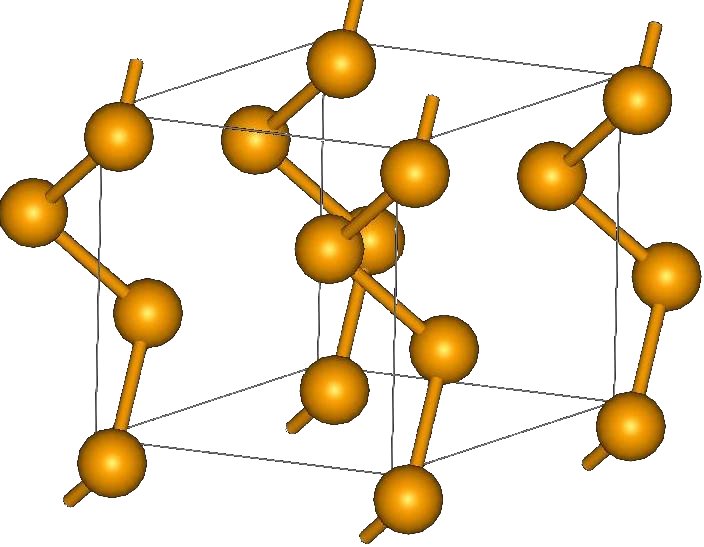
Кристаллическая структура селена
Существует две модификации селена:
1. Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
2. Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен — это одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты H2SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением. Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
СВОЙСТВА

Черный, стеклообразный аморфный и красный аморфный селен
Температура плавления вещества – 217 (α-Se) и 170–180 градусов Цельсия (β-Se), а закипает он при температуре 6850.
Степени окисления, что селен проявляет в реакциях: (-2), (+2), (+4), (+6), он устойчив к воздуху, кислороду, воде, соляной кислоте и разбавленной серной кислоте.
Поддается растворению в азотной кислоте высокой концентрации, «царской водке», более длительно растворяется в щелочной среде с окислением. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА

Селен
Поскольку селен примешен к сере, элемент извлекают из сульфата железа. Для этого даже делать особо ничего не надо. 34-ый металл накапливается в пылеочистительных камерах сернокислотных заводов. Забирают селен и из установок электролиза меди. После него остается анодный шлам. Из него-то и выделяют 34-ый элемент. Достаточно обработать шлам растворами гидроксида натрия и диоксида серы. Полученный селен нужно очистить. Для этого используют метод дистилляции. После, металл подсушивают.
ПРОИСХОЖДЕНИЕ

Отличные глянцевые кристаллы из горящих угольных отвалов. Ширина изображения — 1,8 мм. Германия, Северный Рейн-Вестфалия, Аахен, Альсдорф, шахта Анна
Содержание селена в земной коре — около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4·10-4 мг/л.
ПРИМЕНЕНИЕ

Селен
Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз). Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл). Полупроводниковые свойства селена в чистом виде широко использовались в середине 20-го века для изготовления выпрямителей, особенно в военной технике по следующим причинам: в отличие от германия, кремния, селен малочувствителен к радиации, и, кроме того, селеновый выпрямительный диод обладает уникальным свойством самовосстанавливаться при пробое: место пробоя испаряется и не приводит к короткому замыканию, допустимый ток диода несколько снижается, но изделие остается функциональным. К недостаткам селеновых выпрямителей относятся их значительные габариты.
Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Согласно исследованиям прием 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки — на 58 %, опухолями простаты на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.
Малые концентрации селена подавляют гистамин и за счет этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.
Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе
Селен (англ. Selenium) — Se
| Молекулярный вес | 78.96 г/моль |
| Происхождение названия | От греческого, Selene, «богиня Луны» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.53
| Strunz (8-ое издание) | 1/B.03-30 |
| Nickel-Strunz (10-ое издание) | 1.CC.10 |
| Dana (7-ое издание) | 1.3.3.1 |
| Dana (8-ое издание) | 1.3.4.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | серый переходящий в сероватый черный, красновато- серый, красный |
| Цвет черты | красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | ясная совершенная по {0112} |
| Твердость (шкала Мооса) | 2 |
| Прочность | гибкий |
| Плотность (измеренная) | 4.8 г/см3 |
| Радиоактивность (GRapi) | |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | одноосный (+) |
| Показатели преломления | nω = 3.000 nε = 4.040 |
| Максимальное двулучепреломление | δ = 1.040 |
| Оптический рельеф | очень высокий |
| Оптическая анизотропия | очень сильная |
| Цвет в отраженном свете | белый в воздухе, более темный белый до серовато- коричневого в иммерсии, красный напросвет |
| Плеохроизм | видимый от кремово-белого до коричневого |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 3 2 — трапецоэдральный |
| Пространственная группа | P31 2 1 |
| Сингония | тригональная |
| Параметры ячейки | a = 4.3662Å, c = 4.9536Å |
mineralpro.ru
13.07.2016
Общие сведения и методы получения
Селен (Se) —элемент темно-серого цвета с коричневым оттенком. Впервые обнаружен Берцелиусом в 1817 г. в отходах сернокислотного производства. Новое вещество имело свойства, сходные со свойствами теллура, и названо селеном (греческое название Луны), так как он встречается вместе с теллуром, открытым ранее и названным в честь Земли.
Содержание селена в земной коре 6*10~5% (по массе). В морской воде содержится 0,004 мг/л селена.
Чистые селеновые минералы чрезвычайно редки. Важнейшие минералы селена: берцелианит CuSe, тиеманит HgSe, науманнит Ag2Se, клауста-лит PbSe, онофрит Hg(Se, S), халькоменит CuSe03-2H20. Описан самородный селен. Практического значения селеновые минералы не имеют.
Будучи аналогом и постоянным спутником серы, селен содержится в небольших количествах в сульфидных минералах меди, цинка, свиица и в виде примесей в самородной сере.
Промышленное производство селена началось в начале XX в. Источниками промышленного получения селена служат шламы медеэлектро-литных заводов, сернокислотного и целлюлозно-бумажного производства. В шламах селен присутствует вместе с серой, теллуром, тяжелыми и благородными металлами. Для извлечения селена шламы фильтруют и подвергают либо окислительному обжигу (около 700 °С), либо нагреванию с коицентрнрованиой серной кислотой. Образующийся летучий оксид селена Se02 улавливают в скрубберах и электрофильтрах. Из растворов технический селен восстанавливают оксидом серы (S02) до элементарного состояния. Применяют также окислительное спекание шлама с содой с последующим выщелачиванием селенита и селената натрия водой. Из полученного раствора при помощи оксида серы (S02) восстанавливают элементарный селен.
Технический селен содержит 97,5—99 % Se. Для получения селена высокой чистоты его подвергают дистилляции в вакууме, перекристаллизации, сульфитно-циклическому методу обработки и др.
Окислительно-восстановительный метод дает возможность получить селен чистотой 99,999 %. Зонной плавкой можно повысить содержание селена до 99,9999 %.
Наиболее чистый селен получают термической диссоциацией селено-водорода (H2Se). Селен высокой чистоты содержит не более Ы0~5% (по массе) примесей.
Технический селей, предназначенный для получения чистого селена,
выпускают трех марок: СТО, СТ1, СТ2. <
Технический селен поставляют в виде порошка, слитков и гранул. Размеры слитков и гранул устанавливаются соглашением сторон.
Физические свойства
Атомные характеристики. Атомный номер 34, атомная масса 78,96 а. е. м., атомный объем 16,42*10—6 м3/моль, атомный радиус 0,16 нм, ионный радиус Se2- 0,198 нм, Se4+ 0,069 нм, Se6+ 0,035 нм. Электронная конфигурация внешних оболочек 4s24p4. Значения потенциалов ионизации J (эВ): 9,75, 21,5; 32,0. Электроотрицательиость 2,4. Селен состоит из смеси шести устойчивых изотопов: 74 Se (0,87 %); 76 Se(9,02 %); «Se (7,58 %); 78 Se (23,52 %); 8 °Se (49,82 %); e2 Se (9,19 %).
Селен существует в различных аллотропических модификациях: аморфный селен (порошкообразный, коллоидный н стекловидный) и кристаллический (моноклинный — а- и 6-формы и гексагональный у-форма).
Порошкообразный селен имеет красный цвет; плотность при 298 К равна 4,250 Мг/м3. Получают его при восстановлении из растворов селенистой кислоты H2Se03 сильными восстановителями (оксидом серы (IV), гидразином нли солянокислой солью гидроксиламина) в присутствии сильных кислот, быстрым охлаждением паров селена и другими способами. Красный порошок при выдержке становится черным и при нагревании превращается в гексагональную модификацию.
Коллоидный селен получают восстановлением разбавленных водных растворов растворимого селена оксидом серы (IV), гидразингидратом, декстрозой, трнхлоридом титана или пропусканием электрическою тока через раствор селенистой кислоты (анод—платиновый, катод — покрыт селеном), а также другими способами. Цвет коллоидного селена зависит от условий осаждения и изменяется от фиолетового до красного; плотность такая же, как и порошкообразного селена.
Стекловидный селен-—хрупкая масса черного цвета, обладает стеклянным блеском и представляет собой переохлажденную жидкость. Плотность его при 298 К равна 4,280 Мг/м3. Получают стекловидный селей при нагревании любой модификации селена выше 493 К с последующим быстрым охлаждением. При хранении в теплом месте стекловидный селен постепенно кристаллизуется в гексагональный.
Селен с моноклинной решеткой — кристаллы темно-красного цвета. Получают его при низкотемпературном выпаривании сероуглерода, содержащего растворенный Селен. Имеет две формы: а с параметрами а = =0,9054 нм, 6=0,9083 нм, с = 1,601 нм, ^В = 90°42′ и В с параметрами а=0,931 нм, 6 = 0,807 нм, с= 1,285 нм, ^В = 93°08′. Плотность a-Se
р=4,480 Мг/м3; в -Se р=4,400 Мг/м3. Прн нагревании моиоклннная решетка переходит в гексагональную. Энергия кристаллической решетки 202,5 мДж/кмоль.
Селен с гексагональной решеткой — кристаллы серого цвета плотностью 4,807 Мг/м3 при 293 К. Получают его из других форм селена путем нагрева до температуры плавления и последующего медленного охлаждения до 453—483 К с выдержкой при этой температуре. Представляет собой термодинамически стабильную при нормальных условиях модификацию. Периоды решетки: а=0,4363 нм, с = 0,4959 нм, с /а — 1,137.
Работа выхода электронов равна ф = 4,72 эВ, эффективное поперечное сечение захвата тепловых нейтронов 12,3 -10~28 м2.
Химические свойства
В соединениях обычно проявляет степени окисления +4, +6, —2.
Электрохимический эквивалент селена со степенью окисления +6 равен 0,13637 мг/Кл.
По химическим свойствам селен близок к сере и теллуру, занимая промежуточное положение между ними. По химическому поведению —■ типичный неметалл.
Элементарный селен, особенно аморфный и мелкодисперсный, химически активен. При нагревании на воздухе или в кислороде горит голубым пламенем. При комнатной температуре реагирует с фтором, хлором, бромом, не взаимодействует с кислородом. При высокой температуре реагирует с водородом, с большинством металлов. Вода на селен почти не действует при комнатной температуре, но прн нагревании идет в небольшой степени обратимый гидролиз. Сильные окислители окисляют селей до шестнвалентиого селена.
Соляная и разбавленная серная кислота на селен не действуют, азотная кислота окисляет его до селенистой кислоты H2Se03, концентрированная серная кислота растворяет металлический селен. Селен хорошо растворяется в царской водке, в концентрированных растворах щелочей, в цианистом калии, реагирует с растворами солей серебра и золота, растворяется в растворах сульфидов и полисульфидов щелочных металлов. При взаимодействии селена с пероксидом водорода Н202, а также с озоном 03 в присутствии влаги образуется селенистая кислота H2Se03, соли которой (селениты) нерастворимы в воде, кроме солей щелочных металлов. При действии сильных окислителей (пермаиганат калия и т. п.) селенистая кислота превращается в селеновую кислоту H2Se04, соли которой — селенаты — по свойствам сходны с сульфатами.
Все соединения селена ядовиты, поэтому при работе с ними следует применять правила техники безопасности.
С кислородом селен образует ряд оксидов SeO, Se02, Se2C >5, Se03. Оксид селена (II) SeO образуется при нагревании оксида Se02 до 1000 °С. Устойчив только в парах при высокой температуре. Оксид селена (IV) Se02 —сильный окислитель—образуется при сгорании иа воздухе или в кислороде, при растворении в воде дает селенистую кислоту.
Оксид селена (V) SeOs образуется при нагревании оксида селена (VI) Se03 до 513 К. При 260 °С он разлагается до Se02, расплывается на воздухе, в воде растворяется, образуя кислоту H2Se04; сильный окислитель, бурно реагирует со многими органическими веществами.
Оксид селена (VI) Se03 образуется путем дегидратации селеновой кислоты H2Se04 фосфорным ангидридом с последующей отгонкой Se03 в вакууме. Это бесцветное кристаллическое вещество, хорошо растворимое в воде, химически активный, сильный окислитель.
С серой селен образует соединения Se2S н SeS2. Растворимость серы в твердом селене ~4 %. При введении в селен до 5 % S электропроводность его повышается.
С углеродом селен образует селеноуглерод CSe2. Он получается при взаимодействии HSe с СС14 при 500 «С. Селеноуглерод — золотисто-желтая жидкость плотностью 2,650 Мг/м3, имеющая температуру кипения 125 «С.
С фосфором селен сплавляется в любых отношениях, в результате чего получаются стекла: Se3P2, Se3P4, Se5P2. Кристаллическое строение имеет только Se3P4.
С кремнием селен образует летучий силицид SiSe и нелетучий SiSe2. Эти силициды гидролизуются во влажном воздухе.
По составу галогениды селена очень разнообразны. Это гексафторид селена SeFe, тетрафторид селена SeF4, тетрахлорнд селена SeCl4, дисе-лендихлорид Se 2 Cl2, тетрабромид селена SeBr4, днселендибромид Se2Br2. В парах существуют дихлорид селена SeCl2 и дибромид селена SeBr2.
С иодом селен не взаимодействует. Получены оксигалогениды селена: SeOF2, SeOCh, SeOBr2.
При пропускании паров селена в смеси с водородом над бором при температуре 850—900 °С образуется селенид бора B2Se3. Очень гигроскопичный, легко гидролизующнйся порошок с температурой плавления 475 °С.
Селен и теллур сплавляются в любых отношениях с образованием непрерывных твердых растворов.
Соединения селена с металлами носят название селенидов. Они могут быть получены как синтезом из элементов, так и косвенными методами.
Селеииды, как правило, обладают полупроводниковыми свойствами. В воде растворимы только селениды щелочных и щелочноземельных металлов. В последнее время большое значение благодаря полупроводниковым свойствам приобрели селеииды подгруппы цинка (MeSe), подгруппы германия (MeSe), подгруппы мышьяка (AJe2Se3). Все они химически стойки и растворяются только в концентрированных минеральных кислотах при нагревании или в царской водке.
Известны селеиорганические соединения разных классов:
— алкилселеииды — диэтилселеиид (С2Н6) 2 Se; •— арнлселеииды — дифенилселенид (CeH5)2Se;
— диалкилселениды и диарилселениды типа RSe— SeR’;
— галогеиоселениды — фенилселенобромид CeH5SeH;
— селеиолы (аналоги спиртов) — этанселеиол СгНбБеН;
— селеиолаты (аналоги алкоголятов) — фенилселенолат натрия C6H5SeNa;
— селенокетоиы — диметилселенокетои CH3CSeCH3;
— селеноальдегиды типа RCHSe;
— селеиокарбоновые кислоты типа RCOSeH.
Некоторые классы соединений содержат связанный с селеном» кислород. Существуют разнообразные гетероциклические соединения, в состав цикла которых входит селей.
Технологические свойства
Технологические свойства селена зависят от его термической обработки, которая определяет микроструктуру поликристаллического селена, образующегося при превращении из черной (аморфной) формы.
Селен обладает значительной хрупкостью при комнатной температуре, однако при повышении температуры до 373 К пластичность увеличи-
вается и селен поддается прессованию. Прессованные прутки селена 1 ,меют преимущественную ориентацию, зерен в направлении деформации.
Области применения
Важнейшие области применения селена — электротехника, металлур! ия, стекольная и резиновая промышленность.
Широкое использование селена в электротехнике основано на большой чувствительности его к незначительным колебаниям освещения: он изменяет электропроводность под действием падающего иа него света (фотоэлементы с запорным слоем для сигнальных установок, фото-.раизисторы для телевидения, ксерография, аппараты, работающие по ьринципу снятия электростатического заряда на освещенных местах оарабаиа, покрытого селеном, в электрорентгенографии).
Селен используют как полупроводниковый материал: из него изготавливают селеновые выпрямители, применяемые для зарядки аккумуляторов, для питания анодных и накальных цепей аппаратуры связи, а ыкже в измерительных приборах.
В металлургии селен применяют как модификатор для создания мелкозернистой структуры стали. Присадка селена улучшает способность малоуглеродистых и некоторых нержавеющих сталей к механической 1 ,оработке.
В стекольной промышленности селей используется для устранения зеленоватого оттенка стекла, вызываемого примесями соединений железа: при добавке 0,25 % Se стекло окрашивается в розовый и красный цвет, добавка 0,6 % Se придает стеклу черный цвет.
Особый интерес представляют не содержащие оксидов (сульфидные и арсенидные) стекла с добавкой селена и теллура, ие пропускающие инфракрасных лучей в очень широком интервале длин волн. Селей входит в состав некоторых пигментов для керамики, глазурей н эмалей.
В резиновой промышленности селен используют для сокращения продолжительности процесса вулканизации, повышения временного сопротивления каучука, улучшения процесса его старения и повышения i опротивления истиранию (на 50 %). Добавка селена при вулканизации 1 аучука придает ему огнестойкость.
В химической промышленности селей применяют как катализатор в процессах гидрогенизации — дегидрогенизации, в процессах окисления органических веществ, галогеиирования и др.
Добавка селена увеличивает стойкость смазочных масел против окисления.
Селен входит в состав различных дезинфицирующих веществ, инсек-.ицидов, фунгицидов, гербицидов, некоторых фармацевтических препаратов. Применяется для изготовления красителей, в фотографии.
Несмотря на токсичность, селен используют в небольших количествах в медицине: как добавку к мылу (сульсеновоемыло), для производства некоторых лекарств. Селен также идет для синтеза различных се-ленидов, обладающих полупроводниковыми свойствами.
Селен вводят в составы, применяемые для полирования медных галь-. анических покрытий. Применяют селен также в качестве огнестойкого ^’зедства для оболочек кабелей коммуникационных щитов.
Селеноводород H2Se используют в химическом анализе в качестве , „’агента для осаждения германия, оксид селена (IV) применяют при Органическом синтезе как окислитель и исходный продукт для получена различных органических соединений, добавляют к смазочным мас сам как аитиоксидант.
Некоторые селениды служат катализаторами; селенид кадмия CdSe
является основным красителем в производстве рубиновых стекол, в производстве керамики и эмалей.
Оксихлорид селена SeOCb — один из самых сильных растворителей. Он растворяет резину, клей, синтетические фенольиые смолы и другие органические вещества, а также применяется как реагент для отделения и очистки различных углеводородов н активирования древесного угля.
