Какие свойства элементов можно считать непериодическими
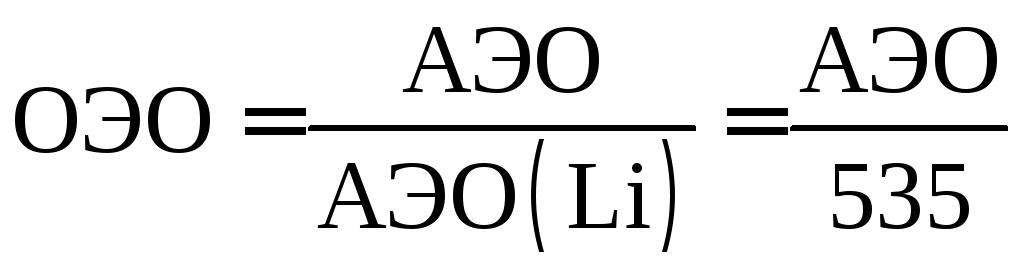
При рассмотрении свойств элементов отметим, что причиной их периодического изменения является периодичность структур электронных слоев и оболочек атомов. Важнейшими периодически изменяющимися свойствами свободных атомов являются радиусы атомов, энергия ионизации и сродство к электрону.
РАДИУСЫ АТОМОВ И ИОНОВ. Изолированный атом не имеет строго определенного размера из-за волновых свойств электрона. Следовательно, понятие размера атома, его радиуса весьма условно. Тем не менее, часто необходимо знать хотя бы приближенные значения радиусов атомов. Для их оценки используют так называемые ЭФФЕКТИВНЫЕ РАДИУСЫ. Это радиусы, которые имеют атомы, входя в состав реальных простых веществ. Их обозначают .
Эффективные атомные радиусы элементов в периодах уменьшаются от щелочного металла к галогену. Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая преобладает над силами взаимного отталкивания электронов. Происходит сжатие электронной оболочки. Наиболее заметное уменьшение эффективного радиуса наблюдается для s- и р – элементов. В рядах d и f – элементов радиусы изменяются более плавно вследствие заполнения электронами второй и третьей снаружи оболочки.
В главных подгруппах с увеличение главного квантового числа происходит заметное увеличение радиуса атома. Для элементов побочных подгрупп изменение радиусов незначительное, а при переходе от пятого к шестому периоду эффективные радиусы атомов практически не изменяются. Это является следствием сжатия электронной оболочки в семействе лантоноидов, которое и компенсирует увеличение объема атома.
При отрыве электрона с внешнего уровня атома происходит уменьшение эффективного радиуса, а в случае образования отрицательного иона – увеличение. Ионные радиусы, как и атомные, являются периодической функцией заряда ядра.
ЭНЕРГИЯ ИОНИЗАЦИИ. Мы уже знаем, что отдельный атом в основном состоянии представляет собой наиболее устойчивую систему из данных частиц. Поэтому для любого изменения структуры этой системы требуется затрата энергии. Величина энергии, которая затрачивается для отрыва одного электрона от нейтрального атома в основном состоянии, называется энергией ионизации данного атома (), или ионизационным потенциалом. Эту энергию обычно относят к одному молю атомов и выражают в килоджоулях на моль или электроновольтах (эВ).
Энергия ионизации – важная характеристика атома. Она позволяет судить о том, насколько прочно связаны электроны в атоме.
В группе при увеличении порядкового номера элемента наблюдается уменьшение энергии ионизации. Оно связано с увеличением радиуса атома.
В периодах энергия ионизации атомов слева направо возрастает. Это вызвано сжатием электронной оболочки вследствие увеличения эффективного заряда ядра. Наименьшей является прочность связи
— электрона с ядром (при . Поэтому атомы щелочных металлов имеют самые низкие значения энергии ионизации. Причем, с увеличениям n их энергия ионизации понижается вследствие экранирующего действия внутренних электронов. Эта закономерность имеется и у р- элементов (за исключением ). Атомы благородных газов имеют максимальную энергию ионизации при данном .
Отрыв второго, третьего и т.д. электронов требует гораздо большей затраты энергии. Это связано с ростом заряда образующегося положительного иона. Энергия ионизации, например, для и соответственно равна 5,14эВ и 47,3эВ.
Сравнение электронных структур атомов и значений энергии ионизации позволяет заключить, что ее максимальными значениями обладают атомы с завершенными внешним слоями и , т.е. атомы благородных элементов.
СРОДСТВО К ЭЛЕКТРОНУ. В ряде случаев важно оценить способность атома присоединять электроны. Эта способность характеризуется значением энергии, которая затрачивается или выделяется при присоединении электрона к нейтральному атому в основном состоянии и называется сродством атома к электрону (). Способность атома присоединять электроны тем больше, чем больше величина его сродства к электрону. По сравнению с энергией ионизации значение сродства к электрону невелико, поскольку избыточный электрон приводит к усилению межэлектронного отталкивания и повышению энергии атомной орбитали.
Минимальное сродство к электрону наблюдается у атомов, имеющих завершенные — и — оболочки, мало оно и у атомов с конфигурацией (азот, фосфор, мышьяк).
Наибольшим сродством к электрону обладают атомы элементов подгрупп VII А, имеющие конфигурацию . Как правило, у элементов третьего периода сродство к электрону больше, чем у элементов второго периода.
Таким образом, в большинстве случаев сродство к электрону в ряду атомов изменяется в той же последовательности, что и их энергия ионизации: растет с ростом числа электронов на внешнем уровне атомов данного периода и уменьшается с ростом радиусов атомов в пределах данной группы или подгруппы.
Практическое использование всех рассмотренных характеристик ограничено тем, что они относятся к изолированным атомам. В случае неизолированных атомов часто используют эмпирическую величину, называемую ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ (ЭО). Ее ввел Л.Полинг как свойство связанного атома притягивать электроны, точнее – электронную плотность. Электронная плотность смещается к тому из атомов, который имеет большую электроотрицательность. Электроотрицательность измеряется в тех же единицах, что и энергия ионизации. Она зависит от многих факторов: электронной структуры, наличия вакантных орбиталей, числа и вида соседних атомов и т.д. Поэтому для данного атома электроотрицательность не может быть постоянной. На практике используют усредненную величину.
В каждом периоде электроотрицательность растет по мере накопления электронов в атомах, т.е. слева направо. В каждой группе она убывает по мере возрастания радиусов атомов. Наибольшей электроотрицательностью обладают самые маленькие атомы с семью внешними электронами (атомы галогенов малых периодов). Наименьшая электроотрицательность у самых больших атомов с одним внешним электроном (атомы щелочных металлов больших периодов).
Однако в этих закономерностях много исключений. Таким образом, применяя эту величину, не следует ее не переоценивать.
НЕПЕРИОДИЧЕСКИЕ СВОЙСТВА. Это свойства элементов, которые с порядковым номером изменяются монотонно. К их числу относятся, например, удельная теплоемкость простых веществ, частоты линий рентгеновского спектра и др.
В заключение подчеркнем, что в периодической зависимости от заряда ядра находятся не только свойства отдельных атомов. Периодически зависят от заряда ядра атома многие свойства аналогичных по составу и структуре веществ: температуры кипения и плавления, энергии диссоциации, магнитные свойства и др.
Периодические и непериодические свойства элементов. . [c.430]
НЕПЕРИОДИЧЕСКИЕ И ПЕРИОДИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ [c.59]
Свойств, для которых отсутствует периодическая зависимость от порядковых номеров элементов, очень мало. На первый взгляд, к «непериодическим свойствам можно отнести удельную теплоемкость простых веществ. Действительно, атомная теплоемкость С— [c.34]
По мере изучения различных свойств элементов и их соединений обнаруживалось, что многие свойства, которые в течение длительного времени рассматривались как непериодические, на самом деле оказались периодическими. Поэтому развитие периодического закона Д. И. Менделеева сопровождалось увеличением числа периодических свойств и уменьшением числа непериодических. [c.59]
Строение электронной оболочки и свойства элементов. Структура электронной оболочки атомов химических элементов изменяется периодически с ростом порядкового номера элемента. Поскольку свойства есть функция строения электронной оболочки, они должны находиться в периодической зависимости от заряда ядра атома. И действительно, для самых разнообразных характеристик элементов указанная зависимость выражается периодическими кривыми, имеющими ряд максимумов и минимумов. Даже такие на первый взгляд непериодические свойства, как удельная теплоемкость простых веществ, частота линий рентгеновского спектра элементов и т.д., при внимательном анализе оказываются периодическими. Объясняется это тем, что периодичность присуща всей электронной оболочке атолюв, а не только ее внешним слоям. Рассмотрим кратко наиболее важные периодические свойства элементов. [c.45]
По характеру изменения в зависимости от атомных номеров все свойства химических элементов могут быть разделены на две группы — непериодические и периодические. К непериодическим свойствам относятся такие, которые являются монотонными функциями зарядов ядер атомов (атомных номеров). Для периодических свойств наблюдается периодическая зависимость от атомных номеров. [c.59]
Некоторые физические свойства элементов, такие, как масса атомов, число электронов в атомах, длина волны характеристичёского рентреновского излучения, атомная теплоемкость металлов, изменяются монотонно, т.е. непериодически. Многие свойства атомов й все химические свойства соединений изменяются периодически увеличиваясь или усиливаясь, напрймер, на протяжении периода, они уменьшаются или ослабляются в начале следующего периода. [c.295]
Как утверждает периодический закон, химические и многие физические свойства элементов изменяются периодически как функции определенного свойства атомов, которое изменяется постепенно, непериодически, от одного элемента к другому. Вначале считали, что этим непериодическим свойством является атомный вес. Поэтому периодический закон в первоначальном виде формулировался так Свойства элементов являются периодической функцией их атомных весов. Позже было установлено, что в действительности непериодическим свойством, в зависимости от которого периодически изменяются остальные свойства, является атомный номер. Под атомным номером подразумевается число положительных электрических зарядов ядер атомов каждого элемента. Известные 104 элемента атомные номера, изменяю- [c.53]
Структура электронной оболочки атомов химических элементов изменяется периодически с ростом порядкового номера элемента. Поскольку свойства есть функция строения электронной оболочки, они должны находиться в периодической зависимости от заряда ядра атома. И действительно, для самых разнообразных характеристик элементов указанная зависимость выражается периодическими кривыми, имеющими ряд максимумов и минимумов. Даже такие на первый взгляд непериодические свойства, как удельная теплоемкость простых веществ, частоты линий рентгеновского спектра элементов и т. д., при внимательном анализе оказываются периодическими. [c.61]
Вопросы для самопроверки 1. Какова современная формулировка периодического закона Д. И. Менделеева 2. Какая закономерность позволила доказать, что заряд ядра атома элемента равен порядковому номеру элемента в периодической системе элементов 3. Что такое энергия ионизации и энергия сродства к электрону Какое свойство атома они характеризуют 4. Что такое электроотрицательность 5. Как изменяются металлические и неметаллические свойства элементов с увеличением порядкового номера в малых и больших периодах 6. Как изменяются металлические свойства элементов в главных подгруппах в связи с изменением радиуса атома элемента 7. Каков порядок заполнения электронных слоев атомов элементов в малых и больших периодах С атомов каких элементов начинают формироваться 3(1-, 4 -, 4/-, 5й-, 5/- и 6 -подуровни 8, На какие электронные семейства классифицируются элементы в зависимости от характера заполнения электронных оболочек 9. Какие элементы называются типическими Какие элементы называются электронными аналогами (полными и неполными) 10. Какие свойства элементов изменяются периодически и какие непериодически с увеличением заряда ядра атома элемента 11. Как изменяются основные и кислотные свой- [c.14]
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
246,5 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху вниз): увеличивается… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Как изменяются свойства в следующих цепочках mn ti ca?
Всем, привет! Тема семьи и отношений очень близка мне, но, став мамой, нужно…
Они у вас расположены не совсем в правильноп порядке, сначла идёт Кальций, затем Титан , а уже дальше Марганец. Если брать измения в группе , то слева направо начинает уменьшаться радиус атома, увеличивается окислительная активность, ослабляются металлические свойства.
Что значит «сильные поля у атомов» в физике?
Сусанна Казарян, США, Физик
А то и значит, что в атомах огромные электростатические поля удерживают электроны на квантовых орбитах. Оценим количественно эти поля, используя квазиклассическое приближение Бора. Заряд протона q = 1,6×10⁻¹⁹ Кл. Напряжённость электростатического поля на первой Боровской орбите (радиус, r ≈ 5,3×10⁻¹¹ м) равен |Е| = kq/r² ≈ 5×10¹¹ В/м, где k ≈ 9×10⁹ Н⋅м²⋅Кл⁻². Таких огромных полей в природе нет, кроме как в атомах и в атомных ядрах.
Для сравнения, пробивная напряжённость электростатического поля в воздухе равна около 3×10⁶ В/м, что соответствует средней напряжённости электростатического поля, создаваемая грозовым облаком непосредственно перед формированием молнии. Видно, что это значение на 5 порядков (в 100000 раз) меньше, чем электрическое поле в атоме.
Кстати, именно такие гигантские электрические поля и приводят к частоте вращения (в квазиклассическом приближении) электрона в атоме водорода ~10¹⁶ оборотов в секунду и электрическому току на первой Боровской орбите атома водорода ~1 мА.
Почему у кислорода валентность 2, а не 6?
В таблице Менделеева кислород находится во втором периоде шестой группы, порядковый номер 8. Это означает, что у него всего имеется 8 электронов и 2 энергетических уровня, на которых эти электроны располагаются.
На первом уровне (который ближе к ядру атома) два S-электрона, а на втором (внешнем) — два S и четыре Р-электрона.
Валентность элемента зависит от числа неспаренных электронов, которые находятся на внешнем уровне. У кислорода их будет всего два.
Рассмотрим строение внешнего уровня атома кислорода. На нем всего 6 электронов.
Два S-электрона находятся в паре на S-подуровне, на нем может поместиться всего два электрона, вот они его и заняли.
На Р-подуровне может поместиться максимум 6 электронов на трех орбиталях. У кислорода 4 электрона. Два из них заняли одну орбиталь, образуя пару. А два распределились каждый на своей орбитали, то есть остались неспаренными.
Так как валентность зависит от числа неспаренных электронов, а у кислорода их два, то и валентность кислорода будет равна 2.
Валентность кислорода не может равняться 6, так как у него отсутствует d-уровень, на который могли бы перейти электроны, разрушив пары и став неспаренными. В отличие от кислорода, все остальные элементы 6 группы, начиная с 3 периода, имеют d-уровни, на которые могут переходить электроны. Поэтому у всех остальных элементов высшая валентность может равняться 6.
Так как электронное
строение элементов изменяется
периодически, то соответственно
периодически изменяются и свойства
элементов, определяемые их электронным
строением, такие как энергия ионизации,
размеры атомов, окислительно-восстановительные
и другие свойства.
Размеры атомов
и ионов. Вследствие
волновой природы электрона атом не
имеет строго определенных границ.
Радиусы атомов и ионов являются условными
величинами. Их обычно вычисляют из
межатомных расстояний, которые зависят
не только от природы атомов, но также и
от вида химической связи между ними.
Зависимость атомных
радиусов (r)
от заряда ядра (Z)
имеет периодический характер. В пределах
одного периода с увеличением Zпроявляется тенденция к уменьшению
размеров атомов. Например, во втором
периоде атомные радиусы имеют следующие
значения:
Li | Be | B | C | N | O | F | |
r, | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,066 | 0,064 |
Это объясняется увеличением притяжения
электронов внешнего слоя к ядру по мере
возрастания заряда ядра. В подгруппах
сверху вниз атомные радиусы возрастают,
т.к. увеличивается число электронных
слоев:
r, | r, | ||
Li | 0,155 | N | 0,071 |
Na | 0,189 | P | 0,130 |
K | 0,236 | As | 0,148 |
Rb | 0,248 | Sb | 0,161 |
Cs | 0,268 | Bi | 0,182 |
Потеря атомом электронов приводит к
уменьшению его эффективных размеров,
а присоединение избыточных электронов
– к увеличению. Поэтому радиус
положительного иона (катиона) всегда
меньше, а радиус отрицательного иона
(аниона) всегда больше, чем радиус
соответствующего электронейтрального
атома. Например:
r, | r, | ||
K0 | 0,236 | Cl0 | 0,099 |
K+ | 0,133 | Cl– | 0,181 |
Радиус иона тем
сильнее отличается от радиуса атома,
чем больше заряд иона:
Cr0 | Cr2+ | Cr3+ | |
r, | 0,127 | 0,083 | 0,064 |
В пределах одной подгруппы радиусы
ионов одинакового заряда возрастают с
увеличением заряда ядра:
r, | r, | ||
Li+ | 0,068 | F– | 0,133 |
Na+ | 0,098 | Cl– | 0,181 |
K+ | 0,133 | Br– | 0,196 |
Rb+ | 0,149 | I– | 0,220 |
Такая закономерность
объясняется увеличением числа электронных
слоев и растущим удалением внешних
электронов от ядра.
Энергия ионизации
и сродство к электрону.
В химических реакциях ядра атомов не
подвергаются изменению, электронная
же оболочка перестраивается, причем
атомы способны превращаться в положительно
и отрицательно заряженные ионы. Эта
способность может быть количественно
оценена энергией ионизации атома и его
сродством к электрону.
Энергией
ионизации
(потенциалом
ионизации) I
называется количество энергии, необходимое
для отрыва электрона от невозбужденного
атома с образованием катиона:
X
– e
→ X+
Энергия ионизации
измеряется в кДж/моль или в электронвольтах
1 эВ = 1,602.10-19
Дж или 96,485 кДж/моль. (эВ). Отрыв второго
электрона происходит труднее, чем
первого, т.к. второй электрон отрывается
не от нейтрального атома, а от положительного
иона:
X+
– e
→ X2+
Поэтому второй
потенциал ионизации I2
больше, чем первый (I2>I1).
Очевидно, что удаление каждого следующего
электрона будет требовать больших
энергетических затрат, чем удаление
предыдущего. Для характеристики свойств
элементов обычно принимают во внимание
энергию отрыва первого электрона.
В группах потенциал ионизации уменьшается
с увеличением атомного номера элемента:
Li | Na | K | Rb | Cs | |
I, | 6,39 | 5,14 | 4,34 | 4,18 | 3,89 |
Это связано с
большей удаленностью валентных электронов
от ядра и, следовательно, с их более
легким отрывом по мере увеличения
количества электронных слоев. Величина
потенциала ионизации может служить
мерой “металличности” элемента: чем
меньше потенциал ионизации, тем легче
удалить электрон из атома, тем сильнее
выражены металлические свойства.
В периодах слева направо заряд ядра
возрастает, а радиус атома уменьшается.
Поэтому потенциал ионизации постепенно
увеличивается, а металлические свойства
ослабевают:
Li | Be | B | C | N | O | F | Ne | |
I, | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,61 | 17,42 | 21,56 |
Нарушение тенденции
возрастания I
наблюдается для атомов с целиком
заполненным внешним энергетическим
подуровнем, либо для атомов, у которых
внешний энергетический подуровеньзаполнен ровно наполовину:
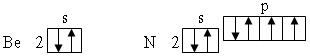
Это свидетельствует
о повышенной энергетической устойчивости
электронных конфигураций с полностью
или наполовину занятыми подуровнями.
Степень притяжения
электрона к ядру и, следовательно,
потенциал ионизации зависят от ряда
факторов, и прежде всего от заряда ядра.
Заряд ядра равен порядковому номеру
элемента в таблице Менделеева., от
расстояния между электроном и ядром,
от экранирующего влияния других
электронов. Так, у всех атомов, кроме
элементов первого периода, влияние ядра
на электроны внешнего слоя экранировано
электронами внутренних слоев.
Поле ядра атома,
удерживающее электроны, притягивает
также и свободный электрон, если он
окажется вблизи атома. Правда, этот
электрон испытывает отталкивание со
стороны электронов атома. Для многих
атомов энергия притяжения дополнительного
электрона к ядру превышает энергию его
отталкивания от электронных оболочек.
Эти атомы могут присоединять электрон,
образуя устойчивый однозарядный анион.
Энергию отрыва
электрона от отрицательного однозарядного
иона в процессе
X–
– e → X0
называют сродством
атома к электрону (A),
измеряемым в кДж/моль или 1 эВ (электронвольт)
= 1,602.10-19
Дж или 96,485 кДж/моль..
При присоединении двух и более электронов
к атому отталкивание преобладает над
притяжением – сродство атома к двум и
более электронам всегда отрицательно.
Поэтому одноатомные многозарядные
отрицательные ионы (O2–,
S2–,
N3–
и т.п.) в свободном состоянии существовать
не могут.
Сродство к электрону
известно не для всех атомов. Максимальным
сродством к электрону обладают атомы
галогенов.
Электроотрицательность.
Эта величина
характеризует способность атома в
молекуле притягивать к себе связующие
электроны. Электроотрицательность не
следует путать со сродством к электрону:
первое понятие относится к атому в
составе молекулы, а второе – к
изолированному атому.
Абсолютная электроотрицательность
(кДж/моль или 1 эВ электронвольт =
1,602.10-19
Дж или 96,485 кДж/моль. ) равна сумме энергии
ионизации и сродства к электрону:
АЭО=I+A.
На практике часто
применяется величина относительной
электроотрицательности, равная отношению
АЭО данного элемента к АЭО лития (535
кДж/моль):
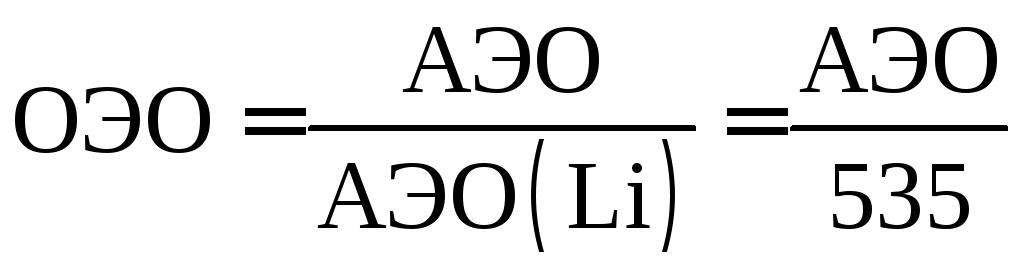
Электроотрицательность
уменьшается сверху вниз по группе и
увеличивается слева направо по периоду.
Ниже приведены относительные
электроотрицательности некоторых
элементов:
Li | Be | B | C | N | O | F | |
ОЭО | 1,0 | 1,5 | 2,0 | 2,5 | 3,1 | 3,5 | 4,0 |
Na | K | Rb | Cs | |
ОЭО | 0,9 | 0,8 | 0,8 | 0,7 |
Наибольшее значение
электроотрицательности имеет фтор,
наименьшее – цезий. Водород занимает
промежуточное положение, т.е. при
взаимодействии с одними элементами
(например, с F) он отдает электрон, а при
взаимодействии с другими (например, с
Rb) – приобретает электрон.
Окислительно-восстановительные
свойства нейтральных атомов.
Эти свойства определяются значениями
энергии ионизации и сродства к электрону.
Восстановительные свойства проявляет
атом, отдающий электрон, а окислительные
– атом, принимающий электрон. В периоде
слева направо восстановительные свойства
ослабевают, т.к. потенциал ионизации
возрастает. В подгруппах сверху вниз
восстановительные свойства нейтральных
атомов усиливаются, поскольку потенциал
ионизации в этом направлении уменьшается.
Окислительные свойства, напротив,
усиливаются слева направо в периоде и
ослабевают сверху вниз в подгруппе, что
связано с тенденциями в изменении
сродства к электрону.
Кислотно-основные
свойства соединений.
Свойства оксидов и гидроксидов элементов
зависят главным образом от заряда и
радиуса центрального атома. С ростом
положительного заряда (точнее, степени
окисления) центрального атома кислотный
характер этих соединений становится
более выраженным:
Na+ | Mg2+ | Al3+ | Si4+ | P5+ | S6+ | Cl7+ |
Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
основные | амфотерный | слабо | средне | сильно кислотные | ||
Сверху вниз в
подгруппе при одинаковости заряда
(степени окисления) центрального атома
с увеличением его радиуса кислотные
свойства оксидов и гидроксидов ослабевают,
а основные – усиливаются:
B3+ | H3BO3 | слабая кислота |
Al3+ Ga3+ In3+ | Al(OH)3 Ga(OH)3 In(OH)3 | амфотер- ные гидрок- сиды |
Tl3+ | Tl(OH)3 | более выражены |
Аналогичный пример
можно привести для кислородсодержащих
кислот элементов VI группы: сила кислот
убывает в ряду H2SO4
серная кислота, H2SeO4
селеновая кислота, H2TeO4
теллуровая кислота.
