Какие свойства ионной связи отличают ее от
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 октября 2016;
проверки требуют 26 правок.
Атомы натрия и фтора подвергающиеся окислительно-восстановительной реакции с образованием фторида натрия. Натрий теряет свой внешний электрон, приобретая стабильную электронную конфигурацию, и этот электрон переходит в атом фтора. Противоположно заряженные ионы притягиваются друг к другу с образованием стабильного соединения.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1,7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью.
Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы, окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион — катион (в переводе с греческого — «идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы — анионы (от греческого «анион» — идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь — это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Пример образования ионной связи[править | править код]
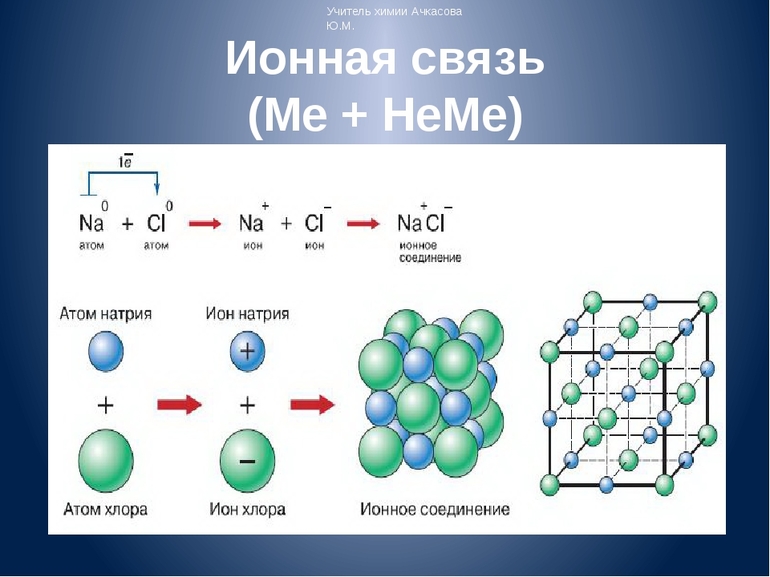
Рассмотрим способ образования на примере «хлорида натрия» NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: и . Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Схематично это можно записать так:
— ион натрия, устойчивая восьмиэлектронная оболочка () за счет второго энергетического уровня. — ион хлора, устойчивая восьмиэлектронная оболочка.
Между ионами и возникают силы электростатического притяжения, в результате чего образуется соединение.
Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
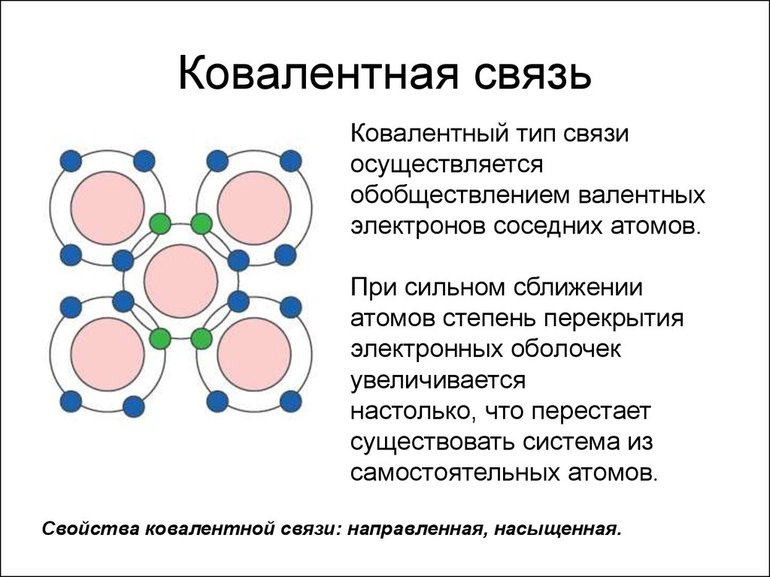
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
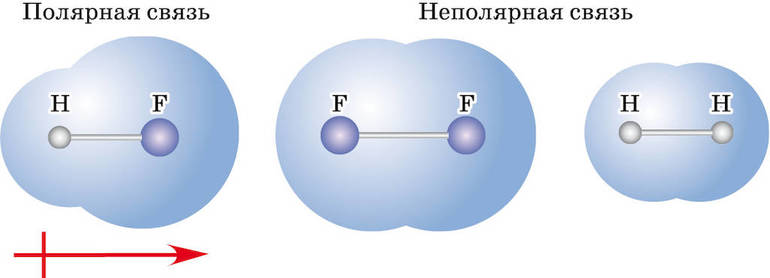
- равны или примерно равны (разница между значениями по шкале Полинга — до 0,4) — это ковалентная неполярная связь (общая электронная пара не смещается ни к одному из атомов);
- отличаются, но не сильно (разница от 0,4 до 1,7) — это ковалентная полярная связь (электронная пара смещается к одному из участвующих атомов);
- отличаются сильно (разница более 1,7) — это ионная связь (один или несколько электронов не просто смещаются, а почти полностью переходят к другому атому, причем всегда к тому, у которого значение электроотрицательности больше, при этом оба атома-участника превращаются в ионы).
Электростатическое притяжение частиц в ионной связи очень сильное. Эта особенность обусловливает высокие температуры плавления и кипения для веществ с такой связью. Однако стопроцентного ионного соединения не существует. Электронная пара не переходит к более электроотрицательному атому полностью. В качестве яркого примера наиболее сильного смещения электронов стоит привести фторид цезия CsF. Так называемая «степень ионности» в этом соединении достигает 97%.
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.

Отрицательно заряженные ионы — это анионы. Примеры: Cl- (хлорид-ион), N 3 — (нитрид-ион) и так далее. Образование анионов происходит в результате получения (приобретения) атомом электрона (или электронов). У них ядерный заряд уступает количеству электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
- однозарядную (K+, Cl- и так далее);
- двухзарядную (Ca2 +, O2 — и прочие);
- трехзарядную (Al3 + и другие).
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.

Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.

Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na0 )2e)8e)1e + Cl0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na0 + Cl0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
- солей;
- щелочей;
- оксидов некоторых металлов.
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
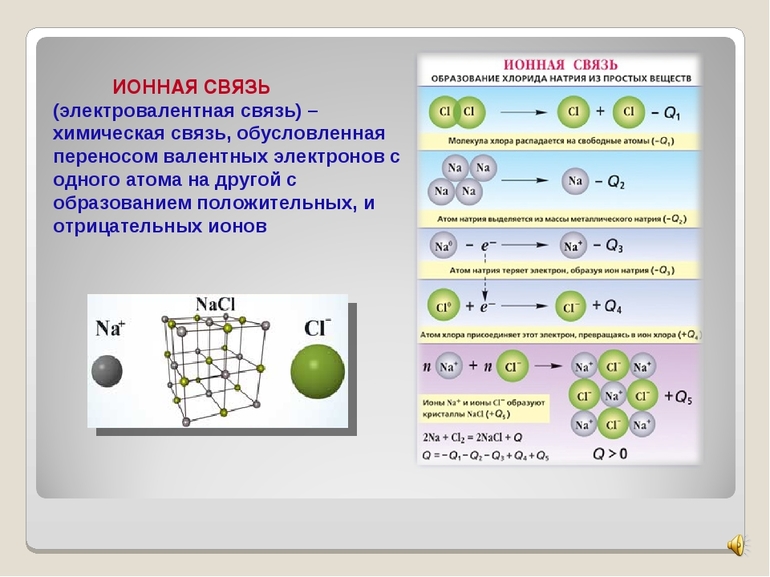
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи

Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:
- прочность;
- длина;
- поляризуемость;
- полярность;
- ненасыщаемость;
- ненаправленность.
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.
Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2). Определим число атомов фтора, которые примут два электрона от атома кальция: (2) (:) (1) (=) (2).
4. Составим схему образования ионной связи:
Ca0+2F0→Ca2+F2−.
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2) (:) (1) (=) (2). Определим число атомов натрия, которые отдадут два электрона атому кислорода: (2).
4. Составим схему образования ионной связи:
2Na0+O0→Na2+O2−.
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
NH4+,NO3−,OH−,SO42−,PO43−,CO32−.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония NH4NO3,NH4Cl,NH4SO42 не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
Питьевая сода
Железный купорос
Поваренная соль
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 63 с.
Энергетические схемы образования молекулы гелия и иона гелия
Задание 71.
Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость нона Не2+ и невозможность существования молекулы Не2.
Решение:
Заполнение МО происходит при соблюдении принципа Паулии правила Хунда: сначала заполняется та орбиталь, которой соответствует наиболее низкая энергия, затем — орбитали с большими значениями полной энергии.
Схема образования молекулы Не2 имеет вид:
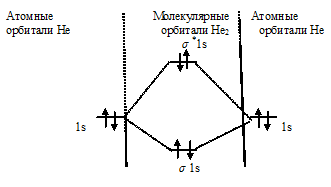
Определим порядок связи: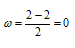
Так как порядок связи равен нулю, то молекула Не2 должна быть энергетически неустойчивой, поскольку здесь из четырёх электронов, которые должны разместиться на МО, два займут связывающую ( 1s), а два – разрыхляющую ( *1s) МО. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Действительно молекулы Не экспериментально не получены.
Схема образования иона Не2+ имеет вид:
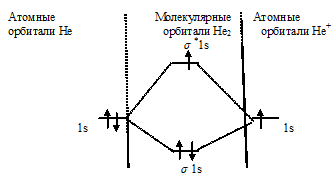
Определим порядок связи: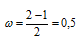
В молекулярном ионе Не2+ порядок связи равен 0,5, следовательно, образование данного иона будет сопровождаться выделением энергии. При его образовании два электрона занимают связывающую МО, а третий электрон – занимает разрыхляющую МО, что и приводит данную частицу к устойчивому существованию. Действительно существование иона Не2+ экспериментально подтверждено и установлено, что при его образовании выделяется энергия.
Водородная связь
Задание 72.
Какую химическую связь называют водородной? Между молекулами, каких веществ она образуется? Почему Н2О и НЕ, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?Решение:
Водородной связью называют связь, которая возникает между молекулами, в которых атомы водорода связаны с атомами фтора, кислорода, азота. Она характерна для молекул HF, H2O, NH3, молекул карбоновых кислот, спиртов, аминокислот, амидов, сахаров, аминов фенолов. Например, при образовании молекулы HF возникает связь H — F, осуществляемая общей электронной парой, которая смещена к атому более электроотрицательного элемента – фтора: 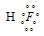 В результате такого распределения электронной плотности молекула фтороводорода представляет из себя диполь, положительный полюс которого – это атом водорода:
В результате такого распределения электронной плотности молекула фтороводорода представляет из себя диполь, положительный полюс которого – это атом водорода: 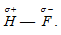 . Из-за смещения общей электронной пары к атому фтора, ядро атома водорода частично обнажается и частично освобождается 1s-орбиталь атома водорода. В связи с тем, что у атома водорода нет экранирующей электронной оболочки, а ядро атома представляет собой протон, напряжённость электрического поля вблизи оголенного протона настолько велика, что он может интенсивно притягивать к себе отрицательный полюс соседней молекулы HF. Поскольку этот отрицательный полюс соседней молекулы не что иное, как атом фтора, имеющий три несвязывающие электронные пары, а 1s-орбиталь атома водорода частично вакантна, то между атомом водорода одной молекулы и атомом фтора другой, соседней, возникает донорно-акцепторное взаимодействие. В результате этого взаимодействия возникает связь между двумя молекулами HF, дополнительная связь. Это и есть водородная связь. Её обозначают точками или пунктирной линией: F — H … F. Система из трёх атомов линейна. Эта связь менее прочная и более длинная, чем обычная ковалентная:
. Из-за смещения общей электронной пары к атому фтора, ядро атома водорода частично обнажается и частично освобождается 1s-орбиталь атома водорода. В связи с тем, что у атома водорода нет экранирующей электронной оболочки, а ядро атома представляет собой протон, напряжённость электрического поля вблизи оголенного протона настолько велика, что он может интенсивно притягивать к себе отрицательный полюс соседней молекулы HF. Поскольку этот отрицательный полюс соседней молекулы не что иное, как атом фтора, имеющий три несвязывающие электронные пары, а 1s-орбиталь атома водорода частично вакантна, то между атомом водорода одной молекулы и атомом фтора другой, соседней, возникает донорно-акцепторное взаимодействие. В результате этого взаимодействия возникает связь между двумя молекулами HF, дополнительная связь. Это и есть водородная связь. Её обозначают точками или пунктирной линией: F — H … F. Система из трёх атомов линейна. Эта связь менее прочная и более длинная, чем обычная ковалентная:
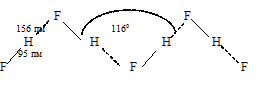
Вещества, молекулы которых соединены водородными связями, образуют системы, отличающиеся от аналогичных веществ, но не образующих водородные связи, некоторыми свойствами (температурами кипения, плавления и молекулярной массой). Обычно их температуры кипения и плавления выше, а молярные массы – больше. Объясняется это тем, что вещества, образующие водородные связи представляют собой высокомолекулярные структуры, например, фтороводород образует ассоциации из бесконечных плоских зигзагообразных цепей.
Ионная связь
Задание 73.
Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
Решение:
Ионная связь образуется противоположно заряжёнными ионами, притягиваемыми друг к другу электростатическими силами. Связь этого типа осуществляется в результате взаимного электростатического притяжения противоположно заряжённых ионов. Положительно заряжённые ионы – катионы образуются из атомов элементов с низким потенциалом ионизации; к таким элементам относятся металлы главных подгрупп 1-й и 2-й группы. Металлы других групп и подгрупп тоже способны образовывать катионы. Анионы образуются из атомов – типичных неметаллов, обладающих большим сродством к электрону, например, Cl-, Br-, S2-.
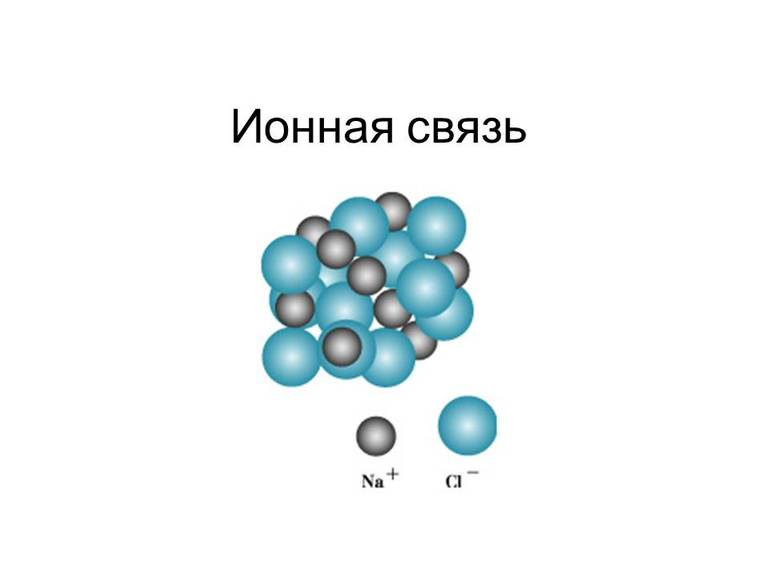
Так, электростатическое взаимодействие в вакууме катиона Na+ и аниона Cl- приводит к образованию существующей в парах двухатомной молекулы NaCl. Взаимодействие этих молекул приводит к их конденсации и образованию ионных кристаллов хлорида натрия NaCl. И в молекуле Na+Cl-, и в кристаллах NaCl почти не происходит обобществления электронов: атом натрия почти полностью отдаёт электрон атому хлора. Оба атома при этом приобретают устойчивые конфигурации благородных газов:
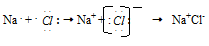
В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Ионная связь не обладает насыщаемостью. Это объясняется тем, что система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создаёт в окружающем пространстве электрическое поле. Это означает, что два разноимённых иона, притянувшиеся друг к другу, сохраняют электростатически взаимодействовать с другими ионами.
Типичными ионными соединениями являются KCl и NaBr. Схемы превращения ионов в нейтральные атомы:
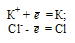
Степень окисления атома
Задание 74.
Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях: СН4, СН3ОН, НСООН, СО2.
Решение:
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются чисто ионными, а само соединение состоит из ионов. Валентность атома элементов определяется числом его химических связей в соединении.
СН4 – степень окисления углерода равна -4;
СН3ОН — степень окисления углерода равна -2;
НСООН — степень окисления углерода равна +2;
СО2 — степень окисления углерода равна +4.
Валентность углерода во всех этих соединениях равна четырём.
Конденсированное состояние вещества
Задание 75.
Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы, и какова их природа?
Решение:
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Если вещество состоит из полярных молекул, например, молекул Н2О или НСI, то в конденсированном состоянии соседние молекулярные диполи ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствие чего наблюдается их взаимное притяжение. Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует взаимной ориентации молекул, поэтому с ростом температуры ориентационный эффект ослабевает.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например, СО2, наблюдается возникновение наведенных или индуцированных диполей. Причина их появления обычно состоит в том, что каждый атом создает вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы. В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
Наконец, движение электронов в атомах, а также колебание ядер, и связанное с этим не-прерывное изменение взаимного положения электронов и ядер вызывает появление мгновенных диполей. Мгновенные диполи возникают в твердых телах и жидкостях согласованно, причем ближайшие друг к другу участки соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению. Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии. В частности, оно обусловливает переход благородных газов при низких температурах в жидкое состояние.
Чем больше полярность молекул, тем больше ориентационные силы. Чем больше деформируемость, чем слабее связаны внешние электроны атомов, т.е. чем эти атомы крупнее, тем значительнее дисперсионные силы. Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ. Например, в случае НСI на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, для НВг эта величина составляет 95%, а для НI 99,5%. Индукционные силы почти всегда малы.
