Какие свойства химических элементов и почему изменяются монотонно
При рассмотрении свойств элементов отметим, что причиной их периодического изменения является периодичность структур электронных слоев и оболочек атомов. Важнейшими периодически изменяющимися свойствами свободных атомов являются радиусы атомов, энергия ионизации и сродство к электрону.
РАДИУСЫ АТОМОВ И ИОНОВ. Изолированный атом не имеет строго определенного размера из-за волновых свойств электрона. Следовательно, понятие размера атома, его радиуса весьма условно. Тем не менее, часто необходимо знать хотя бы приближенные значения радиусов атомов. Для их оценки используют так называемые ЭФФЕКТИВНЫЕ РАДИУСЫ. Это радиусы, которые имеют атомы, входя в состав реальных простых веществ. Их обозначают .
Эффективные атомные радиусы элементов в периодах уменьшаются от щелочного металла к галогену. Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая преобладает над силами взаимного отталкивания электронов. Происходит сжатие электронной оболочки. Наиболее заметное уменьшение эффективного радиуса наблюдается для s- и р – элементов. В рядах d и f – элементов радиусы изменяются более плавно вследствие заполнения электронами второй и третьей снаружи оболочки.
В главных подгруппах с увеличение главного квантового числа происходит заметное увеличение радиуса атома. Для элементов побочных подгрупп изменение радиусов незначительное, а при переходе от пятого к шестому периоду эффективные радиусы атомов практически не изменяются. Это является следствием сжатия электронной оболочки в семействе лантоноидов, которое и компенсирует увеличение объема атома.
При отрыве электрона с внешнего уровня атома происходит уменьшение эффективного радиуса, а в случае образования отрицательного иона – увеличение. Ионные радиусы, как и атомные, являются периодической функцией заряда ядра.
ЭНЕРГИЯ ИОНИЗАЦИИ. Мы уже знаем, что отдельный атом в основном состоянии представляет собой наиболее устойчивую систему из данных частиц. Поэтому для любого изменения структуры этой системы требуется затрата энергии. Величина энергии, которая затрачивается для отрыва одного электрона от нейтрального атома в основном состоянии, называется энергией ионизации данного атома (), или ионизационным потенциалом. Эту энергию обычно относят к одному молю атомов и выражают в килоджоулях на моль или электроновольтах (эВ).
Энергия ионизации – важная характеристика атома. Она позволяет судить о том, насколько прочно связаны электроны в атоме.
В группе при увеличении порядкового номера элемента наблюдается уменьшение энергии ионизации. Оно связано с увеличением радиуса атома.
В периодах энергия ионизации атомов слева направо возрастает. Это вызвано сжатием электронной оболочки вследствие увеличения эффективного заряда ядра. Наименьшей является прочность связи
— электрона с ядром (при . Поэтому атомы щелочных металлов имеют самые низкие значения энергии ионизации. Причем, с увеличениям n их энергия ионизации понижается вследствие экранирующего действия внутренних электронов. Эта закономерность имеется и у р- элементов (за исключением ). Атомы благородных газов имеют максимальную энергию ионизации при данном .
Отрыв второго, третьего и т.д. электронов требует гораздо большей затраты энергии. Это связано с ростом заряда образующегося положительного иона. Энергия ионизации, например, для и соответственно равна 5,14эВ и 47,3эВ.
Сравнение электронных структур атомов и значений энергии ионизации позволяет заключить, что ее максимальными значениями обладают атомы с завершенными внешним слоями и , т.е. атомы благородных элементов.
СРОДСТВО К ЭЛЕКТРОНУ. В ряде случаев важно оценить способность атома присоединять электроны. Эта способность характеризуется значением энергии, которая затрачивается или выделяется при присоединении электрона к нейтральному атому в основном состоянии и называется сродством атома к электрону (). Способность атома присоединять электроны тем больше, чем больше величина его сродства к электрону. По сравнению с энергией ионизации значение сродства к электрону невелико, поскольку избыточный электрон приводит к усилению межэлектронного отталкивания и повышению энергии атомной орбитали.
Минимальное сродство к электрону наблюдается у атомов, имеющих завершенные — и — оболочки, мало оно и у атомов с конфигурацией (азот, фосфор, мышьяк).
Наибольшим сродством к электрону обладают атомы элементов подгрупп VII А, имеющие конфигурацию . Как правило, у элементов третьего периода сродство к электрону больше, чем у элементов второго периода.
Таким образом, в большинстве случаев сродство к электрону в ряду атомов изменяется в той же последовательности, что и их энергия ионизации: растет с ростом числа электронов на внешнем уровне атомов данного периода и уменьшается с ростом радиусов атомов в пределах данной группы или подгруппы.
Практическое использование всех рассмотренных характеристик ограничено тем, что они относятся к изолированным атомам. В случае неизолированных атомов часто используют эмпирическую величину, называемую ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ (ЭО). Ее ввел Л.Полинг как свойство связанного атома притягивать электроны, точнее – электронную плотность. Электронная плотность смещается к тому из атомов, который имеет большую электроотрицательность. Электроотрицательность измеряется в тех же единицах, что и энергия ионизации. Она зависит от многих факторов: электронной структуры, наличия вакантных орбиталей, числа и вида соседних атомов и т.д. Поэтому для данного атома электроотрицательность не может быть постоянной. На практике используют усредненную величину.
В каждом периоде электроотрицательность растет по мере накопления электронов в атомах, т.е. слева направо. В каждой группе она убывает по мере возрастания радиусов атомов. Наибольшей электроотрицательностью обладают самые маленькие атомы с семью внешними электронами (атомы галогенов малых периодов). Наименьшая электроотрицательность у самых больших атомов с одним внешним электроном (атомы щелочных металлов больших периодов).
Однако в этих закономерностях много исключений. Таким образом, применяя эту величину, не следует ее не переоценивать.
НЕПЕРИОДИЧЕСКИЕ СВОЙСТВА. Это свойства элементов, которые с порядковым номером изменяются монотонно. К их числу относятся, например, удельная теплоемкость простых веществ, частоты линий рентгеновского спектра и др.
В заключение подчеркнем, что в периодической зависимости от заряда ядра находятся не только свойства отдельных атомов. Периодически зависят от заряда ядра атома многие свойства аналогичных по составу и структуре веществ: температуры кипения и плавления, энергии диссоциации, магнитные свойства и др.
Периодичность в изменении свойств элементов. Периодический закон Д.И. Менделеева
Периодическую систему химических элементов создал в 1869 году наш великий соотечественник Дмитрий Иванович Менделеев.
В отличие от своих предшественников, Менделеев сравнивал не только сходные, но главным образом несходные между собой элементы и их группы (например, щелочные металлы и галогены), располагая их на основе главной (известной к тому времени) характеристики элемента – атомного веса.
Формулировка закона в то время была такова:
Свойства химических элементов, а также свойства и формы их соединений находятся в периодической зависимости от их атомных весов.
Позже Менделеев использовал введенную им более фундаментальную, чем атомный вес, характеристику элементов, а именно их порядковый номер, который определяется положительным зарядом ядра, т.е. числом протонов в ядре атома. Были установлены закономерности изменения свойств элементов в периодах и группах.
Для описания и систематизации химических элементов необходимо знать их характеристики: порядковый номер (заряд ядра его атомов) и относительную атомную массу.
Из них заряд ядра атомов является общей, неизменной при химических реакциях главной характеристикой для определения элемента.
Для описания элементов, кроме перечисленных выше количественных характеристик, нужны и другие, в том числе качественные характеристики элемента. Таковыми являются электронное строение и свойства его атомов.
Особое значение имеют электроны, расположенные на внешнем электронном слое, валентные электроны. У элементов-металлов их обычно 1 – 2, реже 3, у неметаллов – 4 и больше. У элементов больших периодов побочных подгрупп валентными являются электроны не только внешнего, но и предвнешнего слоя. От валентных электронов зависит реакционная способность атомов к образованию химических связей с другими атомами, к образованию химических соединений.
Химическое соединение – это химически индивидуальное вещество, состоящее из химически связанных атомов одного в простом или нескольких в сложном веществе элементов, имеющее определённый состав.
Простые и сложные вещества – это формы реального существования элементов в природе. Характер элементов влияет на свойства образованных ими веществ, и наоборот, зная свойства веществ, можно судить о характере элемента.
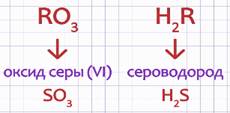
Дмитрий Иванович Менделеев придавал большое значение знанию форм и свойств типичных кислородных и водородных соединений элемента для его характеристики. Под формой соединений он понимал сходство в составе типичных для группы элементов их соединений, выраженное общими формулами. Так, элементы главной подгруппы VI группы периодической системы имеют следующие формы кислородных и водородных соединений: RO3, H2R.
Например: оксид серы и сероводород.
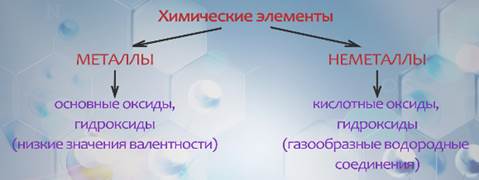
Типичные металлические элементы образуют основные оксиды и гидроксиды, проявляя в этих формах соединений низкие значения валентности. У неметаллических элементов высшие кислородные соединения (оксиды и гидроксиды) имеют кислотный характер. Эти элементы образуют газообразные водородные соединения. Многие элементы проявляют промежуточные свойства.
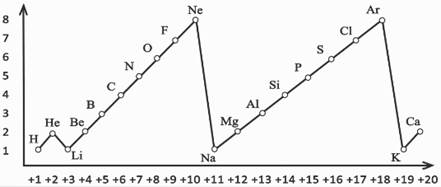
Выведем закономерности изменения свойств элементов с увеличением их порядкового номера.
1.Важнейшие количественные характеристики элемента – заряд ядра его атомов и атомная масса – возрастают монотонно.
2.Структуры внешнего электронного слоя изменяются скачкообразно.
3.Периодически повторяются формы и свойства оксидов и гидроксидов элементов.
4.Периодически повышается валентность элементов по кислороду и уменьшается по водороду.
Какова зависимость между характеристиками элемента, меняющимися монотонно и периодически?
Рассмотрим эту связь на примере заряда ядра атомов и их внешних электронов. Для этого построим график. Отметим на горизонтальной линии заряд ядра атома, а на вертикальной – число электронов на внешнем слое атомов элементов.

Число электронов внешнего электронного слоя атомов элементов периодически изменяется при монотонном возрастании величины заряда ядра их атомов.
Открытие периодического закона ознаменовало начало новой эпохи в развитии химии – ее современного этапа. До этого накопленные в науке факты не имели внутренней связи.
Периодический закон раскрыл глубокую связь между элементами, позволил ученым предсказывать свойства еще не открытых элементов и их соединений и целенаправленно осуществлять поиск новых.
Дмитрий Иванович Менделеев не сомневался в достоверности открытого закона, твердо верил в его будущее, в его развитие. Незадолго до смерти он написал: «…периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает».
Периодический закон:
– утвердил глубокую внутреннюю связь между элементами;
– позволил ученым предположить, что все атомы построены по общему плану;
– тем самым создал предпосылку для перехода к новому этапу развития науки, к познанию внутренней структуры атомов – открытие электрона, радиоактивности, разработка теории строения атома и т.д.
Следующим этапом стало раскрытие физической сущности закона на основе теории строения атома.
Вы уже знакомы со строением атомов и знаете, что заряд ядра атома – его главная характеристика. Заряд ядра совпадает с порядковым номером элемента в периодической системе Менделеева.
Ученик Резерфорда английский учёный-физик Генри Мозли установил в 1913 году, что длина волны рентгеновского излучения у каждого элемента своя. Она увеличивается с возрастанием атомной массы. Мозли связал частоту этого излучения с порядковым номером элемента. Закон Мозли подтвердил, что изменение Менделеевым порядковых номеров элементов в периодической системе соответствовало последовательному увеличению зарядов ядер их атомов. Этот вопрос мы уже обсуждали при изучении изотопов.
В связи с новыми открытиями в области строения атома периодический закон принял следующую современную формулировку:
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома.
Почему свойства элементов и их соединений изменяются периодически?
В чем причина периодичности?
Ответ на данный вопрос также позволяет дать теория строения атома:
Величина заряда ядра – главная характеристика элемента, мера его индивидуальности. От этой характеристики элемента зависят все остальные его свойства, она определяет число электронов и их состояние в атоме.
Возрастание зарядов ядер атомов от первого до последнего элемента приводит к периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне. В этом физический смысл периодического закона и причина периодичности изменения свойств элементов.
Периодическое изменение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и электронных структур атомов.
Теория строения атома способствовала развитию периодического закона и периодической системы химических элементов, определению их современного содержания. Она дала импульс к изучению внутреннего строения веществ, к открытию и получению новых элементов.
Анонимный вопрос · 5 марта 2019
< 100
способность металлов увеличивать свои размеры при нагревании, называется:?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Способность металлов к изменению объема при температурных воздействиях связана с полиморфизмом. Полиморфизм это явление, когда металл в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры металлов.
Как можно изменить свойства объекта без механических воздействий?
Всё зависит от состава этого объекта. Мы, физики, никогда не вступаем в контакт с неизвестным объектом — все данные собираем удалённо. После сбора данных — уже можно делать выводы о составе, а уже зная состав, можно знать какие виды взаимодействия, кроме физического контакта, возможны. Тут уже на выбор все виды взаимодействий — излучения, магнитные поля, изменение давления, тепло-холод, частотное воздействие, и т.п.
Прочитать ещё 1 ответ
Для каких элементов характерны летучие водородные соединения?
Автор проекта ChemistryToday, человек, заинтересованный химией и продвигающий… · vk.com/chemtoday
Летучие водородные соединения (ЛВС) образуют, в основном, неметаллы: практически у каждого из них есть такие соединения — гидриды элемента или элемент’иды водорода.
Посмотрим на 2 период Таблицы Менделеева: ЛВС характерны для бора (различные бораны BnHm), углерода (вся органика! CxHy), азота (аммиак, например NH3), кислорода (вода!) и фтора (плавиковая кислота HF). Это как раз все неметаллы 2 периода (за исключением неона, благородного газа).
В 3 периоде всё то же самое: алюминий образует AlH3, алан, кремний — силан SiH4, фосфор — фосфин PH3, сера — сероводород H2S, хлор — хлороводород HCl.
Но так как при движении вниз по группе «металличность» элементов повышается, то для галлия (который под алюминием) уже гораздо менее характерно образование водородных соединений, тем более летучих, поэтому галлий уже выбывает из ЛВС неметаллов 4 периода. Следующий за ним — германий — образует герман GeH4, мышьяк — арсин AsH3, селен — селеноводород H2Se, бром — бромоводород HBr.
Все остальные также существуют: PbH4, SnH4, H2Te, SbH3, BiH3 (очень нестабилен), HI, HAt, H2Po.
Как происходит изменение агрегатных состояний вещества?
При переходе агрегатного состояния изменяется внутренняя энергия вещества так, что молекулы или атомы больше не могут находиться в прежней структуре и изменяют ее. Например, при нагревании воды увеличивается внутренняя энергия атомов, которая заставляет их двигаться активнее и быстрее отталкиваться друг о друга. Именно поэтому происходит разуплотнение до состояния пара.
На элементе какой группы оканчивается правильный период натуральной последовательности элементов?
Все мы знакомы с Периодической Системой Элементов. Автором которой считаем великого российского учёного Дмитрия Ивановича Менделеева, который в 1869 году разработал первый вариант периодической таблицы элементов, в которой не было единообразного окончания периодов на элементе определённой химической группы. С 1870-1871 годов по 1906 годы Менделеев стал неизменно оканчивать периоды на элементе группы галогенов.
Швейцарский химик Альфред Вернер в 1905 году окончил периоды на элементе группы благородных газов, тогда как Менделеев начинал периоды благородным газом. Но Последователи Менделеева приписывают именно Менделееву предложение оканчивать периоды на элементе группы благородных газов.
Мало кто из учёных и почти никто из школьников и простых обывателей знают, что немецкий врач и великий физик и химик Юлиус Лотар Мейер в 1862 году построил фрагмент периодической таблицы элементов с окончанием периодов на элементе группы щёлочноземельных металлов.
Кто же из этих авторов правильно окончил периоды Натуральной Последовательности элементов?
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
248,9 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху вниз): увеличивается… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Почему высшая валентность изменяется периодически?
TutorOnline — одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов… · tutoronline.ru
С увеличением порядкового номера элемента в периоде увеличивается количество электронов на внешнем энергетическом поле, которые могут создавать химические связи. Больше электронов — выше валентность! В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома. Легче всего отрываются электроны от атомов щелочного металла франция. В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень. Наиболее активно принимают электроны атомы галогена фтора.
Как построена периодическая система химических элементов?
Интересы часто менялись, поэтому во многих областях знаний что-то знаю:)
В периодической системе отражаются сходства свойств различных элементов.
Выделяют:
- группы (столбцы таблицы), в рамках которых элементы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках.
- периоды (строки таблицы), в рамках которых элементы демонстрируют определённые закономерности в атомном радиусе, энергии ионизации и электроотрицательности, а также в энергии сродства к электрону.
- блоки, элементы в которых объединены тем, на какой оболочке находится последний электрон. Блоковая структура выглядит так:
Подробнее почитать обо всех закономерностях периодической системы можно здесь
Как изменяются свойства в следующих цепочках mn ti ca?
Всем, привет! Тема семьи и отношений очень близка мне, но, став мамой, нужно…
Они у вас расположены не совсем в правильноп порядке, сначла идёт Кальций, затем Титан , а уже дальше Марганец. Если брать измения в группе , то слева направо начинает уменьшаться радиус атома, увеличивается окислительная активность, ослабляются металлические свойства.
