Какие свойства белков определяют их растворимость
§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Таблица 4
Молекулярные характеристики некоторых белков
Белок | Относитель-ная молекулярная масса | Число цепей | Число аминокислотных остатков |
Инсулин | 5733 | 2 | 51 |
Рибонуклеаза | 13683 | 1 | 124 |
Миоглобин | 16890 | 1 | 153 |
Химотрипсин | 22600 | 3 | 241 |
Гемоглобин | 64500 | 4 | 574 |
Глутамат-дегидрогеназа | ~1000000 | ~40 | ~8300 |
В молекулах белков может содержаться самое разное количество аминокислотных остатков — от 50 и до нескольких тысяч; относительные молекулярные массы белков также сильно колеблются — от нескольких тысяч (инсулин, рибонуклеаза) до миллиона (глутаматдегидрогеназа) и более. Число полипептидных цепей в составе белков может составлять от единицы до нескольких десятков и даже тысяч. Так, в состав белка вируса табачной мозаики входит 2120 протомеров.
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
.
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
.
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
Белок | pI |
Пепсин | 1,0 |
Каталаза | 5,1 |
Рибонуклеаза | 7,8 |
Лизоцим | 11,0 |
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
В изоэлектрической точке растворимость белка минимальна, так как его молекулы в таком состоянии электронейтральны и между ними нет сил взаимного отталкивания, поэтому они могут «слипаться» за счет водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. При значениях рН, отличающихся от рI, молекулы белка будут нести одинаковый заряд — либо положительный, либо отрицательный. В результате этого между молекулами будут существовать силы электростатического отталкивания, препятствующие их «слипанию», растворимость будет выше.
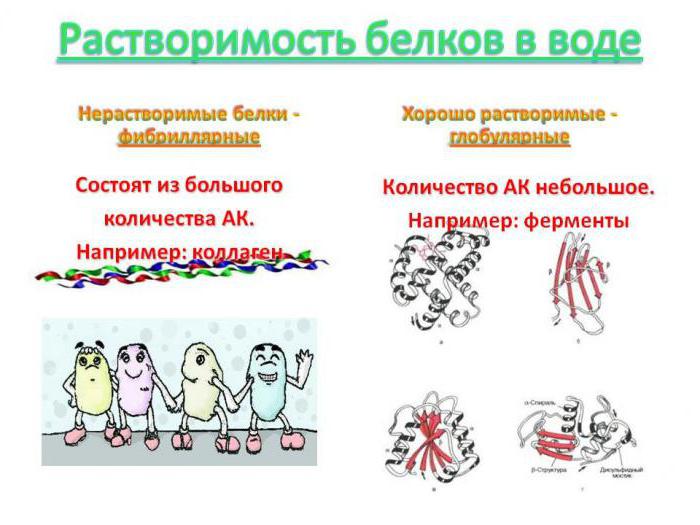
Растворимость белков
Белки бывают растворимые и нерастворимые в воде. Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и других факторов и определяется природой тех групп, которые находятся на поверхности белковой молекулы. К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (щелк, паутина). Многие другие белки растворимы в воде. Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО-, -NH3+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка (рис. 15), существование которой обусловливает их растворимость в воде.
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (NH4)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка.
При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши.
На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
Денатурация белка
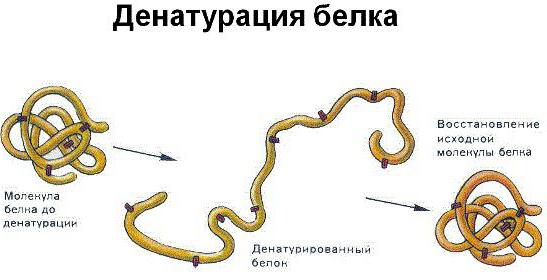
Рассмотрим хорошо нам знакомое явление. При нагревании яичного белка происходит постепенное его помутнение, и затем образуется твердый сгусток. Свернувшийся яичный белок – яичный альбумин – после охлаждения оказывается нерастворимым, в то время как до нагревания яичный белок хорошо растворялся в воде. Такие же явления происходят и при нагревании практически всех глобулярных белков. Те изменения, которые произошли при нагревании, называются денатурацией. Белки в естественном состоянии носят название нативных белков, а после денатурации — денатурированных.
При денатурации происходит нарушение нативной кон-формации белков в результате разрыва слабых связей (ион-ных, водородных, гидрофобных взаимодействий). В результате этого процесса могут разрушаться четвертичная, третичная и вторичные структуры белка. Первичная структура при этом сохраняется (рис. 17).
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство. Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
Наша статья будет посвящена изучению свойств веществ, являющихся основой феномена жизни на Земле. Белковые молекулы присутствуют в неклеточных формах – вирусах, входят в состав цитоплазмы и органоидов прокариотических и ядерных клеток. Наряду с нуклеиновыми кислотами они образуют вещество наследственности – хроматин и формируют главные компоненты ядра — хромосомы. Сигнальная, строительная, каталитическая, защитная, энергетическая – это перечень биологических функций, которые выполняют белки. Физико-химические свойства белков заключаются в их способности к растворимости, осаждению, высаливанию. Кроме того, они способны денатурировать и являются по своей химической природе амфотерными соединениями. Изучим эти свойства протеинов далее.

Виды белковых мономеров
20 видов α-аминокислот — это структурные единицы белка. Кроме углеводородного радикала, они содержат NH2- аминогруппу и COOH-карбоксильную группу. Функциональные группы определяют кислотные и основные свойства мономеров белка. Поэтому в органической химии соединения этого класса называют амфотерными веществами. Ионы водорода карбоксильной группы внутри молекулы могут отщепляться и связываться с аминогруппами. В результате образуется внутренняя соль. Если в молекуле присутствуют несколько карбоксильных групп, то соединение будет кислым, как, например, глутаминовая или аспарагиновая кислота. Если же преобладают аминогруппы – аминокислоты имеют основный характер (гистидин, лизин, аргинин). При равном количестве функциональных групп раствор пептида имеет нейтральную реакцию. Установлено, что присутствие всех трех видов аминокислот влияет на то, какие признаки будут иметь белки. Физико-химические свойства белков: растворимость, водородный показатель, заряд макромолекулы, определяются по соотношению кислых и основных аминокислот.
Какие факторы влияют на растворимость пептидов
Выясним все необходимые критерии, от которых зависят процессы гидратации или сольватации макромолекул белков. Это: пространственная конфигурация и молекулярная масса, определяемая по количеству аминокислотных остатков. Также учитывается соотношение полярных и неполярных частей – радикалов, находящихся на поверхности белка в третичной структуре и суммарный заряд полипептидной макромолекулы. Все выше названные свойства непосредственно влияют на растворимость белка. Рассмотрим их подробнее.
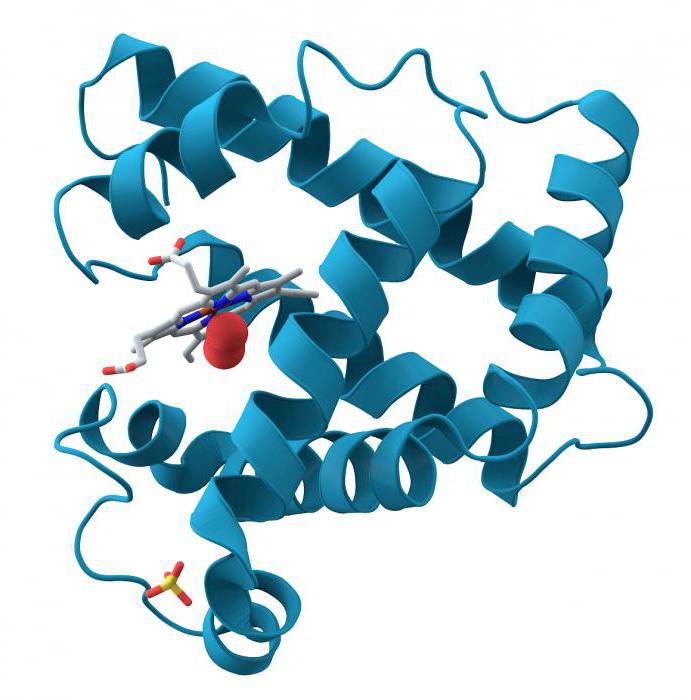
Глобулы и их способность к гидратации
Если внешнее строение пептида имеет шаровидную форму, то принято говорить о его глобулярной структуре. Она стабилизирована водородными и гидрофобными связями, а также силами электростатического притяжения разноименно заряженных частей макромолекулы. Например, гемоглобин, переносящий по крови молекулы кислорода, в четвертичной форме состоит из четырех фрагментов миоглобина, объединенных с помощью гема. Такие белки крови, как альбумины, α – и ϒ -глобулины, легко взаимодействуют с веществами кровяной плазмы. Инсулин – еще один глобулярный пептид, который регулирует уровень глюкозы в крови млекопитающих и человека. Гидрофобные части таких пептидных комплексов находятся в середине компактной структуры, а гидрофильные располагаются на ее поверхности. Это обеспечивает им сохранение нативных свойств в жидкой среде организма и объединяет их в группу водорастворимых белков. Исключение составляют глобулярные протеины, формирующие мозаичное строение мембран клеток человека и животных. Они связаны с гликолипидами и нерастворимы в межклеточной жидкости, что обеспечивает выполнение ими барьерной роли в клетке.
Фибриллярные пептиды
Коллаген и эластин, входящие в состав дермы и обуславливающие ее упругость и эластичность, имеют нитевидную структуру. Они способны растягиваться, изменяя свою пространственную конфигурацию. Фиброин – белок натурального шелка, вырабатывается личинками тутового шелкопряда. Он содержит короткие структурные волокна, состоящие из аминокислот с небольшой массой и длиной молекулы. Это, прежде всего, серин, аланин и глицин. Его полипептидные цепи ориентированы в пространстве в вертикальном и горизонтальном направлении. Вещество относится к структурным полипептидам и имеет слоистую форму. В отличие от глобулярных полипептидов, растворимость белка, состоящего из фибрилл, очень мала, так как гидрофобные радикалы его аминокислот лежат на поверхности макромолекулы и отталкивают полярные частицы растворителя.
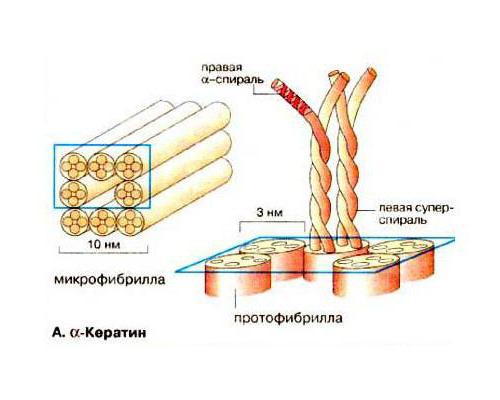
Кератины и особенности их строения
Рассматривая группу структурных белков фибриллярной формы, таких, как фиброин и коллаген, нужно остановиться еще на одной широко распространенной в природе группе пептидов — кератинов. Они служат основой таких частей тела человека и животных, как волосы, ногти, перья, шерсть, копыта и когти. Что такое кератин сточки зрения его биохимического строения? Установлено, что существует два вида пептидов. Первый имеет вид спиральной вторичной структуры (α-кератин) и является основой волос. Другой представлен долее жесткими слоистыми фибриллами – это β-кератин. Его можно обнаружить в твердых частях тела животных: копытах, птичьих клювах, чешуях пресмыкающихся, когтях хищных млекопитающих и птиц. Что такое кератин, исходя из того, что его аминокислоты, например, такие, как валин, фенилаланин, изолейцин, содержат большое количество гидрофобных радикалов? Это нерастворимый в воде и других полярных растворителях белок, выполняющий защитную и структурную функции.
Влияние рН среды на заряд белкового полимера
Ранее мы упоминали о том, что функциональные группы белковых мономеров — аминокислот, определяют их свойства. Добавим теперь, что от них зависит и заряд полимера. Ионогенные радикалы – карбоксильные группы глутаминовой и аспарагиновой кислоты и аминогруппы аргинина и гистидина влияют на общий заряд полимера. Они также ведут себя различно в кислой, нейтральной или щелочной среде раствора. От этих факторов зависит и растворимость белка. Так, при рН<7 раствор содержит избыточную концентрацию протонов водорода, которые угнетают расщепление карбоксила, поэтому общий положительный заряд на молекуле протеина увеличивается.
Накопление катионов в белке возрастает также в случае нейтральной среды раствора и при избытке мономеров аргинина, гистидина и лизина. В щелочной среде происходит увеличение отрицательного заряда полипептидной молекулы, т. к. избыток ионов водорода расходуется на образование молекул воды путем связывания гидроксильных групп.
Факторы, определяющие растворимость белков
Представим ситуацию, при которой количество положительных и отрицательных зарядов на белковой спирали одинаково. Показатель рН среды в этом случае называется изоэлектрической точкой. Общий же заряд самой макромолекулы пептида становится нулевым, а его растворимость в воде или другом полярном растворителе будет минимальной. Положения теории электролитической диссоциации утверждают, что растворимость вещества в полярном растворителе, состоящем из диполей, будет тем выше, чем более поляризованы частицы растворяемого соединения. Они же объясняют и факторы, определяющие растворимость белков: их изоэлектрическую точку и зависимость гидратации или сольватации пептида от суммарного заряда его макромолекулы. Большинство полимеров этого класса содержат избыток групп –COO- и имеют слабокислые свойства. Исключением будут уже упоминавшиеся ранее мембранные белки и пептиды, входящие в состав ядерного вещества наследственности — хроматина. Последние называются гистонами и имеют ярко выраженные основные свойства, обусловленные присутствием в полимерной цепи большого количества аминогрупп.
Поведение протеинов в электрическом поле
В практических целях часто возникает необходимость в разделении, например, белков крови, на фракции или индивидуальные макромолекулы. Для этого можно использовать способность заряженных молекул полимера двигаться с определенной скоростью к электродам в электрическом поле. Раствор, содержащий разные по массе и заряду пептиды, помещают на носитель: бумагу или специальный гель. Пропуская электрические импульсы, например, через порцию плазмы крови, получают до 18 фракций отдельных белков. Среди них: все виды глобулинов, а также белок альбумин, являющийся не только важнейшим составным компонентом (на него приходится до 60 % массы пептидов кровяной плазмы), но и играющим центральную роль в процессах осмоса и циркуляции крови.
Как влияет на растворимость белка концентрация солей
Способность пептидов образовывать не только гели, пены и эмульсии, но и растворы – важное свойство, отражающее их физико-химическую характеристику. Например, ранее изученные альбумины, находящиеся в эндосперме семян зерновых культур, молоке и сыворотке крови, быстро образуют водные растворы с концентрацией нейтральных солей, например, таких, как хлорид натрия, в интервале от 3 до 10 процентов. На примере тех же альбуминов можно выяснить зависимость растворимости белка от концентрации соли. Они хорошо растворяются в ненасыщенном растворе сульфата аммония, а в пересыщенном – обратимо осаждаются и при дальнейшем снижении концентрации соли путем добавления порции воды восстанавливают свою гидратную оболочку.
Высаливание
Выше описанные химические реакции пептидов с растворами солей, образованных сильной кислотой и щелочью, называются высаливанием. В его основе лежит механизм взаимодействия заряженных функциональных групп белка с ионами солей – катионами металлов и анионами кислотных остатков. Он заканчивается потерей заряда на пептидной молекуле, уменьшением ее водной оболочки, слипанием частиц белка. В результате происходит их осаждение, на котором мы остановимся далее.
Осаждение и денатурация
Ацетон и этиловый спирт разрушают водную оболочку, окружающую белок в третичной структуре. Однако это не сопровождается нейтрализацией общего заряда на нем. Такой процесс называется осаждением, растворимость белка резко снижается, но не заканчивается денатурацией.
Молекулы пептидов, находящихся в нативном состоянии, очень чувствительны ко многим параметрам внешней среды, например, к температуре и концентрации химических соединений: солей, кислот или щелочей. Усиление действия обоих этих факторов в изоэлектрической точке приводит к полному разрушению стабилизирующих внутримолекулярных (дисульфидные мостики, пептидные связи), ковалентных и водородных связей в полипептиде. Особенно быстро в таких условиях денатурируют глобулярные пептиды, при этом полностью утрачивая свои физико-химические и биологические свойства.
