Какие сложные эфиры можно получить из продуктов

Сегодня, мы продолжим знакомство с различными классами органических соединений и поговорим о широко распространенных в природе сложных эфирах. Эта статья будет особенно полезна тем, кто подготавливается к сдаче ЕГЭ, изучает углубленно курс органической химии и просто тем, кому интересно вспомнить школьную программу по данной теме. Итак, приступим!
Что же такое сложные эфиры?
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами.
Таким образом, общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
Или:
Формулы отдельных простейших представителей класса сложных эфиров таковы:
Сложные эфиры широко распространены в природе. Специфический аромат ягод, плодов и фруктов в значительной степени обусловлен представителями этого класса органических соединений.
Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — так же, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое. Однако, вопрос применения и классификации сложных эфиров, мы затронем более обширно, чуть позже. А сейчас перейдем к не менее важному вопросу.
Изомерия сложных эфиров.
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например, метилбутирату изомерны метилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки –СО–О–. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат, этилпропионат и метилбутират.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота, а метилформиату уксусная кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис- , транс-изомерия.
Теперь поговорим подробнее о разновидностях сложных эфиров.
Необходимо знать следующее.
Сложные эфиры жирных кислот и спиртов с длинными углеводородными радикалами, называют восками.
Напоминаю, жирные кислоты — это алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из чётного числа атомов углерода (от 4 до 24, включая карбоксильный) и могут быть как насыщенными, так и ненасыщенными.
Важнейшими представителями природных сложных эфиров являются жиры.
Жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отображены общей формулой:
Где R – это радикалы входящие в состав высших карбоновых кислот:
— С3Н7 – масляной.
— С15H31 – пальмитиновой.
— С17Н35 — стеариновой
— С17Н33 – олеиновой.
— С17Н31 – линолевой.
Причем первые три радикала – это остатки предельных карбоновых кислот, а два последних – это остатки непредельных кислот.
В свою очередь, жиры классифицируют на твердые жиры и жидкие жиры (масла).
Физические свойства сложных эфиров.
Многие сложные эфиры, обладают приятными запахами цветов и фруктов. Они хорошо растворимы в спиртах, а вот в воде растворяются очень мало. Дело в том, что плотность сложных эфиров меньше чем у воды и поэтому они по большей части плавают на ее поверхности.
Сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения.
Способы получения сложных эфиров.
1. Реакция этерификации.
Реакция этерификации, является важнейшим из способов получения сложных эфиров.
Этерификация (от греч. eter — эфир и лат. facio — делаю) — это реакция образования сложных эфиров при взаимодействии кислот и спиртов.
В общем виде реакция этерификации может быть записана так:
Обратите внимание на то, что реакция этерификации обратима. Продукты этой реакции могут вернутся в состояние исходных веществ – спирта и кислоты. Таким образом, над стрелочкой, указывающей в сторону продуктов, мы можем написать – этерификация, а над стрелкой указывающей в сторону исходных веществ, можно написать – гидролиз сложного эфира.
О гидролизе сложных эфиров, мы поговорим чуть позже.
2. Получение сложных эфиров из хлорангидрирдов карбоновых кислот.
Хлорангидриды карбоновых кислот — это производные карбоновых кислот, в которых гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора.
Общая формула хлорангидридов карбоновых кислот такова:
Например, из хлорангидрида уксусной кислоты мы можем получить фенилацетат, путем следующей химической реакции:
Вместо фенола, в данной реакции можно использовать так же и его соли, например фенолят натрия:
Таким же образом эта реакция возможна и для предельных одноатомных и многоатомных спиртов, и их солей:
3. Получение сложного эфира, путем взаимодействия соли карбоновой кислоты и галогеналкана.
Химические свойства сложных эфиров:
1. Галогенирование.
Эта реакция характерна для сложных эфиров, содержащих непредельный углеводородный радикал. Реакция с бромной водой при этом, имеет особое значение, так как она качественная. Происходит обесцвечивание бромной воды.
2. Гидрирование.
Данная реакция так же характерна для сложных эфиров содержащих непредельный углеводородный радикал:
Эта реакция имеет большое практическое значение, так как именно она лежит в основе получения твердого жира – маргарина из жидкого растительного масла.
3. Гидролиз.
В зависимости от условий гидролиз бывает:
— Водный (без катализатора, при высоких температуре и давлении).
— Кислотный (в присутствии кислоты в качестве катализатора).
— Ферментативный (происходит в живых организмах).
Такой гидролиз является обратимым. Для смещения равновесия в сторону продуктов его проводят в присутствие щелочей (или например Na2CO3). При этом гидролиз протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Именно поэтому гидролиз жиров в щелочной среде, называют – омыливанием жиров.
Мыло, которое мы используем, представляет собой смесь солей, поскольку жир, из которого его получают, содержит остатки различных кислот. Натриевые соли высших кислот RCOONa имеют твердое агрегатное состояние, а калиевые RCOOK — жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты.
Все мыла диссоциируют как сильные электролиты по уравнению:
RCOONa —> RCOO(-) + Na(+)
Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO-Na+) и неполярный углеводородный радикал, содержащий 12—18 атомов углерода. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна) . В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко изменяется. Неполярные концы молекулы мыла погружаются в капли масла, а полярные карбоксилат-анионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОО-. Наличие этой оболочки препятствует слиянию частиц, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира, содержащего грязь, обусловливает очищающее действие мыла.
В жесткой воде, содержащей ионы Са2+ и Mg2+, мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде:
4. Взаимодействие с аммиаком.
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Реакция горения.
Горение сложных эфиров происходит с образованием углекислого газа и воды:
2CH3COOCH3 + 7O2 = 6CO2 + 6H20
Применение сложных эфиров.
Сложные эфиры используются в парфюмерии, косметике, в качестве пищевых добавок, для изготовления искусственных волокон, краски, лаков, клея. Они служат исходными веществами в производстве многих фармацевтических препаратов
Благодаря тому, что они смешиваются со многими органическими веществами, они используются как растворители для лаков и красок.
Этилформиат и этилацетат используются как растворители целлюлозных лаков.
Винилацетат используется для производства поливинилацетатных смол, клеев и красок.
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности(изготовление мыла, духов, кремов) .
Сложные эфиры применяются для производства пластмасс, резины в качестве пластификаторов.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Отдельно стоит упомянуть, про биологическую роль жиров.
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
— строительная (входят в состав клеточных мембран).
— энергетическая (1 г жира при окислении дает 9 ккал энергии).
— защитная (теплорегуляционная, механическая защита органов).
— запасная (запас энергии и воды).
— регулирующая (обмен веществ в организме).
Вот собственно и все, что нужно знать о сложных эфирах.
Так же рекомендую к прочтению:
Альдегиды и Кетоны.
Карбоновые кислоты.
То, что нужно знать о Спиртах.
Фенолы.
Удачи вам, в изучение химии и на сдачи экзаменов! До новых встреч!
Сложные эфиры – функциональные производные карбоновых
кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Сложные эфиры карбоновых кислот – соединения с
общей формулой
R–COOR’, где
R и R’ – углеводородные радикалы.
Сложные эфиры предельных одноосновных карбоновых
кислот
имеют общую формулу CnH2nO2:

Физические свойства:
·
Летучие,
бесцветные жидкости
·
Плохо
растворимы в воде
·
Чаще
с приятным запахом
·
Легче
воды
Сложные
эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический
запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. –
апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших
одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших
одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный
эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Аромат. Структурная | Название |
Яблоко
| Этиловый эфир 2-метилбутановой кислоты |
Вишня
| Амиловый эфир муравьиной кислоты |
Груша
| Изоамиловый эфир уксусной кислоты |
Ананас
| Этиловый эфир масляной кислоты (этилбутират) |
Банан
| Изобутиловый |
Жасмин
| Бензиловый |
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Применение
·
В качестве отдушек и усилителей запаха в пищевой и
парфюмерной (изготовление мыла, духов, кремов) промышленности;
·
В производстве пластмасс, резины в качестве
пластификаторов.
Пластификаторы
– вещества,
которые вводят в состав полимерных материалов для придания (или повышения) эластичности и
(или) пластичности при переработке и
эксплуатации.
Применение
в медицине
В конце XIX —
начале ХХ века, когда органический синтез делал свои первые шаги, было
синтезировано и испытано фармакологами множество сложных эфиров. Они стали
основой таких лекарственных средств, как салол, валидол и др. Как
местнораздражающее и обезболивающее средство широко использовался
метилсалицилат, в настоящее время практически вытесненный более эффективными
средствами.
Получение сложных эфиров
Cложные
эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция
этерификации). Катализаторами являются минеральные кислоты.
Видео «Получение уксусноэтилового эфира»
Видео
«Получение борноэтилового эфира»
Реакция
этерификации в условиях кислотного катализа обратима. Обратный процесс –
расщепление сложного эфира при действии воды с образованием карбоновой кислоты
и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+)↔
RCOOH + R’OH
Гидролиз
в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно
заряженный карбоксилат-анион RCOO– не вступает в реакцию с
нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным
гидролизом сложноэфирных связей в жирах при получении мыла).
В прошлой статье мы рассказывали о простых эфирах, а сейчас поговорим 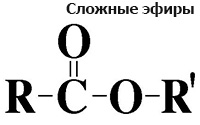 о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.
о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.
Сложные эфиры — органические соединения на основе кислородосодержащих органических карбоновых или неорганических кислот. Структуру вещества можно представить как молекулу кислоты, в которой атом Н в гидроксиле ОН— замещен углеводородным радикалом.
Получают сложные эфиры в результате реакции кислоты и спирта (реакция этерификации).
Классификация
 — Фруктовые эфиры — жидкости с фруктовым запахом, молекула содержит не более восьми атомов углерода. Получают из одноатомных спиртов и карбоновых кислот. Эфиры с цветочным запахом получают с помощью ароматических спиртов.
— Фруктовые эфиры — жидкости с фруктовым запахом, молекула содержит не более восьми атомов углерода. Получают из одноатомных спиртов и карбоновых кислот. Эфиры с цветочным запахом получают с помощью ароматических спиртов.
— Воски — твердые вещества, содержат в молекуле от 15 до 45 атомов С.
— Жиры — содержат в молекуле 9-19 атомов углерода. Получают из глицерина (трехатомного спирта) и высших карбоновых кислот. Жиры могут быть жидкими (растительные жиры, называемые маслами) и твердыми (животные жиры).
— Сложные эфиры минеральных кислот по своим физическим свойствам тоже могут быть как маслянистыми жидкостями (до 8 атомов углерода), так и твердыми веществами (от девяти атомов C).
Свойства
В нормальных условиях сложные эфиры могут быть жидкими без цвета, с фруктовым или цветочным запахом, или твердыми, пластичными; как правило, без запаха. Чем длиннее цепочка углеводородного радикала, тем тверже вещество. Почти неводорастворимы. Хорошо растворяются в органических растворителях. Горючи.
Вступают в реакции с аммиаком с образованием амидов; с водородом (именно эта реакция превращает жидкие растительные масла в твердые маргарины).
В результате реакции гидролиза разлагаются на спирт и кислоту. Гидролиз жиров в щелочной среде приводит к образованию не кислоты, а ее соли — мыла.
Сложные эфиры органических кислот малотоксичны, оказывают на человека наркотическое воздействие, в основном относятся ко 2-му и 3-му классу опасности. Некоторые реактивы на производстве требуют использования специальных средств защиты для глаз и дыхания. Чем больше длина молекулы эфира, теми он токсичнее. Эфиры неорганических фосфорных кислот ядовиты.
В организм вещества могут попадать через органы дыхания и кожу. Симптомами острого отравления служат возбуждение и нарушенная координация движений с последующим угнетением ЦНС. Регулярное воздействие может привести к болезням печени, почек, сердечно-сосудистой системы, нарушениям формулы крови.
Применение
— В органическом синтезе.
— Для производства инсектицидов, гербицидов, смазок, пропиток для кожи и бумаги, моющих средств, глицерина, нитроглицерина, олиф, масляных красок, синтетических волокон и смол, полимеров, оргстекла, пластификаторов, реагентов для обогащения руд.
— Как добавка к моторным маслам.
— В синтезе парфюмерных отдушек, пищевых фруктовых эссенций и косметических ароматизаторов; лекарственных средств, например, витаминов А, Е, В1, валидола, мазей.
— Как растворители красок, лаков, смол, жиров, масел, целлюлозы, полимеров.
В ассортименте магазина «ПраймКемикалсГрупп» вы можете купить востребованные сложные эфиры, в том числе бутилацетат и Твин-80.
Бутилацетат
Применяется как растворитель; в парфюмерной промышленности для изготовления отдушек; для дубления кож; в фармацевтике — в процессе изготовления некоторых лекарств.
Твин-80
Он же полисорбат-80, полиоксиэтилен сорбитан моноолеат (основан на сорбите оливкового масла). Эмульгатор, растворитель, техническая смазка, модификатор вязкости, стабилизатор эфирных масел, неионогенный ПАВ, увлажнитель. Входит в состав растворителей и смазочно-охлаждающих жидкостей. Используется для производства продукции косметического, пищевого, бытового, сельскохозяйственного, технического назначения. Обладает уникальным свойством превращать смесь воды и масла в эмульсию.
СЛОЖНЫЕ ЭФИРЫ – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R. Прилагательное «сложные» в названии эфиров помогает отличить их от соединений, именуемых простыми эфирами.
Если исходная кислота многоосновная, то возможно образование либо полных эфиров – замещены все НО-группы, либо кислых эфиров – частичное замещение. Для одноосновных кислот возможны только полные эфиры (рис.1).
Рис. 1. ПРИМЕРЫ СЛОЖНЫХ ЭФИРОВ на основе неорганической и карбоновой кислоты
Номенклатура сложных эфиров.
Название создается следующим образом: вначале указывается группа R, присоединенная к кислоте, затем – название кислоты с суффиксом «ат» (как и в названиях неорганических солей: карбонат натрия, нитрат хрома). Примеры на рис. 2
Рис. 2. НАЗВАНИЯ СЛОЖНЫХ ЭФИРОВ. Фрагменты молекул и соответствующие им фрагменты названий выделены одинаковым цветом. Сложные эфиры обычно рассматривают как продукты реакции между кислотой и спиртом, например, бутилпропионат можно воспринимать как результат взаимодействия пропионовой кислоты и бутанола.
Если используют тривиальное (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ) название исходной кислоты, то в название соединения включают слово «эфир», например, С3Н7СООС5Н11 – амиловый эфир масляной кислоты.
Классификация и состав сложных эфиров.
Среди изученных и широко применяемых сложных эфиров большинство представляют соединения, полученные на основе карбоновых кислот. Сложные эфиры на основе минеральных (неорганических) кислот не столь разнообразны, т.к. класс минеральных кислот менее многочисленен, чем карбоновых (многообразие соединений – один из отличительных признаков органической химии).
Когда число атомов С в исходных карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом. Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей. Интересны эти соединения широким спектром приятных ароматов (табл. 1), некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
| Табл. 1. НЕКОТОРЫЕ СЛОЖНЫЕ ЭФИРЫ, обладающие фруктовым или цветочным ароматом (фрагменты исходных спиртов в формуле соединения и в названии выделены жирным шрифтом) | ||
| Формула сложного эфира | Название | Аромат |
| СН3СООС4Н9 | Бутилацетат | грушевый |
| С3Н7СООСН3 | Метиловый эфир масляной кислоты | яблочный |
| С3Н7СООС2Н5 | Этиловый эфир масляной кислоты | ананасовый |
| С4Н9СООС2Н5 | Этиловый эфир изовалериановой кислоты | малиновый |
| С4Н9СООС5Н11 | Изоамиловый эфир изовалериановой кислоты | банановый |
| СН3СООСН2С6Н5 | Бензилацетат | жасминовый |
| С6Н5СООСН2С6Н5 | Бензилбензоат | цветочный |
При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками, они, как правило, не обладают запахом. Пчелиный воск содержит смесь различных сложных эфиров, один из компонентов воска, который удалось выделить и определить его состав, представляет собой мирициловый эфир пальмитиновой кислоты С15Н31СООС31Н63. Китайский воск (продукт выделения кошенили – насекомых Восточной Азии) содержит цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Кроме того, воски содержат и свободные карбоновые кислоты и спирты, включающие большие органические группы. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.
Третья группа – жиры. В отличие от предыдущих двух групп на основе одноатомных спиртов ROH, все жиры представляют собой сложные эфиры, образованные из трехатомного спирта глицерина НОСН2–СН(ОН)–СН2ОН. Карбоновые кислоты, входящие в состав жиров, как правило, имеют углеводородную цепь с 9–19 атомами углерода. Животные жиры (коровье масло, баранье, свиное сало) – пластичные легкоплавкие вещества. Растительные жиры (оливковое, хлопковое, подсолнечное масло) – вязкие жидкости. Животные жиры, в основном, состоят из смеси глицеридов стеариновой и пальмитиновой кислоты (рис. 3А,Б). Растительные масла содержат глицериды кислот с несколько меньшей длиной углеродной цепи: лауриновой С11Н23СООН и миристиновой С13Н27СООН. (как и стеариновая и пальмитиновая – это насыщенные кислоты). Такие масла могут долго храниться на воздухе, не меняя своей консистенции, и потому называются невысыхающими. В отличие от них, льняное масло содержит глицерид ненасыщенной линолевой кислоты (рис. 3В). При нанесении тонким слоем на поверхность такое масло под действием кислорода воздуха высыхает в ходе полимеризации по двойным связям, при этом образуется эластичная пленка, не растворимая в воде и органических растворителях. На основе льняного масла изготавливают натуральную олифу.
Рис. 3. ГЛИЦЕРИДЫ СТЕАРИНОВОЙ И ПАЛЬМИТИНОВОЙ КИСЛОТЫ (А И Б) – компоненты животного жира. Глицерид линолевой кислоты (В) – компонент льняного масла.
Сложные эфиры минеральных кислот (алкилсульфаты, алкилбораты, содержащие фрагменты низших спиртов С1–8) – маслянистые жидкости, эфиры высших спиртов (начиная с С9) – твердые соединения.
Химические свойства сложных эфиров.
Наиболее характерно для эфиров карбоновых кислот гидролитическое (под действием воды) расщепление сложноэфирной связи, в нейтральной среде оно протекает медленно и заметно ускоряется в присутствии кислот или оснований, т.к. ионы Н+ и НО– катализируют этот процесс (рис. 4А), причем гидроксильные ионы действуют более эффективно. Гидролиз в присутствии щелочей называют омылением. Если взять количество щелочи, достаточное для нейтрализации всей образующейся кислоты, то происходит полное омыление сложного эфира. Такой процесс проводят в промышленном масштабе, при этом получают глицерин и высшие карбоновые кислоты (С15–19) в виде солей щелочных металлов, представляющих собой мыло (рис. 4Б). Содержащиеся в растительных маслах фрагменты ненасыщенных кислот, как и любые ненасыщенные соединения, могут быть прогидрированы, водород присоединяется к двойным связям и образуются соединения, близкие к животным жирам (рис. 4В). Этим способом в промышленности получают твердые жиры на основе подсолнечного, соевого или кукурузного масла. Из продуктов гидрирования растительных масел, смешанных с природными животными жирами и различными пищевыми добавками, изготавливают маргарин.
Основной способ синтеза – взаимодействие карбоновой кислоты и спирта, катализируемое кислотой и сопровождаемое выделением воды. Эта реакция обратна показанной на рис. 3А. Чтобы процесс шел в нужном направлении (синтез сложного эфира), из реакционной смеси дистиллируют (отгоняют) воду. Специальными исследованиями с применением меченых атомов удалось установить, что в процессе синтеза атом О, входящий в состав образующейся воды, отрывается от кислоты (отмечено красной пунктирной рамкой), а не от спирта (нереализующийся вариант выделен синей пунктирной рамкой).
По такой же схеме получают сложные эфиры неорганических кислот, например, нитроглицерин (рис. 5Б). Вместо кислот можно использовать хлорангидриды кислот, метод применим как для карбоновых (рис. 5В), так и для неорганических кислот (рис. 5Г).
Взаимодействие солей карбоновых кислот с галоидалкилами RCl также приводит к сложным эфирам (рис. 5Г), реакция удобна тем, что она необратима – выделяющаяся неорганическая соль сразу удаляется из органической реакционной среды в виде осадка.
Применение сложных эфиров.
Этилформиат НСООС2Н5 и этилацетат Н3СООС2Н5 используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).
Сложные эфиры на основе низших спиртов и кислот (табл. 1) используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
Жиры вместе с углеводами и белками составляют набор необходимых для питания пищевых продуктов, они входят в состав всех растительных и животных клеток, кроме того, накапливаясь в организме, играют роль энергетического запаса. Из-за низкой теплопроводности жировой слой хорошо предохраняет животных (в особенности, морских – китов или моржей) от переохлаждения.
Животные и растительные жиры представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина (рис. 4), используемого в косметической промышленности и как компонент различных смазок.
Нитроглицерин (рис. 4) – известный лекарственный препарат и взрывчатое вещество, основа динамита.
На основе растительных масел изготавливают олифы (рис. 3), составляющие основу масляных красок.
Эфиры серной кислоты (рис. 2) используют в органическом синтезе как алкилирующие (вводящие в соединение алкильную группу) реагенты, а эфиры фосфорной кислоты (рис. 5) – как инсектициды, а также добавки к смазочным маслам.
Михаил Левицкий






