Какие продукты реакции гидролиза могут образовываться
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.

Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью оксиления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:

Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут провзаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О=(МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень обратимого гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:

2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:

По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз. Среда водных растворов: кислая, нейтральная, щелочная.
Определение
Гидролиз веществ (в том числе органических соединений) — обменное взаимодействие вещества с водой, приводящее к разложению и образованию новых соединений.
Таким образом, гидролиз солей можно рассматривать как частный случай реакций ионного обмена. Для составления уравнений гидролиза следует помнить, что в водных растворах присутствуют и катионы водорода ($H^+$) и гидроксид-ионы ($OH^-$), образующиеся в ходе диссоциации воды:
$H_2O Leftrightarrow H^+ + OH^-$
Большинство солей подвергается обратимому гидролизу, однако существует ряд солей, которые гидролизуются необратимо. Гидролизу могут подвергаться не только соли, но и другие неорганические соединения. например бинарные.
НЕОБРАТИМЫЙ ГИДРОЛИЗ
Для бинарных соединений характерен необратимый гидролиз:
$NCl_3 + 3H_2O = NH_3 + 3HClO$
$PCl_5 + 4H_2O = H_3PO_4 + 5HCl$
$NaH + H_2O = NaOH + H_2$
ГИДРОЛИЗ СОЛЕЙ
Гидролиз солей — взаимодействие ионов соли с ионами воды, приводящее к образованию слабого (малодиссоциирующего) электролита.
Запомнить! При составлении уравнений гидролиза солей необходимо учитывать, что гидролиз идет по слабому иону, а тип среды определяется по сильному иону, входящему в состав соли.
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$. Это соединение относится к классу солей и является растворимым и, следовательно, сильным электролитом, а значит, в водном растворе подвергается диссоциации:
$Na_2CO_3 Leftrightarrow 2Na^+ + CO_3^{2-}$
Вспомнив классификацию электролитов, можно утверждать, что данная соль образована сильным основанием ($Na^+ rightarrow NaOH$) и слабой кислотой ($ CO_3^{2-} rightarrow H_2CO_3$). Ион натрия с водой не взаимодействует, поскольку соответствующее основание (гидроксид натрия) является сильным, то есть полностью диссоциирует на ионы:
$Na^+ +HOH ne $
А карбонат-ион при взаимодействии с водой образует слабую угольную кислота ($H_2CO_3$), которая разлагается на углекислый газ и воду. :
$CO_3^{2-} +2HOH leftrightarrow underbrace{ H_2CO_3}+ 2OH^-$
$hspace{1.35cm} swarrow searrow$
$ hspace{1.35cm} CO_2 uparrow + H_2O$
Следовательно именно анион кислотного остатка приводит к образованию слабого электролита. В таком случае говорят, что гидролиз идет по аниону.
Образующиеся при диссоциации сильного электролита NaOH гидроксид-ионы обуславливают тип среды — щелочной.
Соли многоосновных кислот гидролизуются ступенчато, образуя кислые соли:
$CO_3^{2-} +HOH leftrightarrow HCO_3^- + OH^-hspace{1cm} K_2CO_3 + H_2O leftrightarrow KHCO_3 + KOH$
$HCO_3^- +HOH leftrightarrow H_2CO_3+ OH^- hspace{1cm} KHCO_3 + H_2O leftrightarrow H_2CO_3+ NaOH$
Аналогично, гидролиз солей многокислотных оснований протекает ступенчато:
$I) hspace{0.3cm} Fe^{3+} + HOH leftrightarrow FeOH^{2+} + H^+ hspace{1cm} FeCl_3 + H_2O leftrightarrow FeOHCl_2 + HCl$
$II) hspace{0.3cm} FeOH^{2+} + HOH leftrightarrow Fe(OH)_2^+ + H^+ hspace{1cm} FeOHCl_2 + H_2O leftrightarrow Fe(OH)_2Cl + HCl$
$III)hspace{0.3cm} Fe(OH)_2^+ + HOH leftrightarrow Fe(OH)_3 + H^+ hspace{1cm} Fe(OH)_2Cl + H_2O leftrightarrow Fe(OH)_3 + HCl$
сокращенные ионные уравнения молекулярные уравнения
При этом гидролиз по второй и третьей ступени при комнатной температуре практически не протекает
Напомним, что для процессов диссоциации константа равновесия называется константой диссоциации и связана со степенью диссоциации законом разбавления Оствальда.
Закон разбавления Оствальда
$K_{textrm{д}} = dfrac{alpha^2 cdot C}{(1 — alpha)}$
где $K_{textrm{д}}$ константа диссоциации, С — молярная концентрация,$alpha$ — степень диссоциации
Константа гидролиза
Константа гидролиза – величина, равная произведению констант всех стадий, из которых складывается процесс гидролиза с учетом стехиометрических коэффициентов.
Константа гидролиза $K_{textrm{г}}$ может быть рассчитана на основе значений ионного произведения воды $K_w$ и константы диссоциации $K_{textrm{д}}$ образующихся в результате гидролиза слабой кислоты или слабого основания:
$K_{textrm{г}} = dfrac{K_w}{K_{textrm{д}}}$
Чем выше величина константы, тем сильнее соль подвергается гидролизу.
Константа гидролиза первой и последующих ступеней для многозарядных слабых ионов сильно отличается: константа гидролиза по первой ступени в несколько раз больше, чем константа гидролиза по второй ступени. Поэтому гидролиз протекает преимущественно по первой ступени (для многозарядных слабых ионов)
Тип гидролиза и среды в зависимости от строения соли обобщены в таблице:
| Соль образована | сильной кислотой | слабой кислотой | |
|---|---|---|---|
HNO$_3$,H$_2$SO$_4$, HCl, HBr, HI, HClO$_4$, HClO$_3$, HBrO$_3$ | все остальные кислоты | ||
| сильным основанием | все «Р» + Ca(OH)$_2$ | гидролизу не подвергается среда нейтральная pH=7 | гидролиз по аниону среда щелочная pH>7 |
| слабым основанием | все «Н», «М» + NH$_3$ $cdot $H$_2$O | гидролиз по катиону среда кислая pH<7 | гидролиз и по катиону и по аниону среда нейтральная pH=7 |
Пример 1
Гидролиз соли, образованной слабым основанием и сильной кислотой
$NH_4Cl = NH_4^+ + Cl^-$
$NH_4^+ + HOH leftrightarrow NH_4OH + H^+ hspace{0.5cm}$ выделяются катионы водорода, среда — кислая
$Cl^- + HOH ne hspace{3cm}$ хлорид-ион не подвергается гидролизу (сильная кислота)
Молекулярное уравнение гидролиза:
$NH_4Cl + H_2O leftrightarrow NH_4OH + HCl$
гидролиз по катиону, среда кислая, pH<7
Пример 2
Гидролиз соли, образованной слабой кислотой и сильным основанием
$CH_3COOK = CH_3COO^- + K^-$
$K^+ + HOH ne hspace{1cm}$ катион калия не подвергается гидролизу (сильное основание)
$CH_3COO^- + HOH leftrightarrow CH_3COOH + OH^- hspace{1cm}$ выделяются гидроксид-ионы, среда щелочная
Молекулярное уравнение гидролиза:
$CH_3COOK + H_2O leftrightarrow CH_3COOH + KOH$
гидролиз по аниону, среда щелочная, pH>7
Пример 3
Гидролиз соли, образованной слабым основанием и слабой кислотой
$CH_3COONH_4 = CH_3COO^- + NH_4^+$
$CH_3COO^- + HOH leftrightarrow CH_3COOH + OH^- hspace{1cm}$ выделяются гидроксид-ионы,
$NH_4Cl = NH_4^+ + Cl^-$
$NH_4^+ + HOH leftrightarrow NH_4OH + H^+ hspace{0.5cm}$ выделяются катионы водорода
Молекулярное уравнение гидролиза:
$CH_3COONH_4 + H_2O leftrightarrow CH_3COOH + NH_4OH$
гидролиз и по аниону и по катиону, среда нейтральная, pH=7
Пример 4
Гидролиз соли, образованной сильным основанием и сильной кислотой
$Na_2SO_4 = 2Na^+ + SO_4^{2-}$
$Na^+ + HOH ne hspace{1cm}$ катион натрия не подвергается гидролизу (сильное основание)
$SO_4^{2-}- + HOH ne hspace{1cm}$ сульфат-ион не подвергается гидролизу (сильная кислота)
Молекулярное уравнение гидролиза:
$Na_2SO_4 + H_2O ne$
гидролиз не идет, среда нейтральная, pH=7
Факторы, влияющие на гидролиз
Гидролиз солей — обратимая реакция и сместить равновесие в ней можно руководствуясь принципом Ле-Шателье.
Гидролиз можно усилить разбавлением раствора, нагреванием (гидролиз – эндотермический процесс) и связыванием (удалением) какого-либо продукта гидролиза.
Протеканию реакции гидролиза можно препятствовать увеличением концентрации продуктов гидролиза. Обычно этого достигают подкислением раствора соли слабого основания и сильной кислоты или подщелачиванием раствора соли сильного основания и слабой кислоты. Например, чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Гидролиз находит широкое применение и играет важную роль, например, в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
Жиры — органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных)
кислот.
К жирным кислотам (их формулы лучше выучить 😉 относятся:
- Пальмитиновая — C15H31COOH (предельная)
- Стеариновая — C17H35COOH (предельная)
- Олеиновая — C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая — C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая — C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров
есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры — твердые и
содержат остатки предельных жирных кислот.

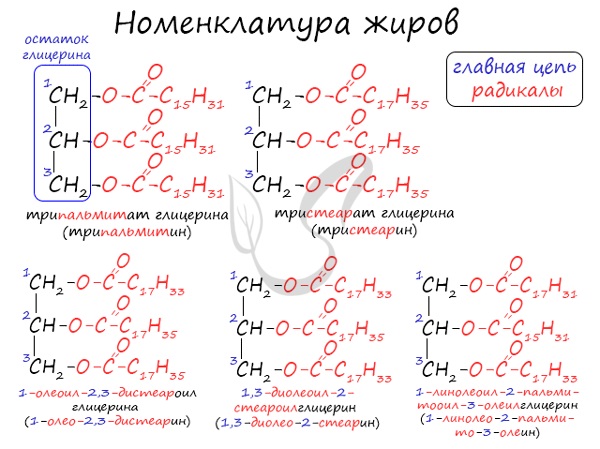
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов — остатков жирных
кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс «оил».
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание «ин» к названию кислоты и приставку, указывая, сколько гидроксогрупп
в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 😉
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми
(жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.

Химические свойства жиров
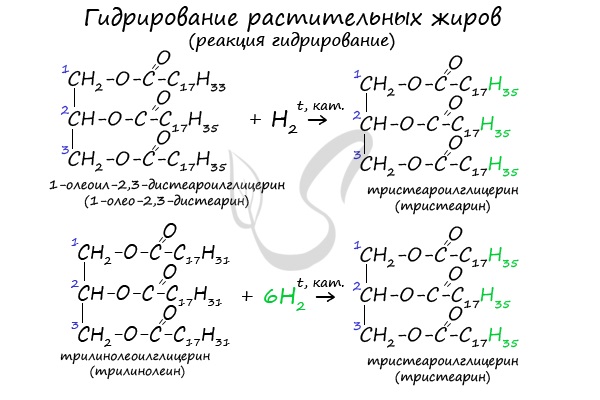
- Гидрирование растительных жиров
- Гидролиз
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой
промышленности получают маргарин.
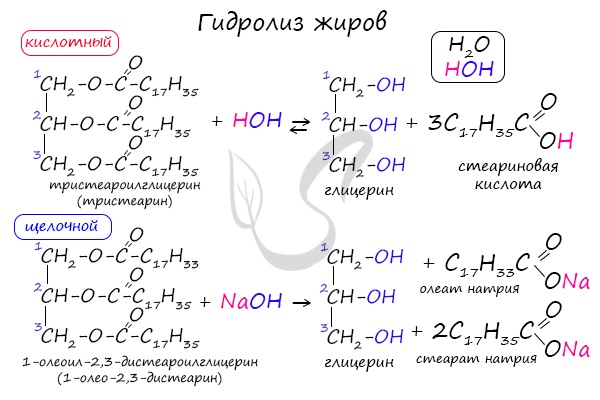
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза
образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза — глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот — мыла. Кислотный гидролиз протекает
обратимо, щелочной — необратимо.

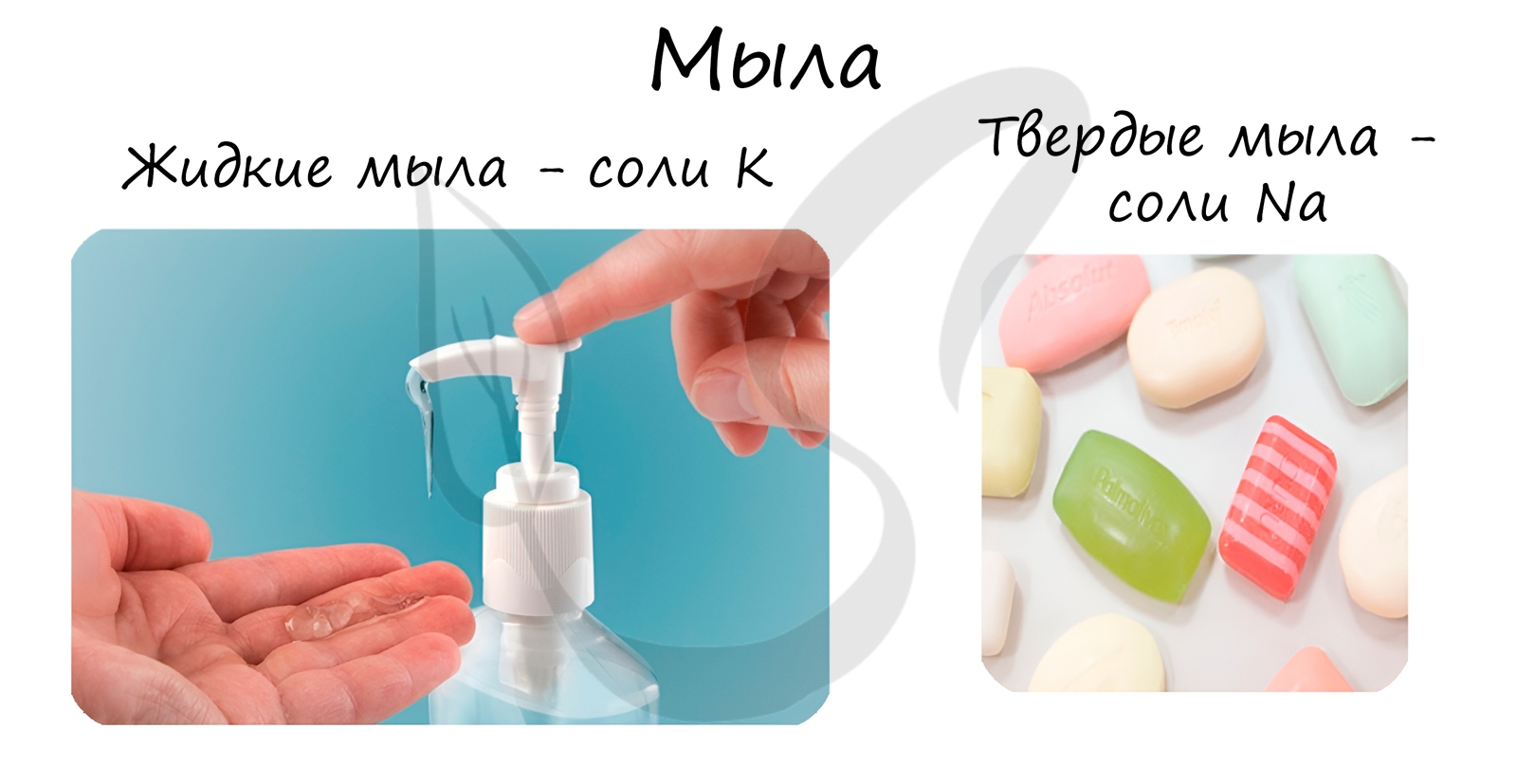
В состав твердого мыла входят соли Na, в состав жидкого — K.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
