Какие продукты образуются при гликолизе

Гликолиз (от
греч. glycys – сладкий и lysis –
растворение, распад) – это последовательность ферментативных реакций,
приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных
условиях пируват проникает в митохондрии, где полностью окисляется до СО2
и Н2О. Если содержание кислорода недостаточно, как это может иметь
место в активно сокращающейся мышце, пируват превращается в лактат.
Итак,
гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный
путь, поскольку он может использовать кислород, если
последний
доступен (аэробные условия), но может протекать и в отсутствие кислорода
(анаэробные условия).
Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы,
протекающий в тканях человека и животных без потребления кислорода. Конечным
продуктом гликолиза является молочная кислота. В процессе гликолиза образуется
АТФ. Суммарное уравнение гликолиза можно представить следующим образом:

В анаэробных
условиях гликолиз – единственный процесс в животном организме, поставляющий
энергию. Именно благодаря гликолизу организм человека и животных определенный
период может осуществлять ряд физиологических функций в условиях
недостаточности кислорода. В тех случаях, когда гликолиз протекает в
присутствии кислорода, говорят об аэробном гликолизе .
Последовательность
реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо
изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство
из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и
свойства которых достаточно известны. Заметим, что гликолиз протекает в
гиало-плазме (цитозоле) клетки.
Первой
ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос
остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом
гексокиназой:
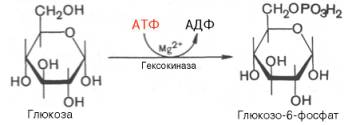
Образование
глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением
значительного количества свободной энергии системы и может считаться
практически необратимым процессом.
Наиболее
важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е.
последний служит одновременно и продуктом реакции, и аллостерическим
ингибитором.
Фермент
гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и
других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме
гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование
только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см.
главу 16).
Второй
реакцией гликолиза является превращение глюкозо-6-фос-фата под действием
фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:
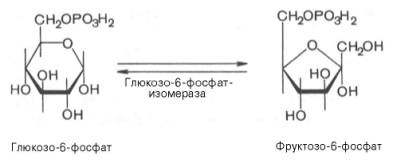
Эта реакция
протекает легко в обоих направлениях, и для нее не требуется каких-либо
кофакторов.
Третья
реакция катализируется ферментом фосфофруктокиназой; образовавшийся
фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:
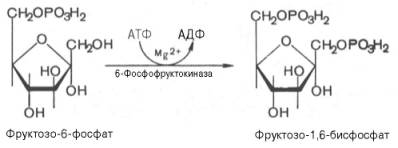
Данная
реакция аналогично гексокиназной практически необратима, протекает в
присутствии ионов магния и является наиболее медленно текущей реакцией
гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа
относится к числу аллостерических ферментов. Она ингибируется АТФ и
стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность
фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении
этого коэффициента интенсивность гликолиза повышается. Так, в неработающей
мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно
высокая. Во время работы мышцы происходит интенсивное потребление АТФ и
активность фосфофруктокиназы повышается, что приводит к усилению процесса
гликолиза.
Четвертую
реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента
фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
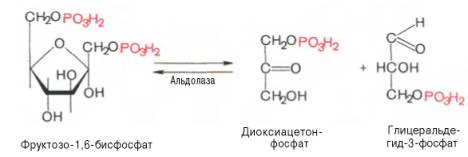
Эта реакция
обратима. В зависимости от температуры равновесие устанавливается на различном
уровне. При повышении температуры реакция сдвигается в сторону большего
образования триозофосфатов (дигидро-ксиацетонфосфата и
глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом
триозофосфатизомеразой:

Равновесие
данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95%
дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие
реакции гликолиза может непосредственно включаться только один из двух
образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого
по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы
ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием
глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая
стадия – наиболее сложная и важная. Она включает окислительно-восстановительную
реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным
фосфорилированием, в процессе которого образуется АТФ.
В результате
шестой реакции глицеральдегид-3-фосфат в присутствии фермента
глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата
подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой
кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или
бромацетатом, протекает в несколько этапов:
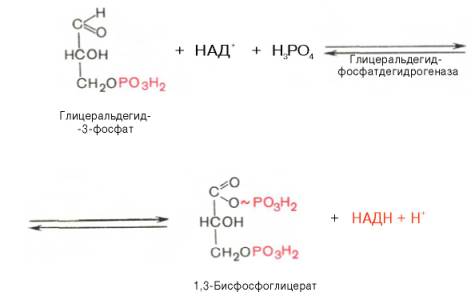
1,3-Бисфосфоглицерат
представляет собой высокоэнергетическое соединение (макроэргическая связь
условно обозначена знаком «тильда» ~). Механизм действия
глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии
неорганического фосфата НАД+ выступает как акцептор водорода,
отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН
глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп
последнего. Образовавшаяся связь богата энергией, но она непрочная и
расщепляется под влиянием неорганического фосфата, при этом образуется
1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача
богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с
образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
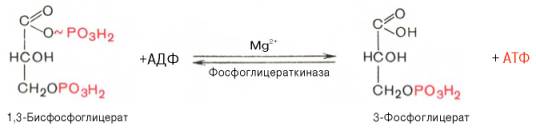
Таким
образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы
и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной
группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме
энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из
высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция
сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и
3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту
(2-фосфоглицерат).
Реакция
легкообратима, протекает в присутствии ионов Mg2+. Кофактором
фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в
фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая
реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота
в результате отщепления молекулы воды переходит в фосфоенолпировиноградную
кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится
высокоэргической:
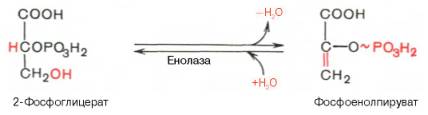
Енолаза
активируется двухвалентными катионами Mg2+или
Мn2+ и ингибируется фторидом.
Десятая
реакция характеризуется разрывом высокоэргической связи и переносом фосфатного
остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование).
Катализируется ферментом пируваткиназой:
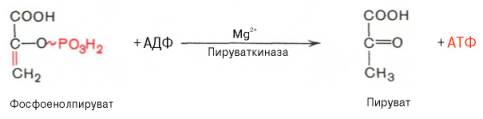
Для действия
пируваткиназы необходимы ионы Mg2+, а также
одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки
реакция является практически необратимой.
В результате
одиннадцатой реакции происходит восстановление пировиноградной кислоты и
образуется молочная кислота. Реакция протекает при участии фермента
лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Последовательность
протекающих при гликолизе реакций представлена на рис. 10.3.
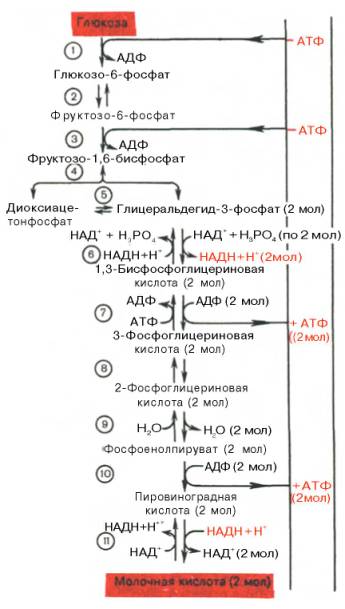
Рис. 10.3. Последовательность реакций гликолиза.
1 —
гексокиназа; 2 — фосфоглюкоизоме-раза; 3 — фосфофруктокиназа; 4 — альдо-лаза; 5
— триозофосфатизомераза; 6 — гли-церальдегидфосфатдегидрогеназа; 7
-фосфоглицераткиназа; 8 — фосфоглицеромутаза; 9 — енолаза; 10 —
пируватки-наза; 11 —
лактатдегидрогеназа.
Реакция
восстановления пирувата завершает внутренний окислительно-восстановительный
цикл гликолиза. НАД+ при этом играет роль промежуточного переносчика
водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту
(11-я реакция), при этом сам он регенерируется и вновь может участвовать в
циклическом процессе, получившем название гликолитический оксидоредукции.
Биологическое
значение процесса гликолиза заключается прежде всего в образовании богатых
энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2
молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих
образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции).
Таким образом, энергетическая эффективность гликолиза в анаэробных условиях
составляет 2 молекулы АТФ на одну молекулу глюкозы.
Как
отмечалось, основной реакцией, лимитирующей скорость гликолиза, является
фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая
гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза
осуществляется также ЛДГ
и ее изоферментами.
В тканях с
аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1
и ЛДГ2 (см. главу 4). Эти изоферменты инги-бируются даже небольшими
концентрациями пирувата, что препятствует образованию молочной кислоты и
способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле
трикарбоновых кислот.
В тканях
человека, в значительной степени использующих энергию гликолиза (например,
скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4.
Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые
ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5
обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в
молочную кислоту.
Как
отмечалось, процесс анаэробного распада гликогена получил название
гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза
происходит при участии 2 ферментов – фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате
фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс
гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и
гликогенолиза полностью совпадают:
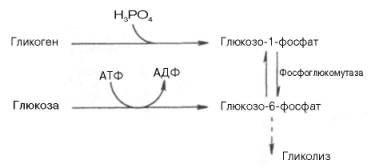
В процессе
гликогенолиза в виде макроэргических соединений накапливаются не две, а три
молекулы АТФ (АТФ не тратится на образование глюкозо-6-фосфата). Кажется, что
энергетическая эффективность глико-генолиза выглядит несколько более высокой по
сравнению с процессом гликолиза, но эта эффективность реализуется только при
наличии активной фосфорилазы а.
Следует иметь в виду, что в процессе активации фосфо-рилазы b расходуется АТФ (см. рис. 10.2).
Еще по теме:
- ГЛИКОЛИЗ — химическая энциклопедия
- Гликолиз — биохимический справочник
- Гликолиз — Наглядная биохимия
Гликолиз — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты, не является мембранозависимым процессом. Он происходит в цитоплазме. Однако ферменты гликолиза связаны со структурами цитоскелета. Суть гликолиза состоит в том, что молекула глюкозы (C6H12O6) без участия кислорода распадается на две молекулы пировиноградной кислоты (СН3СОСООН). При этом окисление идет за счет отщепления от молекулы глюкозы четырех атомов водорода, связывающихся со сложным органическим веществом НАД с получением двух молекул НАД•Н. Выделяющаяся при этом энергия запасается (40% от общего количества) в виде макроэргических связей двух молекул АТФ. 60% энергии выделяется в виде тепла. При последующем окислении НАД•Н получается еще 6 молекул АТФ. Таким образом, полный энергетический выход гликолиза в анаэробных условиях составляет 8 молекул АТФ.
На схеме в рамках обозначены исходные субстраты и конечные продукты гликолиза, цифрами в скобках — число молекул.
Для распада и частичного окисления молекулы глюкозы требуется протекание 11 сложных последовательных реакций.
Реакции гликолиза
Ход реакций
Ферменты, Активаторы, ингибиторы
Подготовительная стадия гликолиза
Стадия активации глюкозы проходит в 5 реакций, в ходе которых 1 молекула гексозы (глюкозы) расщепляется на 2 молекулы триоз-глицеральдегидфосфата
1. Необратимая реакция фосфорилирования глюкозы
Процесс гликолиза начинается с фосфорилирования глюкозы за счет АТФ — первая реакция. Это первая пусковая реакция гликолиза. Ее результатом является глюкозо-6-фосфат, имеющий отрицательный заряд. В гликолизе может участвовать не только глюкоза, но и другие гексозы (фруктоза), но в результате фосфорилирования и активации все равно образуется глюкозо-6-фосфат.

фермент: гексокиназа
Активаторы: АДФ, Н3РO4.
Ингибиторы: глюкозо-6-Ф, фосфоенолпируват.
2. Обратимая реакция изомеризации глюкозо-6-фосфата
Во второй реакции происходит изомеризация (внутримолекулярные перестройки) глюкозо-6-фосфата во фруктозо-6-фосфат.

фермент: глюкозо-6-фосфатизомераза
3. Необратимая реакция фосфорилирования фруктозо-6-фосфата (ключевая стадия гликолиза)
В третьей реакции происходит фосфорилирование (присоединение остатка ортофосфорной кислоты) фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата. При этом затрачивается еще одна молекула АТФ (уже вторая) — это вторая пусковая реакция гликолиза. Она идет в присутствии Mg2+ и является необратимой, так как сопровождается масштабным уменьшением свободной энергии.

фермент: фосфофруктокиназа
Активаторы: АДФ, АМФ, Н3РO4, К+.
Ингибиторы: АТФ, цитрат, НАДН.
4. Обратимая реакция дихотомического расщепления фруктозо-1,6-дифосфата
В четвертой реакции гликолиза происходит расщепление фруктозо-1,6-дифосфата на две молекулы глицеральдегид-3-фосфата.

фермент: алъдолаза
5. Обратимая реакция изомеризации дигидроксиацетона-3-фосфат в глицеральдегид-3-фосфат
В пятой реакции происходит изомеризация полученных триозофосфатов. На этом заканчивается первая стадия гликолиза.

фермент: триозофосфатизомераза
Стадия генерации АТФ
Проходит в 6 реакций (или 5), в ходе которых энергия окислительных реакций трансформируется в химическую энергию АТФ (субстратное фосфорилирование).
6. Окисление глицеральдегид-3-фосфата до 1,3-дифосфоглицерата (реакция гликолитической оксиредукции)
В шестой реакции происходит окисление альдегидной группы до карбоксильной. Выделившийся Н+ акцептируется NAD, который восстанавливается до NADH. Освобождающаяся энергия затрачивается для образования высокоэнергетической связи 1,3-бифосфоглицерата (1,3-бифосфоглицериновая кислота).

фермент: глицералъдегид-3-фосфат-дегидрогеназа
7. Субстратное фосфорилирование АДФ (7)
В седьмой реакции фосфорильная группа 1,3-бифосфоглицерата переносится на ADP, в результате чего образуется АТР (напоминаем, что следует иметь в виду две параллельные цепи реакций, с участием двух молекул триоз, образовавшихся из одной молекулы гексозы, следовательно, синтезируется не одна, а две молекулы АТР).

фермент: фосфоглицераткиназа
8. Реакция изомеризации 3-фосфоглицерата в 2-фосфоглицерат
В восьмой реакции гликолиза происходит перенос фосфатной группы с третьего атома углерода на второй. В результате образуется 2-фосфоглицерат (2-фосфоглицериновая кислота).

9. Реакция енолизации
Девятая реакция сопровождается внутримолекулярными окислительно-восстановительными процессами, в результате которых образуется фосфоенолпируват (фосфоенолпировиноградная кислота) с высокоэнергетической связью во втором атоме углерода и отщепляется молекула воды

фермент: енолаза
10. Реакция субстратного фосфорилирования
В ходе десятой реакции фосфорильная группа переносится на ADP. При этом синтезируется АТР и пируват (пировиноградная кислота). Эта реакция также необратима, поскольку высокоэкзергонична.

фермент: пируваткиназа
11. Реакция обратимого восстановления пировиноградной кислоты до молочной кислоты (в анаэробных условиях)
Если после гликолиза следует аэробное расщепление, пируват мигрирует в матрикс митохондрий, где, взаимодействуя с коэнзимом-А, участвует в образовании ацетил-СоА. В анаэробных условиях пируват при участии NADH восстанавливается до лактата (молочной кислоты), который при этом является конечным продуктом гликолиза. Затем в аэробных условиях лактат может обратно превратиться в пируват и окислиться в митохондриях.

фермент: лактатдегидрогеназа
1. Биология для поступающих в вузы / Г.Л. Билич, В.А. Крыжановский. — 2008.
2. Биология в таблицах и схемах / Спб. — 2004.
3. Биохимия в схемах и таблицах / И. В. Семак — Минск — 2011.
Гликолиз[править | править код]
Гликолиз – процесс распада одной молекулы глюкозы с выделением энергии, достаточной для «зарядки» двух молекул АТФ, протекает в саркоплазме под воздействием 10 специальных ферментов.
C6H12O6 + 2H3PO4 + 2АДФ = 2C3H6O3 + 2АТФ + 2H2O.
Гликолиз может протекать без потребления кислорода (такие процессы называются анаэробными) и с потреблением кислорода (аэробный гликолиз) способен быстро восстанавливать запасы АТФ в мышце.
При занятиях бодибилдингом и высокоинтенсивных упражнениях происходит анаэробный гликолиз, с образованием молочной кислоты.
Во время динамических нагрузок, таких как бег, плавание и т.п., происходит аэробный гликолиз.
Аэробный гликолиз происходит в митохондриях под воздействием специальных ферментов и требует затрат кислорода, а соответственно и времени на его доставку. Окисление происходит в несколько этапов, сначала идет гликолиз, но образовавшиеся в ходе промежуточного этапа этой реакции две молекулы пирувата не преобразуются в молекулы молочной кислоты, а проникают в митохондрии, где окисляются в цикле Кребса до углекислого газа СО2 и воды Н2О и дают энергию для производства еще 38 молекул АТФ. Суммарное уравнение реакции окисления глюкозы выглядит так:
C6H12O6 + 6O2 + 38АДФ + 38H3PO4 = 6CO2 + 44H2O + 38АТФ
Распад глюкозы по аэробному пути (аэробный гликолиз) дает энергию для восстановления 38 молекул АТФ. Аэробное окисление в 19 раз эффективнее анаэробного гликолиза.
![]() Подробное описание в статье: Энергообеспечение мышечной деятельности
Подробное описание в статье: Энергообеспечение мышечной деятельности
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора[править | править код]

Рис. 18.1. Анаэробный гликолиз в эритроцитах

Рис. 18.2. Образование 2,3-бисфосфоглицерата в эритроцитах
Эритроциты транспортируют большое количество кислорода, которым снабжают все органы человека. По иронии судьбы сами они не могут использовать этот кислород. Источником энергии для эритроцитов служит глюкоза, при окислении которой в ходе анаэробного гликолиза в эритроцитах образуется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритроцитах невозможно, так как в них отсутствуют митохондрии и вместе с ними все ферменты цикла Кребса. Кроме того, в них отсутствуют также ферменты, необходимые для окисления жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем органам и тканям организма. Гемоглобин эритроцитов прочно связывается с кислородом, образуя оксигемоглобин. Однако в периферических тканях эритроциты должны отдать этот кислород другим клеткам. Это осуществляется благодаря явлению, известному под названием эффекта Бора. Эффект Бора создается благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2).
- Протоны вытесняют кислород из оксигемоглобина
Работающим мышцам необходим АТФ, и поэтому в них интенсивно функционирует цикл Кребса. В цикле Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту (эту реакцию катализирует карбоангидраза). Угольная кислота самопроизвольно диссоциирует, образуя бикарбонат и протон, что приводит к местному возрастанию концентрации протонов (Н+), т.е. понижению pH. Протоны высвобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Здесь он связывается с миоглобином и переносит кислород в дыхательную цепь, где он используется для синтеза АТФ путем окислительного фосфорилирования.
- Высвобождение кислорода в периферических тканях: 2,3-бисфосфоглицерат (2,3-БФГ) стабилизирует структуру дезоксигемоглобина. Помимо протонов, в создании эффекта Бора принимает участие 2,3-бисфосфоглицерат (2.3-БФГ) (рис. 18.2). В медицинской литературе распространено и другое название этого вещества — 2,3-дифосфоглицерат (2,3-ДФГ). 2.3-БФГ образуется в анаэробных условиях в эритроцитах. Процесс образования 2,3-БФГ происходит в дополнительной реакции гликолиза, получившей название
2,3-БФГ-шунта (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и стабилизирует его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина.
- Связывание гемоглобина с кислородом в легких. Эритроциты переносят дезоксигемоглобин и связанный с ним СО2 в легкие. Поскольку в легких имеет место высокое парциальное давление кислорода, он вытесняет С02 из гемоглобина, и С02 выходит из легких при выдохе. Кислород связывается с гемоглобином, образуя оксигемоглобин, 2,3-БФГ вытесняется, и эритроциты переносят к периферическим тканям следующую порцию кислорода.
2.3- БФГ в норме и при патологии[править | править код]
Эмбриональный гемоглобин имеет низкое сродство к 2,3-БФГ[править | править код]
Гемоглобин — тетрамер. состоящий из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин имеет иное строение: он состоит из двух а-цепей и двух у-цепей. По сравнению с нормальным гемоглобином взрослого человека, фетальный гемоглобин имеет более низкое сродство к 2,3-БФГ. Это значит, что сродство к кислороду у фетального гемоглобина выше, чем у гемоглобина материнского организма. Благодаря этому происходит транспорт кислорода от материнского организма к азолу.
2.3- БФГ и высотная адаптация[править | править код]
Предположим, что некий житель низин решил провести отпуск в горах. В первые дни отпуска даже незначительные физические нагрузки вызовут у него усталость и одышку. Но за несколько дней произойдет адаптация к высокогорью — в эритроцитах повысится концентрация 2,3-БФГ. Благодаря этому ткани станут получать кислород в достаточном количестве. несмотря на то что его концентрация в разреженном горном воздухе невысока.
Повышение концентрации 2,3-БФГ — ответная реакция организма на недостаток кислорода
У курящих лиц концентрация 2,3-БФГ в эритроцитах выше, чем у некурящих. Так организм компенсирует сниженное вследствие постоянного воздействия угарного газа обеспечение тканей кислородом. Компенсаторное повышение уровня 2.3- БФГ также часто наблюдается у больных хроническими анемиями, обструктивной болезнью легких, при врожденных пороках сердца и муковисцидозе.
Энзимопатии гликолитического пути в эритроцитах[править | править код]
В редких случаях из-за врожденной недостаточности гликолитических ферментов в эритроцитах развивается наследственная несфероцитарная гемолитическая анемия. Это заболевание может быть весьма тяжелым, поскольку в эритроцитах гликолиз — единственный путь синтеза и АТФ и 2.3-БФГ.
Нарушения гликолитического ферментативного аппарата могут по-разному сказываться на метаболизме 2.3-БФГ (рис. 18.2). Если нарушение расположено проксимально по отношению к 2.3-БФГ-шунту (например, при недостаточности гексокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет снижен, так как будет снижена интенсивность синтеза его предшественников. Если же нарушение расположено после 2.3-БФГ-шунта (например, недостаточность пируваткиназы). концентрация 2.3-БФГ в эритроцитах будет повышена.
Кроме того, у ряда больных была обнаружена недостаточность бифункционального фермента шунта — БФГ-мутазы/2,3-БФГ-фосфагазы. У таких больных концентрация 2.3- БФГ была низкой.
Номенклатура альдолаз[править | править код]
Чтобы учащийся не путал разные термины, необходимо разобраться в номенклатуре альдолаз. Альдолаза (полное название — фруктозо-1,6-бисфосфат-атьдолаза) по официальной номенклатуре называется D-глицеральдегид-З-фосфатлиазой (КФ 4.1.2.13). Она выполняет три функции:
- катализирует реакцию конденсации дигидрокснацетон-фосфата и глицеральдегид-З-фосфата. Продукт этой реакции — фруктозо-1,6-бисфосфат;
- катализирует расщепление фруктозо-1,6-бисфосфата на лигилроксиацетонфосфат и минеральдегид-3-фосфат;
- катализирует расщепление других, структурно близких фосфатов сахаров. Так. альдолаза катализирует расщепление фруктозо-1-фосфата на дигидроксиацетонфосфат и глицеральдегид (примечание: раньше фермент, выполняющий эту функцию, называли кетозо-1-фосфат-альдолазой. КФ 4.1.2.7).
У животных обнаружены три формы альдолазы.
Альдолаза А. Содержится в эритроцитах и мышцах. При наследственной гемолитической анемии в крови содержится дефектная форма альдолазы А.
Альдолаза В. Недостаточность альдолазы В приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике.
Альдолаза С. Содержится в головном мозге.
Взаимосвязь гликолиза и аэробных реакций[править | править код]
Два способа оценки аэробных возможностей организма (прямая оценка показателя максимального устойчивого состояния по лактату и косвенная оценка аэробно-анаэробного перехода) основаны на классической теории активации гликолиза, предложенной А. Хиллом. В основу этой теории легла гипотеза о том, что активация гликолиза в мышечном волокне запускается при снижении аэробного ресинтеза АТФ. Основной причиной снижения аэробного ресинтеза АТФ должно быть неадекватное снабжение клетки кислородом, т.е. фактически снижение внутриклеточного парциального давления кислорода до критического уровня (0,1—0,5 мм рт. ст.), ниже которого нормальное функционирование митохондрий невозможно. Прямо проверить данное предположение оказалось методически достаточно сложно.
Относительно недавно появились исследования, в которых in situ было измерено внутримышечное парциальное давление кислорода, связанного с миоглобином, во время максимального теста с возрастающей нагрузкой в т. gracilis у собаки методом криомикроспектроскопии. Среднее парциальное давление кислорода, связанного с миоглобином, при работе на уровне МПК значительно выше критического и составляет 5,5 мм рт. ст., при этом не удается обнаружить связь между ПК мышцей или средним парциальным давлением кислорода в волокне и концентрацией лактата в мышце или суммарным выходом лактата из мышцы.
Сходные результаты получены при измерении внутримышечного парциального давления кислорода во время максимального теста с повышающейся нагрузкой (50-100% от пикового ПК) у тренированных велосипедистов в условиях in vivo при разгибании ноги в коленном суставе. Исследователи получили достаточно неожиданный результат. Оказалось, что парциальное давление кислорода в миоглобине не изменяется на протяжении всего теста с возрастающей нагрузкой (50—100% от пикового ПК) вплоть до отказа от работы. Среднее парциальное давление кислорода, связанного с миоглобином, составляет 3,1 мм рт. ст. Любопытно, при работе в гипоксических условиях (F,02—0,12) парциальное давление кислорода, связанного с миоглобином, оказывается достоверно ниже, чем в нормоксии и составляет 2,1 мм рт. ст. Оно также не изменяется во всем диапазоне нагрузок (50~100% от пикового ПК). При этом потребление кислорода тканями рабочей ноги, измеренное с помощью прямого метода (по Фику), линейно растет вплоть до отказа от работы, как в гипоксических, так и в нормоксических условиях.
Таким образом, даже при гипоксии во время максимальной нагрузки парциальное давление кислорода в миоглобине не падает ниже критического уровня. Однако при этом наблюдается увеличение скорости суммарного выхода лактата из рабочей мышцы, измеренное с помощью прямого метода. Причем работа в условиях гипоксии приводила к значительно более интенсивному выходу лактата (относительно нормированной мощности работы), чем работа в нормоксических условиях. На основании этих данных можно сделать вывод о том, что парциальное напряжение кислорода в активной мышечной клетке не является ключевым фактором, активирующим гликолиз. В то же время опыты с гипоксией дают основание полагать, что парциальное давление кислорода в цитоплазме может модулировать активность гликолиза. Увеличение суммарного выхода лактата из мышцы, как в условиях нормоксии, так и в условиях гипоксии, регулируется, главным образом, активацией симпато-адреналовой системы. Это подтверждается сходной динамикой концентрации адреналина в артериальной крови и суммарного выхода лактата из рабочей мышцы. Влияние симпато-адреналовой системы на гликолиз подтверждается и рядом других работ, в которых исследовали изменения концентрации катехоламинов во время нагрузки, а также опытами с применением бета-блокаторов.
Среди других возможных кандидатов на роль активаторов гликолиза выделяют: АДФ, АМФ, неорганический фосфат, отношение креатин/фосфокреатин и цитоплазматический окислительно-востановительный потенциал (НАДН+/НАД+).
Суммируя результаты описанных исследований, можно сказать, что парциальное давление кислорода в цитоплазме мышечной клетки не опускается до критичного уровня даже при работе максимальной аэробной мощности. Это означает, что активность гликолиза в мышечном волокне во время работы не зависит от скорости аэробного ресинтеза АТФ или, по крайней мере, зависит не только от нее.
Читайте также[править | править код]
- Регуляция гликолиза и цикл Кребса
- Регуляция активности ферментов
- Окисление жирных кислот
- Анаэробное окисление глюкозы
- Аэробное окисление глюкозы
