Какие продукты могут образоваться при реакции метана с хлором
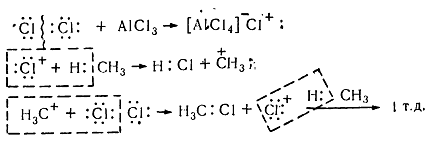
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
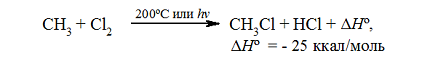
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
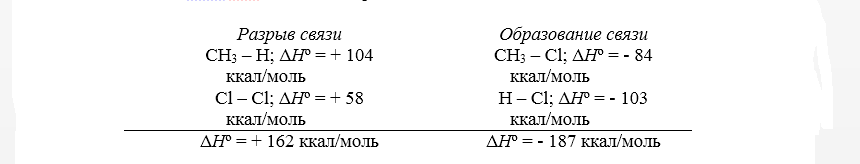
Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = — 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
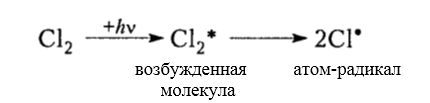
Рисунок 3. Хлорирование метана
рост цепи
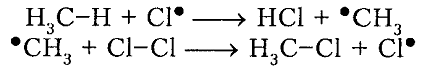
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
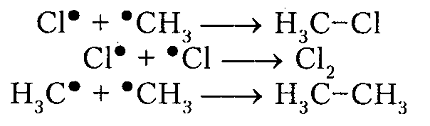
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
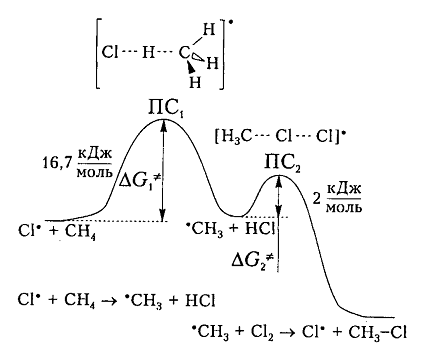
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи — связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах — плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
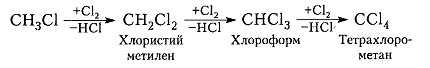
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
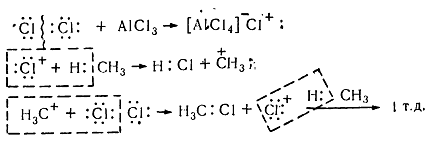
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Радикальный механизм хлорирования метана
Закономерности радикального хлорирования метана
Ионный механизм хлорирования метана
Одной из характерных особенностей насыщенных углеводородов является их способность активно вступать в реакцию с таким химическим элементом как хлор. Молекулярный хлор обладает невысокой способностью вступать в реакцию с алканами, поэтому они хлорируются катионами или атомами хлора, обладающими большей активностью. Для осуществления процесса распада хлорной молекулы на атомы необходимо затратить энергию, составляющую 242,8 кДж/моль. Подобная диссоциация может быть легко проведена при обычных температурных условиях под воздействием ультрафиолетового света. В ходе процесса молекула хлора, поглощая ультрафиолет, получает энергию в 293,0 кДж/моль. Реализация термической диссоциации хлорной молекулы на атомы должна происходить в условиях достаточно высоких температур — около 300ºC. Затраты энергии на диссоциацию молекулы для получения ионов хлора составляют порядка 1130,2 кДж/моль. Анализируя энергетические показатели разнообразных вариантов хлорирования можно сделать вывод о том, что наиболее предпочтительным способом хлорирования насыщенных углеводородов является процесс, проводимый на свету.
Процесс хлорирования алканов по сравнению с фторированием представляет собой процесс менее экзотермический, сопровождаемый выделением теплоты в количестве 108,8 кДж/моль. Осуществление хлорирования алканов фотохимическим способом проходит с применением рассеянного света, по причине того, что воздействие прямого света при проведении реакции приводит к взрыву. В ходе реакции хлорирования происходит постепенное замещение в алканах атомами хлора атомов водорода. Для реакций данного вида характерно образование в их результате хлорпроизводных насыщенных углеводородов.
Таким образом, нагревая до 200ºC смесь метана и хлора или подвергая её воздействию ультрафиолетового света, обладающего длиной волны подходящей величины, запускается реакция, сопровождаемая достаточно сильным выделением теплоты:
Для расчёта теплового эффекта, получаемого в ходе хлорирования метана, находящегося в газовой фазе, на первой стадии до состояния CH3Cl и HCl применяется закон Гесса.
Величина суммарного теплового эффекта ∆Hº равна 25 ккал/моль. Рассматриваемые показатели позволяют сделать вывод о полной вероятности проведения процесса хлорирования метана, причём сопровождающий реакцию тепловой эффект никак не связан со скоростью её протекания, определяемой количеством свободной энергии активации.
Радикальный механизм хлорирования метана
Осуществление реакции хлорирования метана, сопровождаемой нагревом и облучением, а также участием в ней инициаторов, способствующих образованию радикалов, реализует механизм радикально-цепного типа SR (Семенов), состоящий из следующих трёх базовых стадий:
инициирования цепи, или её зарождения
рост цепи
рекомбинация или обрыв цепи
Под воздействием света (hv) или под воздействием температуры молекула хлора Cl2 обретает избыточную энергию и переходит в возбуждённое состояние, которое заканчивается её распадом на два атома, являющиеся по своей природе радикалами. Взаимодействие или столкновение атома-радикала хлора с другими молекулами метана CH4 приводит к отщеплению от них водородных атомов, при котором образуется метильный радикал ●CH3. В свою очередь он отщепляет от следующей молекулы атом хлора Cl2 и т.д. Образование одного радикала, таким образом, инициирует многократное повторение стадии, при которой растёт цепь. Для протекающей реакции длина кинетической цепи определяется в соответствии с количеством подобных повторений. Для процесса хлорирования число повторений может достигать 10 и более тысяч.
Энергетическая диаграмма взаимодействия метановой молекулы и атома хлора изображена на рисунке.
Закономерности радикального хлорирования метана
Согласно общетеоретическим положениям, взаимодействие атомов хлора и молекулы метана будет происходить исключительно в случае равенства их свободной энергии величине энергии активации (или энергетического барьера), составляющего 16,7 кДж/моль. Сама по себе свободная энергия, как правило, немного больше простой разницы между энергией разрыва существующей в молекуле связи C–H (+425 кДж/моль), и образования связи нового вида H-Cl (-431 кДж/моль), которая составляет -6 кДж/моль. По этой причине взаимодействие реагирующих частиц запускается не каждым столкновением между ними, а только обладающими достаточной энергией для преодоления барьера.
Возникновение дополнительной активационной энергии связано с нагревом либо облучением молекул. В возбуждённом состоянии молекулы движутся с достаточно высокой скоростью, что позволяет при столкновении превратить их кинетическую энергию в энергию потенциальную. В переходном состоянии ПС1, соответствующем первой вершине кривой энергетической диаграммы, практически одновременно происходят разрыв старых связей C-H и образование связей нового вида H-Cl в активированном комплексе, который сформировался. Метильный радикал, образуемый в ходе реакции, обладает достаточной потенциальной энергией и впоследствии взаимодействует с молекулой хлора Cl2 сравнительно легко. Энергия, необходимая для активации данной стадии относительно не высока и составляет всего 2 кДж/моль. Окончательное образование соединения CH3Cl осуществляется в находящемся в переходном состоянии ПС2 активированном комплексе, сформировавшемся повторно.
Процесс хлорирования алканов и метана в частности, протекающий при температурах такой величины, представляет собой процесс, плохо поддающийся управлению. Обычно он не прекращается на стадии формирования соединения хлористого метила CH3Cl и способен протекать далее с получением промежуточных соединений – хлористого метилена, хлороформа и тетрахлорометана.
Ионный механизм хлорирования метана
Реакция хлорирования, осуществляемая в кислой среде в присутствии способствующих её протеканию по ионному механизму катализаторов (ими обычно являются кислоты Льюиса SbF5, AlCl3), обладает электрофильным характером (Se). Сущность процесса реагирования молекулы хлора с электроноакцепторного хлорида алюминия, в химическом плане, состоит в значительной поляризации связи C-C, являющейся до этого неполярной, приводящей к образованию электрофильного агента после её диссоциации. При отсутствии катализаторов хлорирование, происходящее по ионному механизму, практически не может осуществляться, по причине того, что для гетеролитического расщепления на анион и катион молекулы хлора необходима значительная энергия – порядка 1130 кДж/моль.
Цепной ионный электрофильный механизм (Se), по которому осуществляется хлорирование в присутствии катализаторов насыщенных углеводородов, изображен на рисунке:
Под воздействием катализатора происходит гетеролитический распад молекулы хлора, сопровождаясь возникновением ионной комплексной пары [AlCl4] – Cl +, из-за того, что алюминий соединён с атомами хлора, имеющими отрицательный электрический заряд, и нуждается в электронах. По этой причине алюминием от атома хлора Cl2 отщепляется пара электронов, сопровождаясь одновременным образованием катиона хлора, взаимодействующего впоследствии с молекулой метана гетеролитично разрывая связь C-H. Результатом данного процесса является образование метильного карбкатиона, который затем реагирует с хлорной молекулой, образуя, в конце концов, хлористый метил и катион хлора, взаимодействующий впоследствии со следующей молекулой. Ионные реакции, у которых промежуточными частицами являются ионы с положительным зарядом, имеют название реакций электрофильных.
По причине того, что для диссоциации хлорных молекул на ионы необходима значительная энергия, хлорирование углеводородов в насыщенном состоянии в присутствии катализаторов должно сопровождаться нагревом реакционной смеси.
Анонимный вопрос · 28 мая 2018
1,7 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????хлорирование метана????
❗️Это реакция радикального замещения
❗️Метан-это алкан,формула которого СН4
❗️Хлор-галоген,молекулярная формула которого Сl2
❗️Для данной реакции необходим квант света hv
D6B2EA2F-B3C4-4122-BC6D-79A1EFE217B2.jpeg Читать далее
Что характерно для метана?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????метан????
❗️формула СН4
❗️Физические свойства:
-газ
-без цвета ,запаха
❗️химические свойства:
-хлорирование
СН4+Cl2➡️CH3Cl+HCl
-нитрование
СН4+HNO3➡️CH3NO2+H2O
-конверсия
СН4+Н2О➡️СО+3Н2
-окисление
СН4+2О2➡️СО2+2Н2О
Прочитать ещё 1 ответ
Какие свойства имеет «Бутен 1»?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
Бутен-1 — это ????газообразное вещество(все алкены, имеющие от 1 до 4 атомов С, газы????)
????смесь с воздухом очень взрывоопасна????
????очень сильный наркотик????
????в Н2О нерастворим, но хорошо растворяется в полярных растворителях (например, бензоле)
Теперь химические свойства????
????Как и все органические соединения, Бутен-1 горит????
C4H8+6O2=4CO2+4H2O
????Вступает в реакции присоединения, т. к. у него есть двойная связь, которая потом разрывается????Бутен-1 присоединяет
????Н2, каждый атом водорода выбирает себе пару среди углеродов в двойной связи???? Реакция идёт при 400 градусах и катализаторе(например, Ni)
СН2=СН-СН2-СН3+Н2->
СН3-СН2-СН2-СН3 (получился бутан)
????Галогены. Ведут себя так же, как и Н2) Раствор Br2 при реакции с бутеном-1(да и со всеми алкенами????) обесцвечивается. Только пару себе находят атомы брома????
СН2=СН-СН2-СН3+Br2->
CH2Br-CHBr-CH2-CH3(1,2-дибромбутан)
????Водичка и галогеноводороды. присоединяются по правилу Маркрвникова: атом Н идёт к тому атому С, у которого больше водородов????
СН2=СН-СН2-СН3+Н2О->
СН3-СН(ОН)-СН2-СН3(спирт бутанол-2)
Водород идёт к -СН2, потому что у этого атома С больше водородов, его друзей????
СН2=СН-СН2-СН3+НBr->
CH3-CHBr-СН2-СН3(2-бромбутан)
???? У бутена-1 есть свои окислительно-восстановительные реакции????
Он обесцвечивает не только бромную воду, но и раствор КМnO4
????Реакция возможна в нейтральной среде(к КMnO4 просто добавляем воду)
СН2=СН-СН2-СН3+КMnO4+H2O->CH2(OH) — CH(OH) — CH2-CH3+KOH+MnO2⬇️
Получается многоатомный спирт — гликоль и выпадает бурый осадок MnO2
????В кислой среде (КМnO4+H2SO4)
-СН2 переходит в СО2
-СН3-СН2-СН в СН3-СН2-СООН
(если это не очень понятно, то можешь посмотреть это вебинар
https://vk.com/video-76732610_456239087????)
СН2=СН-СН2-СН3+KMnO4+H2SO4->MnSO4+K2SO4+CO2⬆️+CH3COOH+
H2O
Вроде всё, если есть вопросы задавай)
Прочитать ещё 4 ответа
Как из водорода получить метан?
Водород может получаться при сильном нагревании метана.
Поэтому в промышленности большое количество водорода получают именно из метана, добавляя к нему при высокой температуре перегретый водяной пар:
1) CH4 + H2O = CO + 3 H2
2) CO + H2O = CO2 + H2
В сумме этот процесс можно записать уравнением:
CH4 + 2 H2O = 4 H2 + CO2
Какие вещества реагируют с ацетиленом?
Вернее будет рассматривать вопрос с пункту «с чем реагирует сам ацетилен».
Например, он вступает хорошо в реакции присоединения с хлором. С водой образуется уксусный ангидрид при определенных условиях. Вступает в реакцию с самим собой — полимеризуется.
Собственно веществ очень много, главное отличительной способностью является возможность присоединения по связи.
Что используют в органике для обнаружения хлора?
Долгое время работала воспитателем детского сада, многое знаю о работе с детьми…
Опыт. Качественное определение хлора в молекулах галогенопроизводных углеводородов
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
Прочитать ещё 1 ответ
Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра Общей Химической Технологии
Реферат
по курсу: Технология химических производств
на тему:
Хлорирование метана
Казань 2008
Содержание
Хлорирование метана
Технологические и технико-экономические показатели
Реклама
Список литературы
Хлорирование метана
Процесс совместного получения хлорметанов можно осуществлять в реакторе со стационарным илипсевдоожиженным слоем катализатора. Вторая технология более перспективна, она включает следующие стадии: хлорирование в псевдоожиженном слое катализатора; пылеулавливание и отпаривание газов кислотного характера; абсорбция хлороводорода; нейтрализация и осушка рециркулирующего реакционного газа; компримироваиие рециркулирующих газов; ректификация хлорметанов с выделением товарных продуктов.
Хлор и метан подают в реактор в соотношении от 1: 2 до 3,88: 1 в зависимости от того, какое хлорпроизводное желательно получить. Например, при соотношении С12: СН4-1: 2 образуется продукт, содержащий [п% (мол)]: СН3С1 — 62; СН2С12 — 30; СНС13 — 7; СС14 — 1; при соотношении С12: СН4 = 3,88: 1 образуется продукт, содержащий только 4% (мол) СНС13 и 96% (мол) СС14.
Метан и хлор поступают в реактор 1 с псевдоожиженным слоем катализатора. Реактор выполнен из хромоникелевоп стали.
Хлорирование ведут; при 350 °С и атмосферном давлении, время контакта 0,1-20 с. Реакционная смесь проходит систему пылеулавливания (циклон 2) и поступает на нейтрализацию в колонну 3, где отпариваются кислые газы. После этой колонны продукты реакции промывают водой в скруббере 6; при этом получается товарная соляная кислота. Далее газы нейтрализуют раствором щелочи в скруббере 7 и осушают серной кислотой в скруббере 8.
Нейтрализованные газы, содержащие в основном метан и метилхлорид, компримируют и возвращают в реактор на хлорирование. Конденсат после отпаривания кислых газов поступает на ректификацию в колонны 10, 12 и 13, в которых последовательно выделяют метиленхлорид, хлороформ и тетрахлорид углерода.
Для удалении инертных примесей часть реакционного газа после компрессора 9 и скруббера 6 выводят в атмосферу (на схеме не показано). Расход основного сырья на 1 т готового продукта составляет 133 кг метана и 1784 кг хлора.
В процессе на 1 т хлороформа образуется 0,9 т метиленхлорида и 0,5 т тетрахлорида углерода. Кубовые остатки (в основном со стадии ректификации) в количестве 0,01 т на 1 т хлороформа направляют па установку термического обезвреживания. В процессе образуется соляная кислота (примерно 1 т па 1 т хлороформа), которую после очистки от хлорорганических примесей можно применять вместо синтетической. Отработанную серную кислоту (0,1 т на 1 т хлороформа) передают на производство сульфата натрия.
Задание:
Составить и описать технологическую схему процесса хлорирование метана
Составить материальный баланс процесса
Рассчитать технологические технико-экономические показатели
В основу расчета принять следующие реакции:
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl2+HCl
CHCl3+Cl2→CCl4+HCl
Исходные данные:
Материальный баланс. Схема потоков:
CH4; Cl2; природный газ; CH3Cl; CH2Cl2; CHCl3; CCl4; CH4;
примесь Cl2 Cl2; прир. газ; примесь Cl2; HCl
Молярные массы веществ:
Mr (CH4) = 12+4=16 кг/кмоль
Mr (Cl2) = 35,45*2=70,9 кг/кмоль
Mr (CH3Cl) = 12+3+35,45=50,45 кг/кмоль
Mr (CH2Cl2) = 12+2+35,45*2=84,9 кг/кмоль
Mr (CHCl3) = 12+1+35,45*3=119,35 кг/кмоль
Mr (CCl4) = 12+35,45*4=153,8 кг/кмоль
Mr (HCl) = 1+35,45=36,45 кг/кмоль.
1. m (прод) = 60*1000/24=2500кг/ч
2. Найдем массовый процентный состав продуктов:
на 100 моль смеси:
32 моль CH4m=32*16=512кг/ч
18 моль CH3Clm = 18*50,45=908,1 кг/ч
25 моль CH2Cl2 m = 25*84,9=2122,5 кг/ч
20 моль CHCl3 m = 20*119,35=2387 кг/ч
5 моль CCl4 m = 5*153,8=769 кг/ч
всего: 6698,6 кг/ч
Wмас (СН4) = 512/6698,6*100% = 7,64%
Wмас (СН3Cl) = 908,1/6698,6*100% = 13,56%
Wмас (CH2Cl2) = 2122,5/6698,6*100% = 31,69%
Wмас (CHCl3) = 2387/6698,6*100% = 35,63%
Wмас (CCl4) = 769/6698,6*100% = 11,48%
Состав продуктов:
mост (СН4) =2500*0,0764=191кг/ч
m (СН3Cl) =2500*0,1356=339кг/ч
m (CH2Cl2) =2500*0,3169=792,25кг/ч
m (CHCl3) =2500*0,3563=890,75кг/ч
m (CCl4) =2500*0,1148=287кг/ч
Wост (СН4) =191/16=11,94кмоль/час
W (СН3Cl) = 339/50,45=6,72кмоль/час
W (CH2Cl2) = 792,25/84,9=9,33кмоль/час
W (CHCl3) = 890,75/119,35=7,46кмоль/час
W (CCl4) = 287/153,8=1,87кмоль/час
Прореагировало хлороформа: Wпр (CHCl3) = W (CCl4) = 1.87 кмоль/ч
Образовалось хлороформа: Wо (CHCl3) = Wпр + W = 1.87 + 7.46 = 9.33 кмоль/ч.
Прореагировало хлористого метилена: Wпр (CH2Cl2) = Wо (CHCl3) = 9.33 кмоль/ч.
Образовалось хлористого метилена: Wо (CH2Cl2) = Wпр + W = 18.66 кмоль/ч
Прореагировало хлористого метила: Wо (CH2Cl2) = Wо (CH2Cl2) = 18.66 кмоль/ч.
Образовалось хлористого метила: Wо (CH2Cl2) = Wпр + W = 18.66 + 6.72 = 25.38 кмоль/ч.
Прореагировало метана: Wпр (СН4) = 25.38 кмоль/ч
Всего подано на реакцию: W (СН4) = Wпр + Wо = 25.38 + 11.94 = 37.32
mо (СН4) = 37.32 * 16 = 597.12
Всего подано метана с учетом потерь: mвсего (СН4) — 100%,
597.12 — 98.7%
mвсего (СН4) = 597.12 * 100/ 98.7 = 604.88 кг/ч
W (СН4) = 604.88/16 = 37.81 кмоь/ч
mп (СН4) = 604.88 — 597.12 = 7.76 кг/ч
W (СН4) = 7.76,16 = 0.485 кмоь/ч
Количество превращенного кислорода и образовавшегося HCl:
1 р — я:
W1 (Cl2) = W1 (HCl) = Wо (СН3Cl) = 25.38 кмоль/ч
2 р — я:
W2 (Cl2) = W2 (HCl) = Wо (CH2Cl2) = 18.66 кмоль/ч, 3 р — я:
W3 (Cl2) = W3 (HCl) = Wо (CHCl3) = 9.33 кмоль, 4 р — я:
W4 (Cl2) = W4 (HCl) = W (CCl4) = 1.87 кмоь/ч
Wо (Cl2) = W3 (HCl) = 55.24 кмоль/ч
m о (Cl2) =55.24 * 70.9 = 3916.52 кг/ч
m о (HCl) = 55.24 * 36.45 = 2013.5 кг/ч
Хлор с учетом избытка:
Wвсего (Cl2) = 2.6 * Wвсего (СН4) = 98.306 кмоль/ч
mвсего (Cl2) = 98.306 * 70.9 = 6969.9 кг/ч
Избыток:
mизб (Cl2) = mвсего (Cl2) — mо (О2) = 6969.9 — 3916.52 = 3053.38 кг/ч
Wизб (Cl2) = 3053.38/70.9 = 43.07 кмоль/ч
Подано природного газа (примесь метана):
604.88 — 93%
х — 7%
х = m (пр. газ) = 604.88 * 7/93 = 45.53 кг/ч
Подано примесей хлора:
6969.9 — 98.5%
х — 1.5%
х = mприм (Cl2) = 6969.9 * 1.5/98.5 = 106.14
Технологические и технико-экономические показатели
Пропускная способность установки:
m (CH4) + m (Cl2) + m (прим Cl2) + (прим CH4) = 7726,45 кг/ч
Конверсия или степень превращения метана:
= M (CH4) подано — M (CH4) непрореагировало / M (CH4) подано * 100%
= 604,88 — 198,76/604,88* 100% = 67%
Теоретические расходные коэффициенты:
по СН4:
sтСН4 = Mr (CH4) / Mr (CH3Cl) = 16/50,45 = 0,317 кг/кг;
sтСН4 = Mr (CH4) / Mr (CH2Cl2) = 16/84,9 = 0,188 кг/кг;
sтСН4 = Mr (CH4) / Mr (CHCl3) = 16/119,35 = 0,134 кг/кг;
sтСН4 = Mr (CH4) / Mr (CCl4) = 16/153,8 = 0,104 кг/кг;
по Cl2:
sт Cl2 = Mr (Cl2) / Mr (CH3Cl) = 70,9/50,45 = 1,405 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CH2Cl2) = 70,9/84,9 = 0,835 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CHCl3) = 70,9/119,35 = 0,594 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CCl4) = 70,9/153,8 = 0,461 кг/кг.
Фактические расходные коэффициенты:
по СН4:
sфСН4 = m (CH4) / m (CH3Cl) = 604,88/339 = 1,78 кг/кг;
sфСН4 = m (CH4) / m (CH2Cl2) = 604,88/792,25 = 0,764 кг/кг;
sфСН4 = m (CH4) / m (CHCl3) = 604,88/890,75 = 0,679 кг/кг;
sфСН4 = m (CH4) / m (CCl4) = 604,88/287 = 2,108 кг/кг;
по Cl2:
sфCl2= m (Cl2) / m (CH3Cl) = 6969,9/339 = 20.56 кг/кг.
sфCl2= m (Cl2) / m (CH2Cl2) = 6969,9/792,25 = 8,798 кг/кг.
sфCl2= m (Cl2) / m (CHCl3) = 6969,9/890,75 = 7,825 кг/кг.
sфCl2= m (Cl2) / m (CCl4) = 6969,9/287 = 24,285 кг/кг.
Выход на поданное сырье:
Фактический выход CCl4:
QФ = m (CCl4) = 287 кг;
Теоретический выход CCl4:
