Какие оксиды проявляют амфотерные свойства

Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]

4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Тема № 10.
Химические свойства оксидов: основных, амфотерных, кислотных
Рекомендуемые видеоуроки
Теоретические сведения
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом
Номенклатура оксидов
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
Классификация оксидов
По химическим свойствам оксиды делятся на две группы:
1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;
2. Солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
Основным оксидам соответствуют основания.
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Химические свойства основных оксидов
1. Основные оксиды взаимодействуют с водой с образованием оснований.
Условие протекания реакции: должны образовываться растворимые основания!
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2→ CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 → Сa(AlO2)2
Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
Химические свойства кислотных оксидов
1. Взаимодействие с водой с образованием кислоты:
Условия протекания реакции: должна образовываться растворимая кислота.
P2O5 + 3H2O → 2H3PO4
2. Взаимодействие со щелочами с образованием соли и воды:
Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание.
SO3 + 2NaOH → Na2SO4 + H2O
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4
Амфотерные оксиды
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Химические свойства амфотерных оксидов
1. C водой не взаимодействуют
2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства):
ZnO + SiO2 → ZnSiO3
3. Взаимодействие с кислотами с образованием соли и воды (основные свойства):
ZnO + H2SO4 → ZnSO4 + H2O
4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства):
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2NaOH → 2NaAlO2 + H2O
5. Взаимодействие с основными оксидами (кислотные свойства):
Al2O3 + CaO → Ca(AlO2)2
Интернет-источники
Анонимный вопрос · 30 мая 2019
30,4 K
Амфотерными называются элементы, которые в соединениях проявляют свойства металлов и неметаллов. К ним относятся элементы А-групп Периодической системы — Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп — Cr, Mn, Fe, Zn, Cd, Au и др.
Оксиды и гидроксиды этих соединений, соотвественно, будут амфотерными.
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Амфотерные оксиды — это оксиды, у которых элемент в степени окисления +3 или +4
Например, Al2O3, ТiO2, Cr2O3, Fe2O3, PbO2
☘️Но☝️
ZnO, BeO тоже амфотерные, хотя Zn и Be в степени окисления +2. Это нужно запомнить)
☘️Гидроксиды, которые соответствуют амфотерными оксидам, тоже амофотерны ????
Эффективный репетитор по математике, физике, химии. Автор книг и консультант по обучению… · repetitor-5.ru
Из #викивпечку : Амфоте́рность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Похожее слово есть в биологии: «амфибия» — животное, которое может жить и в воде, и на суше. Амфи — и тот, и другой, био — жизнь. Живёт и там, и тут.
Амфотер… Читать далее
Почему оксиды имеют разный характер и от чего это зависит?
Химия, кулинария, математика.
Характер оксида зависит от элемента оксида. Если это оксид металла, то это основный оксид ( пример Al2O3 ), если это оксид не металла, то это кислотный оксид ( пример NO2), если степень окисления переходит, то это амфотерный оксид ( пример ZnO ), еще существуют несолеобразующие оксиды ( пример NO ).
Что такое «оляция» и «оксоляция»?
Researcher, Institute of Physics, University of Tartu
Возьмем обычный гидроксид. Ну, скажем, гидроксид титана или ортотитановая кислота, кому как нравится. Формула Ti(OH)4. Т.е. условная молекула этого соединения содержит четыре ОН-группы, присоединенные к атому титана. Каждая из этих ОН-групп присоединена к титану так: Ti-OH. Это обычный вариант, обычная концевая («терминальная») ОН-группа, которая присоединена сигма-связью только к одному атому, как ей и положено.
Однако, у кислорода есть неподеленная электронная пара, которая может «сесть» на чью-нибудь незаполненную орбиталь по донорно-акцепторному механизму, а у титана есть куда ей сесть. При этом происходит образование мостиковой ОН-группы между двумя молекулами гидроксида титана (т.е. ОН-группа уже была по обычной сигма-связи соеденина с одним атомом титана, а теперь присоединилась неподеленной парой к еще одному. Выглядит это так: (HO)3Ti-O(H)-Ti(OH)4 . При этом мы видим, что мостиковый кислород имеет три связи, а один из атомов титана — пять. Такая мостиковая ОН-группа называется «ол-группа«, а процесс ее образования, которыя я описал выше — оляцией.
Это структура с формально трехвалентным кислородом и пятивалентным титаном является неустойчивой и довольно быстро переходит в более удобоваримую структуру с мостиковым атомом кислорода: (HO)3Ti-O(H)-Ti(OH)4 -> (HO)3Ti-O-Ti(OH)3 + H2O. Теперь, как мы видим, у всех всё в порядке — кислород двухвалентный, оба титана четырехвалентны, всё как обычно. Этот процесс называется оксоляцией, поскольку ол-группа превращается в мостиковую оксо-группу (-O-). Можно заметить, что отщепилась молекула воды и гидроксид как бы стал на шажок ближе к оксиду. Это будет совершенно справедливое замечание, поскольку конечным результатом оксоляции (далеко не всегда достигаемым, конечно) и будет оксид, у которого ОН-группы остались только на поверхности.
Процессы оляции-оксоляции характерны для амфотерных гидроксидов, а также для слабых кислот и оснований. Обычно происходят после их образования в результате гидролиза, то есть сначала из какой-то соли в результате гидролиза получается гидроксид чего-то, а потом постепенно он претерпевает процессы оляции-оксоляции, при этом из индивидуальных молекул этого гидроксида с одним центральным атомом получаются многоатомные (конденсированные) оксо-гидроксосоединения (это называют поликонденсацией). Именно в связи с этим процессом свежеосажденные гидроксиды гораздо более реакционно способны, чем состарившиеся. У преподавателей есть садистический эксперимент для первокурсников или старших школьников — всем известно, что гидроксид алюминия растворяется в избытке щелочи. Так вот надо аккуратно осадить его, потом оставить на некоторое время, а потом попросить студента растворить его в NaOH. Если студент не в курсе дела, то он будет его растворять до позеленения и навсегда потом запомнит, что такое оляция-оксоляция 🙂
Какие оксиды реагируют с водой?
С водой будут взаимодействовать кислотные и основные оксиды. Кислотные оксиды при взаимодействии с водой будут образовывать кислоты. Из основных оксидов с водой взаимодействуют оксиды щелочных и щелочно-земельных металлов.
Какая структурная формула оловянистой кислоты (H2SnO2)?
ALBA synchrotron, postdoc
Sn(OH)2 в свободном виде не существует. Бывает либо гель гидрата неопределённого состава, либо оксогидроксид Sn6O4(OH)4. Он состоит из кластеров состава Sn6O8, соединенных между собой водородными связями (на картинке не показаны).
В чём роль антиоксидантов для организма? Только ли лишь для нейтрализации свободных радикалов? или чего то ещё?
Да, антиоксиданты нужны только для нейтрализации свободных радикалов и активных форм кислорода. Но нет, это не мелочь — это очень важно. Это важно настолько, что исследования показывают: для здоровья очень опасно не только понижение концентрации антиоксидантов ниже физиологической нормы, но и её превышение. Разберём по порядку.
Органические вещества имеют свойство окисляться: окисляются углеводы, жиры, спирты, кислоты. В их окислении организм черпает энергию. Обратимся к схеме дыхательной цепи:
- В правом нижнем углу из кислорода появляются активные формы кислорода, благодаря появлению которых синтезируется АТФ. Из школьного курса биологии мы знаем, что АТФ, то есть аденозинтрифосфат — молекула, несущая три остатка фосфорной кислоты, связи между которыми несут большую энергию, разрыв которых передаёт её на осуществление биохимических реакций. АТФ — это своеобразное топливо для двигателя внутреннего сгорания, которое и не будет сгорать без посредства кислорода. Именно благодаря кислороду окисляются названные выше вещества и именно их окисление питает организм АТФ.
- В левом нижнем углу НАД+ превращается в НАДH2 (читается как над аш два) в цикле трикарбоновых кислот (и других биохимических локациях организма) — центральном биореакторе, перераспределяющем энергию и вещества по реакциям в организме, — а затем обратно из НАДH2 в НАД+. НАД — это своеобразное машинное масло. Если бы в правом нижнем углу не было кислорода и не синтезировался АТФ, этот конвейер переполнился, движение остановилось, и НАДH2 перестал превращаться обратно в НАД+, таким образом остановив и центральный биореактор.
Как мы видим из всё той же схемы, в дыхательной цепи участвует молекулярный кислород и его активная форма, которая, однако, может и высвобождаться из этой цепи. Кроме того, кислород и его активные формы участвуют в окислении многих веществ, в процессе окисления которых лавинообразным каскадом (со всё нарастающими объёмом и скоростью) образуются свободные радикалы этих окисляемых веществ, которые продолжают окислять неокисленные вещества, тем самым и наращивая эту окислительную лавину. Здесь-то на арену и выходят антиоксиданты — своеобразный щит от лавины окисления. Если бы антиоксидантов не было, все вещества нашего организма окислились без остатка, поскольку ничто бы не регулировало и не останавливало этот процесс.
С другой стороны, когда антиоксидантов слишком много, они просто останавливают всякое окисление, в том числе полезное, необходимое — как было сказано выше, вызывая переполнение конвейра, останавливая движение: движение энергии по окислительной цепи, движение веществ по организму, движение организма вообще. Поэтому нельзя употреблять БАДы-витаминки с антиоксидантами (витамины A, E, C) не по назначению врача, да и по назначению без очевидных признаков гиповитаминоза их следует принимать с осторожностью.
Таким образом,
- когда антиоксидантов мало, мы окисляемся без остатка:
https://www.ncbi.nlm.nih.gov/pubmed/6947277
https://www.ncbi.nlm.nih.gov/pubmed/21977319 - когда антиоксидантов много, наше жизненное начало останавливается:
https://www.ncbi.nlm.nih.gov/pubmed/15153272
https://www.ncbi.nlm.nih.gov/pubmed/17327526
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3765487/ - лишь когда антиоксидантов достаточно, всё идёт своим чередом.
А здесь я отвечал на вопрос, откуда взять достаточное количество витамина С.
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
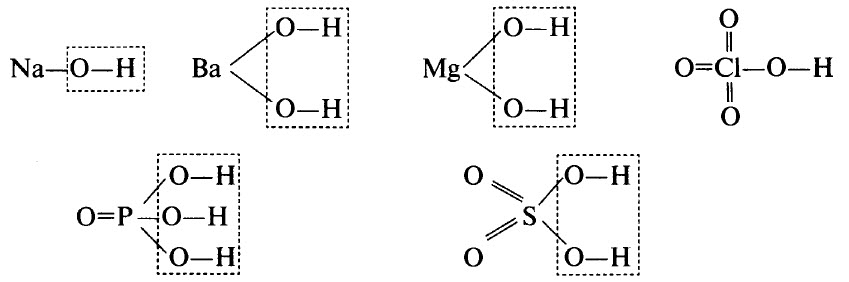
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
