Какие общие свойства раствора
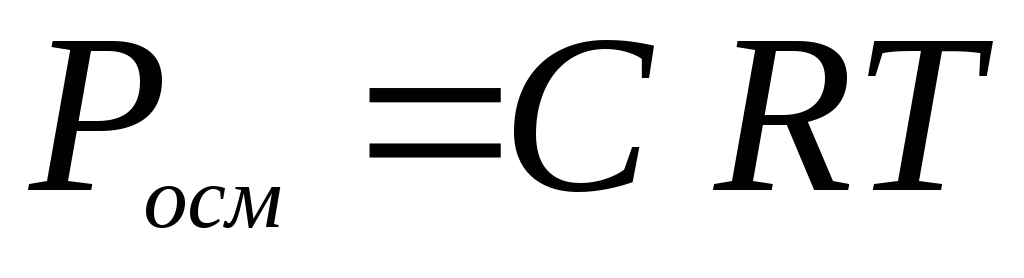
Классификация растворов
Введение
Растворы
Очень многие химические реакции, в том числе технические и жизненно важные, протекают в жидкой фазе.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Человек, животные и растения усваивают питательные вещества в виде растворов. Растворами являются физиологические жидкости – плазма крови, лимфа, желудочный сок и др. Многие медицинские препараты являются растворами различных химических веществ в воде или в спирте.
Природная вода является раствором. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание теории электролитической диссоциации является основой для изучения свойств неорганических и органических соединений и глубокого понимания механизмов химических реакций в растворах.
Растворами называют однородные системы, состоящие из двух или нескольких компонентов, состав которых можно изменять в определенных пределах без нарушения однородности.
Растворителем называется компонент, концентрация которого выше концентрации других компонентов.
Раствор это не механическая смесь, поскольку при растворении наблюдаются объемные и энергетические эффекты.
Раствор отличается от механической смеси гомогенностью, а от химического соединения:
a) переменным составом – от нуля до предела насыщения;
б) тем, что изменение свойств растворителя и растворённого вещества не носит радикальный характер.
Растворение – это самопроизвольный процесс, заключающийся во взаимодействии растворенного вещества с молекулами растворителя. Точка зрения Д. И. Менделеева:
раствор — это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Различают истинные и коллоидные растворы.
Истинные растворы — размер частиц ~10-10…10-11 м, т.е. атомы или молекулы.
Коллоидные растворы — размер частиц ~ 10-8… 5×10-10 м
Растворы бывают:
1) газообразные: газ-газ;
2) жидкие: газ-жидкость,
жидкость-жидкость,
твердое вещество – жидкость;
3) твердые: газ — твердое вещество,
твердое вещество — твердое вещество.
Жидкие растворы могут быть водные и неводные. Водные растворы – это растворы, в которых растворителем является вода.
Твёрдым раствором называется кристалл, кристаллическая решётка которого состоит из двух или более компонентов.
Растворы делятся на электролиты и неэлектролиты. Вещества, которые в растворе или расплаве полностью или частично распадаются на ионы и проводят электрический ток, называются электролитами.
Идеальным называется раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между взаимодействующими компонентами одинаковы.
Общие (коллигативные) свойства растворов те, которые не зависят от природы растворённых веществ, а зависит от количества растворенного вещества.
1.2.1 Закон Рауля:
понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого нелетучего вещества:
, (10.1)
где и – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
х – мольная доля.
Первое следствие из закона Рауля:повышение температуры кипения DТкип пропорционально моляльной концентрации раствора:
DТкип= Кэ×Сm , (10.2)
где Кэ – эбулископическая постоянная растворителя,
Сm – моляльная концентрация, моль/1000 г .
Второе следствие из закона Рауля:понижение температуры замерзания DТзам пропорционально моляльной концентрации раствора:
DТкип=Кк×Сm , (10.3)
где Кк – криоскопическая постоянная.
Кк и Кэ – зависят от природы растворителя:
(10.4)
где DНкип – удельная теплота испарения, ;
Ткип – температура кипения чистого растворителя, К;
R – газовая постоянная, .
, (10.5)
где DНкриc. – удельная теплота кристаллизации, ;
Ткрит. – температура кристаллизации чистого растворителя, К.
1.2.2 Осмотическое давление
Если система, разделённая мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Представим, что сосуд с двумя горлами для добавления раствора разделён мембраной (рисунок 1). В каждую часть сосуда зальём растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведёт к переходу части растворителя в ту часть сосуда, где концентрация растворённого вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнётся в сторону с меньшей концентрацией растворённого вещества (рисунок 1а). Если мембрана жёсткая, то в отсеке с большой концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рисунок 1а) не станет равным осмотическому давлению и не прекратит осмос.
Если внешнее давление больше атмосферного и приложено к более концентрированному раствору, то растворитель будет переходить в разбавленный раствор – обратный осмос.
Рисунок 10.1 — Схема разности осмотических давлений при концентрации x1<x2 при эластичной (а) и жесткой (б) мембранах
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Согласно Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворённое вещество, будучи переведенным в газообразное состояние в том же объёме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде:
π = СМ.R.T , (10.6)
где СМ – молярная концентрация, моль/л.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворённого вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворённых молекул, Вант-Гофф ввёл понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворённых молекул:
i = число частиц в растворе / число молекул в растворе . (10.7)
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением 2CH3COOH = (CH3COOH)2.
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в одном растворе уксусная кислота диссоциирует:
CH3COOH = CH3COO- + H+,
и число частиц становится больше числа молекул.
1.2.3 Закон распределения Нернста – Шилова:
при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями является величиной постоянной, независимой от общего количества компонентов:
, (10.8)
где Крас – коэффициент распределения;
Са и Сb – молярные концентрации веществ в растворах А и В, моль/л.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июля 2017;
проверки требуют 4 правки.
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы[1]. К таким коллигативным свойствам относятся:
- Понижение упругости растворителя над раствором,
- Повышение температуры кипения растворов (в сравнении с чистыми растворителями),
- Понижение температуры замерзания растворов (в сравнении с чистыми растворителями),
- Возникновение осмотического давления,
- Диффузия.
Законы Рауля[править | править код]
Первый закон Рауля[править | править код]
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя.
В 1886 (1887) году Ф. М. Рауль сформулировал закон:
Давление насыщенного пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва, где
Δp — собственно изменение давления по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе.
Второй закон Рауля[править | править код]
Также Рауль экспериментально доказал, что
повышение температуры кипения раствора по сравнению с температурой кипения растворителя равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбуллиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Осмотическое давление[править | править код]
Рассмотрим ситуацию, при которой частично проницаемая мембрана (то есть, такая, через которую могут проходить лишь мелкие объекты, например, молекулы растворителя, но не крупные — например, молекулы растворённого вещества) разделяет чистый растворитель и раствор (или два раствора с разными концентрациями). Тогда молекулы растворителя находятся практически в равных физических условиях по обе стороны мембраны, однако в более насыщенном растворе некоего вещества их концентрация, разумеется, меньше, чем в более разбавленном (в котором меньше места в растворе занимают молекулы растворённого вещества). Следовательно, со стороны менее насыщенного раствора через мембрану диффундирует большее число молекул, чем с противоположной стороны. А это значит, что растворитель попросту переходит из менее насыщенного раствора в более насыщенный, разбавляя его (выравнивая концентрации обоих растворов) и создавая давление на мембрану. Процесс этот (он называется осмосом) можно прекратить, оказав определённое давление на более насыщенный раствор (например, при помощи поршня) —— это давление и называется осмотическим давлением.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Определить осмотическое давление раствора можно по формуле, полученной в 1886 году Я. Х. Вант-Гоффом:
π = CMв-ва · R · T, где
CMв-ва — молярная концентрация раствора, выраженная в , а не в , как обычно;
R — универсальная газовая постоянная;
T — термодинамическая температура системы.
См. также[править | править код]
- Осмос
Примечания[править | править код]
- ↑ Д.А.Фридрихсберг. Курс коллоидной химии. — Ленинград «Химия», 1984. — С. 368.
Литература[править | править код]
- Ершов Ю.А. Общая химия.Биофизическая химия.Химия биогенных элементов. — Издание восьмое,стериотипное. — Москва: Высшая школа, 2010. — 559 с.
Общими являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ. Такие свойства могут проявляться в полной мере в идеальных растворах. Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Соответственно, образование этих растворов не сопровождается тепловым эффектом (ΔН = 0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества. К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором и температуры замерзания, повышение температуры кипения и осмотическое давление. Эти свойства проявляются в случае растворов нелетучих растворенных веществ, т.е. веществ, давлением паров которых можно пренебречь.
Закон Рауля.Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Французский ученый Р. Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ΔрА пропорционально молярной доле растворенного нелетучего вещества хВ:
р0А – рА = ΔрА = р0АхВ,
где р0А, рА – давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ΔрА – разность между давлениями насыщенного пара растворителя над раствором, рА и растворителем р0А. Т.е. с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Повышениетемпературы кипения ΔТкип пропорционально моляльности раствора ст
ΔТкип = Кэст,
где Кэ – эбулиоскопическая постоянная растворителя.
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Это обусловлено более низким давлением пара растворителя над раствором, чем над растворителем. Понижение температуры замерзания (кристаллизации)
ΔТзам = Ккст,
где Кк – криоскопическая постоянная.
Значения Кэ и Кк зависят от природы растворителя.
Используя ΔТкип и ΔТзам, можно определить молярную массу вещества. Для этого экспериментально определяют повышение температуры кипения или замерзания раствора. Если известна масса растворенного вещества тВ и растворителя тА, то молярную массу растворенного вещества МВ определяют по уравнению
МВ = ,
где К ≡ Кэ либо К ≡ Кк.
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя.
| Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба (рис. 5.1.) Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Оно равно давлению столба раствора в осмометре высотой h. При равновесии внешнее давление уравновешивает осмотическое давление. | Рис.5.1. Схема осмометра: 1 — вода; 2 — раствор; 3 — полупроницаемая мембрана |
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа
или π = ,
откуда ,
где – осмотическое давление; с – молярная концентрация раствора.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного – гипотоническим. Например, среднее осмотическое давление крови при 36 ˚С равно 780 кПа.
Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
Активность. Законы Вант-Гоффа и Рауля строго выполняются только в случае бесконечно разбавленных растворов. При увеличении концентрации раствора начинает все больше сказываться взаимодействие частиц растворенного вещества друг с другом и его свойства все больше отклоняются от идеальности. Эти сложные по природе взаимодействия учитывают, заменяя концентрацию компонента с его активностью а:
а = γс,
где γ — коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
Коэффициент активности вычисляют по экспериментальным данным. Для этого какое-либо из свойств раствора (например, температуру кипения или замерзания) и определяют коэффициент активности как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов.
Типы
растворов. По
количеству растворенного вещества
растворы могут быть разбавленными
(в одном литре разбавленного раствора
содержится менее одного моля растворенного
вещества) и
концентрированными.
По
количеству растворенного вещества и
характеру установившегося равновесия
между растворенным веществом и
растворителем растворы делятся на
ненасыщенные , насыщенные и пересыщенные
(раздел 8.4).
По
результату взаимодействия вещества с
растворителем растворы делят на ионные
(в них растворяемое вещество частично
или полностью диссоциировано на ионы)
и молекулярные
(растворяемое вещество распределяется
в растворителе в виде отдельных молекул).
По электрической
проводимости растворы делятся на:
растворы
неэлектролитов, не способные проводить
электрический ток (молекулярные
растворы);растворы
электролитов, проводящие электрический
ток (ионные растворы, проводники второго
рода).
Растворенные вещества делятся, в свою
очередь, на неэлектролиты и электролиты.
Неэлектролиты – это вещества, которые
в растворе и расплаве не диссоциируют
(не распадаются) на ионы.
Электролиты – это вещества, которые
в расплавах, воде и других полярных
растворителях диссоциируют на ионы.
Общие свойства растворов. Все
растворы обладают рядом общих свойств:
1. Давление насыщенного пара растворителя
над раствором всегда ниже, чем над чистым
растворителем; при этом, чем больше
концентрация растворенного вещества,
тем давление ниже (это свойство описывает
Iзакон Рауля).
Насыщенный пар – это пар, находящийся
в равновесии с жидкостью; Vисп=Vконд.
2. Растворы всегда кипят при температурах
более высоких, а замерзают при более
низких, чем чистый растворитель (это
свойство описывает IIзакон Рауля).
3. Для растворов характерно явление
осмоса (это свойство описывает закон
Вант-Гоффа).
Эти свойства количественно зависят от
числа частиц растворенного вещества,
от концентрации раствора и от того,
является ли данный раствор раствором
электролита или неэлектролита.
Для количественного описания свойств
растворов используют модель идеального
раствора. Если при образовании раствора
тепловой эффект ∆Н=0, изменение объема
∆V=0, изменение энтропии
∆S= ∆Sидеального раствора, то раствор называют
идеальным. В идеальном растворе между
компонентами нет химического
взаимодействия; каждый компонент ведет
себя в идеальном растворе независимо
от остальных компонентов, и свойства
раствора при данных условиях определяются
только концентрацией растворенного
вещества. Из реальных растворов лишь
разбавленные растворы неэлектролитов
могут по своим свойствам приближаться
к идеальным.
Примерами растворов неэлектролитов
могут служить, например, растворы
кислорода и сахара в воде, водные растворы
органических спиртов, растворы
углеводородов в углеводородах и т.д.
8.7. Свойства растворов неэлектролитов
Давление
насыщенного пара над раствором. I
закон Рауля.
В результате естественного процесса
результате естественного процесса
испарения над жидкостью образуется
пар, давление которого можно измерить
с помощью манометра (рис. 8.1). Эндотермический
процесс испарения обратим; одновременно
с ним протекает экзотермический процесс
конденсации:
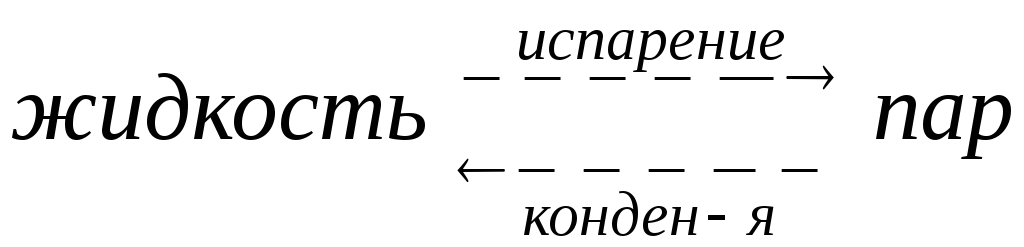
При равновесии
(∆G=0)
Vисп=Vконд.
Каждый раствор находится в равновесии
с его насыщенным паром. Давление
насыщенного пара каждого вещества есть
величина постоянная при данной
температуре, с повышением температуры
давление пара увеличивается.
Давление
насыщенного пара жидкости определяется
числом молекул жидкости, отрывающихся
с ее поверхности за единицу времени.
Рассмотрим
пример (рис.8.2). В первом сосуде у нас
находится чистая вода, во втором –
раствор сахара в воде (раствор
неэлектролита; сахар — нелетучее вещество
и при данных условиях не испаряется).
П
N1=1
P0
P0>P
 ри
ри
образовании раствора концентрация
растворителя уменьшается, его мольная
доля становится меньше единицы (N1<1).
Поверхность раствора, в отличие от
поверхности чистого растворителя,
частично занята молекулами нелетучего
растворенного вещества. Это приводит
к уменьшению числа молекул растворителя,
испаряющихся в единицу времени.
Однако
основную роль здесь играют силы
сольватационного взаимодействия между
молекулами растворителя и растворенного
вещества. Эти силы значительно прочнее
сил сцепления между молекулами
растворителя, чем и объясняется переход
меньшего числа молекул растворителя в
газовую фазу.
Таким
образом, над раствором давление
насыщенного пара растворителя (Р) всегда
меньше, чем над чистым растворителем
(Р0):
Р < Р0.
(Р0
– Р)=∆P
– понижение давления насыщенного пара
растворителя над раство-
ром.
Отношение
![]()
![]() называется относительным понижением
называется относительным понижением
давления насыщенного пара растворителя.
В
1887 г. французский ученый химик Франсуа
Рауль установил I
закон: относительное понижение давления
насыщенного пара растворителя над
раствором равно мольной доле растворенного
вещества.
Математическая
запись I
закона Рауля:
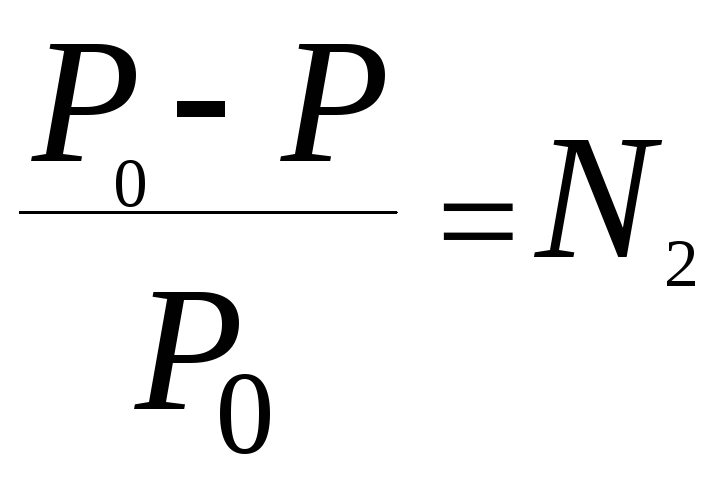 или
или
![]() ,
,![]()
где
N2
– мольная доля растворенного вещества.
Выразив
мольную долю растворенного вещества
N2
через соотношение
![]() ,
,
подставим
данное равенство в выражение I
закона Рауля, выполнив необходимые
преобразования, получим второй вариант
записи I
закона Рауля:
![]() ,
,
где
N1
– мольная доля растворителя.
Т.е. давление насыщенного
пара над раствором равно его давлению
над чистым растворителем, умноженному
на мольную долю растворителя.
Кипение и замерзание растворов
неэлектролитов. IIзакон
Рауля.
Следствием понижения
давления насыщенного пара растворителя
над раствором будет:
понижение температуры замерзания
раствора;повышение температуры кипения раствора.
Рассмотрим диаграмму
состояния воды и раствора неэлектролита.
На рис.8.3 схематически изображена
зависимость равновесного давления
водяного пара от температуры над чистой
водой и раствором.
При температуре
кипения давление пара равно внешнему
давлению, при температуре замерзания
давление пара над веществом в жидком и
твердом состояниях одинаково.
Линия АО — кривая
сублимации — характеризует давление
насыщенного водяного пара надо льдом,
ОВ – кривая
плавления или кристаллизации воды; ОС
– кривая испарения или конденсации
воды.
В точке О сосуществуют
все три фазы воды: жидкость, пар, лед.
Линия
О′С′ – кривая испарения или конденсации
раствора; О′В′ – кривая плавления или
кристаллизации раствора. Обозначение:
t1
— температура замерзания (кристаллизации)
раствора при 760 мм рт. ст.– точка В′;
t2
— температура замерзания чистой воды
(0°С при 760 мм рт. ст.) – точка В; t3
— температура кипения чистой воды (100°С
при 760 мм рт. ст.) – точка С; t4
— температура кипения раствора – точка
С′.
П оскольку
оскольку
давление насыщенного пара воды над
раствором будет ниже, чем над чистой
водой, то изменение его давления будет
характеризоваться кривой О′С′, все
точки которой располагаются ниже
соответствующих точек кривой ОС для
чистого растворителя, т.е. кривая кипения
для раствора лежит ниже, чем для чистой
воды. Из рис. 8.3 видно, что при 100°С давление
насыщенного пара воды над раствором
меньше атмосферного давления (точка
Д), поэтому при данной температуре
раствор не закипает. Равенство давлений
достигается в точке С′ при температуреt4.
При переходе от воды к раствору изменяется
также положение кривой плавления. И
кривая кипения, и кривая плавления
раствора расположены тем дальше от
соответствующих кривых воды, чем
концентрированнее раствор.
∆tкип
= t4
– t3
= (tкип.р-ра
– tкип.р-ля)
– повышение температуры кипения раствора
по сравнению с температурой кипения
растворителя.
∆tзам
= t2
– t1
= (tзам.р-ля
– tзам.р-ра)
– понижение температуры замерзания
(кристаллизации) раствора по сравнению
с температурой замерзания растворителя.
Зависимость
∆tкип
и ∆tзам
от концентрации растворов определяется
вторым законом Рауля:
повышение
температуры кипения и понижение
температуры замерзания растворов
пропорциональны моляльной концентрации
растворенного вещества,
т.е.
∆tкип
= Кэб
· Сm,
∆tзам
= Ккр
·Сm
,
где
Кэб
– коэффициент пропорциональности,
называемый эбуллиоскопической постоянной
растворителя; Ккр
– криоскопическая постоянная растворителя;
Сm
– моляльная концентрация растворенного
вещества, моль/кг. Физический смысл Кэб
и Ккр:
если Сm=
1 моль/кг, то ∆tзам=
Ккр,
т.е. Ккр
–
понижение tзам
раствора, моляльность которого равна
1 моль/кг;
∆tкип=
Кэб,
т.е. Кэб
– повышение tкип
раствора, моляльность которого равна
1 моль/кг.
Кэб,
Ккр
– характеристики растворителя, не
раствора, зависят от природы растворителя
(справочные величины). Например,
для воды: для
бензола:
kкр=1,86°С, Ккр=5,12°С,
kэб=0,52°С; Кэб=2,53°С.
Для
одномоляльных растворов различных
неэлектролитов независимо от их состава
температура кипения данного растворителя
повышается на одну и ту же величину, а
температура замерзания – понижается
на одну и ту же величину. Так, температура
кипения различных по составу одномоляльных
водных растворов увеличивается на
0,52°С, а температура замерзания понижается
на 1,86°С.
Этот закон
показывает, что свойства растворов
зависят только от числа частиц
растворенного вещества, но не от их
размеров, природы и т.д.
Измерение
понижения температуры кристаллизации
раствора по сравнению с температурой
кристаллизации чистого растворителя
называют криоскопией.
Измерение
повышения температуры кипения раствора
по сравнению с температурой кипения
чистого растворителя называют
эбуллиоскопией.
Методами
криоскопии и эбуллиоскопии определяют
относительные молекулярные массы
растворенного неэлектролита. Для этого
подставим в уравнение второго закона
Рауля «развернутую» формулу для расчета
моляльной концентрации растворенного
вещества В
![]() =
=![]() ,
,
получим:
∆tкип
= Кэб
·![]() ,
,
∆tзам
= Ккр
·![]() .
.
Откуда
![]() ;
;
![]() ,
,
где
МВ-
молярная масса растворенного неэлектролита
В, численно равная его относительной
молекулярной массе, mB– масса
неэлектролита В, г; mр-ля
– масса растворителя, кг.
Осмос. Осмотическое
давление. Закон Вант-Гоффа.
Если
привести в соприкосновение два раствора
с разными концентрациями, то молекулы
растворителя и растворенного вещества
будут диффундировать в противоположных
направлениях, преимущественно в том
направлении, где их концентрация ниже.
Такая двусторонняя диффузия приведет
к выравниванию концентраций (С1=С2).
Рассмотрим
особый случай односторонней диффузии,
когда на границе между раствором и
растворителем или между двумя растворами
различной концентрации находится
перегородка, проницаемая для молекул
растворителя и задерживающая частицы
растворенного вещества.
Представим
себе, что в сосуд с водой опущен цилиндр
с раствором, нижняя часть которого
изготовлена из материала, пропускающего
растворитель, но не пропускающего
частицы растворенного вещества
(полупроницаемая перегородка). Получается
неравновесная система, т.к. если в воде
N1=1,
то в растворе мольная доля растворителя
– воды N1<1.
Поэтому
в системе начнется самопроизвольный
процесс выравнивания концентраций.
Молекулы растворителя воды будут
переходить в цилиндр с раствором (переход
растворенного вещества исключен).
О дносторонняя
дносторонняя
диффузия растворителя в раствор через
полупроницаемую перегородку называется
осмосом.
На
рис. 8.4 представлен простейший прибор
для наблюдения осмоса, называемый
осмометром. В результате осмоса раствор
поднимается по цилиндру вверх за счет
того, что число молекул воды, проникающих
в единицу времени в направлении от
растворителя к раствору, больше числа
молекул воды, проходящих через мембрану
в обратном направлении. Через некоторое
время подъем жидкости в цилиндре
прекратится и ее уровень достигнет
высоты h над уровнем жидкости в стакане.
Столб жидкости с высотой h образовался
за счет осмоса. Осмос
прекращается тогда, когда скорости
перехода молекул растворителя через
полупроницаемую перегородку в обоих
направлениях становятся одинаковыми.
Для
количественной характеристики
осмотических свойств растворов по
отношению к чистому растворителю
вводится понятие об осмотическом
давлении. Осмотическое
давление (Росм)
– мера силы, приходящейся на единицу
площади поверхности и заставляющей
проникать молекулы растворителя через
полупроницаемую перегородку
или,
другими словами, давление,
которое нужно приложить к раствору,
чтобы осмос прекратился.
Осмотическое давление в растворе не
существует, оно проявляется только
тогда, когда раствор отделен от
растворителя полупроницаемой мембраной.
Осмотическое
давление Росм
зависит от температуры раствора и его
концентрации и не зависит от природы
растворителя и растворенного вещества.
В 1886 г. голландский химик Вант-Гофф
показал, что
для разбавленных растворовнеэлектролитов
зависимость осмотического давления от
температуры и концентрации выражается
уравнением (закон Вант-Гоффа):
![]() ,
,
где
Росм
– осмотическое давление раствора, кПа;
С – молярная концентрация растворенного
неэлектролита, моль/л; Т – абсолютная
температура, К.
Заменим
величину С отношением
![]() ;
;![]() ,
,
где m – масса растворенного вещества,
г; M – молярная масса растворенного
вещества, г/моль; V – объем раствора, л.
Подставим это отношение в выражение
закона Вант-Гоффа:
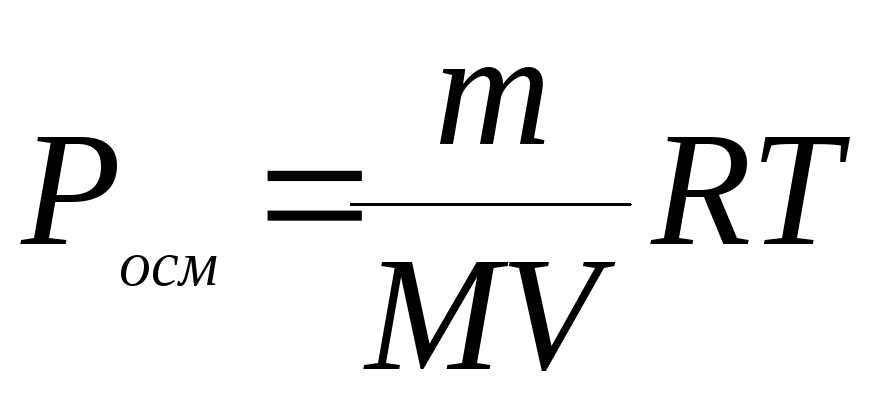 .
.
Формально
уравнение Вант-Гоффа аналогично уравнению
состояния идеального газа и выражает
сходство в поведении разбавленных
растворов неэлектролитов с идеальными
газами. Из вышеприведенного уравнения
выразим величину М:
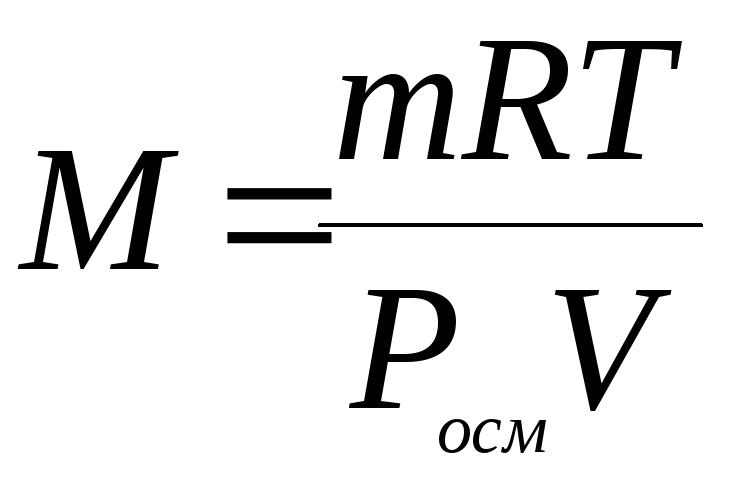 .
.
Данное
выражение позволяет определить
молекулярную массу растворенного
вещества, измерив осмотическое давление
в осмометре.
Явление
осмоса играет важную роль в жизни
растений, животных и человека. Стенки
растительных клеток живых организмов
представляют собой полупроницаемые
мембраны, через которые свободно проходят
молекулы воды, но почти полностью
задерживаются вещества, растворенные
в клеточном соке. Поэтому осмос служит
причиной тургора (состояние напряжения)
и плазмолиза (сморщивание) клеток. С ним
связаны процессы усвоения пищи и обмена
веществ. У высших животных и человека
осмотическое давление в разных органах
и тканях несколько меньше 8 атм и
постоянно. Осмотическое давление широко
встречается в природе, например, в
скважинах осмотическое давление рвет
породы и т.д.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
