Какие методы исследования свойств макроскопических систем применяются

Физика для средней школы
Молекулярная физика и термодинамика — разделы физики, в которых изучаются свойства тел и происходящие в них макроскопические процессы, связанные с огромным числом частиц, содержащихся в телах.
Для исследования этих процессов пользуются двумя методами: молекулярно-кинетическим (статистическим) и термодинамическим.
В основе молекулярной физики лежит молекулярно-кинетическая теория (MKT), которая объясняет строение и свойства тел движением и взаимодействием частиц (молекул, атомов, ионов), из которых состоят тела. Свойства тел, которые непосредственно наблюдаются на опыте (давление, температура и др.), она истолковывает как суммарный результат действия частиц. При этом она пользуется статистическим методом, интересуясь не индивидуальными характеристиками отдельных частиц, а лишь средними значениями физических величин, которые характеризуют движение частиц, составляющих систему.
В классической механике предполагается, что движение частиц происходит в соответствии с законами Ньютона, Если система состоит из малого числа частиц, то, зная начальные условия и решая уравнения механики, можно найти координаты и скорости всех частиц в любой момент времени, т.е. определить состояние системы. Однако огромное число молекул (например, в 1 м3 газа при нормальных условиях содержится число молекул, равное N = 2,7·1025 м-3 (постоянная Лошмидта), а в твердых и жидких телах — порядка 1028 молекул) и хаотичность их движения создает непреодолимые трудности на пути использования для описания системы механического подхода.
Мы практически не можем решать колоссальное число составленных уравнений. Кроме того, согласно соотношению неопределенностей, открытому в 1927 г. В. Гейзенбергом, определить точно положение частицы в пространстве (ее координаты) и ее импульс (а значит, и скорость) одновременно принципиально невозможно. Движение каждой отдельно взятой частицы не только не может быть установлено, но и не представляет интереса при изучении макроскопических явлений, рассматриваемых в молекулярной физике. Эти явления обусловлены не столько деталями строения атомов и характером управляющих ими законов, сколько необычайно большим числом самих атомов в макроскопических системах.
Наличие большого числа частиц дает возможность эффективно использовать статистические методы. Оказывается, в хаосе движений многих частиц можно все-таки найти некоторые закономерности в поведении средних параметров (или так называемые статистические закономерности). Например, мы не имеем возможности определить скорость каждой отдельной частицы газа, но можем узнать среднюю скорость, с которой движутся частицы данной группы молекул при данных условиях. При этом, как показывают расчеты, состояние системы не зависит от начальных координат и скоростей частиц.
Кинетическая энергия движения отдельных молекул может принимать различные значения при данном состоянии вещества, средняя же энергия имеет при этом вполне определенное значение. Это среднее значение энергии определяет температуру тела.
Однако возможен и другой способ описания явлений. Многие свойства веществ связаны с происходящими в них процессами превращения энергии из одних видов в другие. Поэтому и изучать эти свойства можно на основе законов энергетических превращений.
Термодинамика изучает общие свойства тел и различные процессы в них, сопровождающиеся превращениями энергии, на основе двух начал — фундаментальных законов, установленных в результате обобщения огромного числа опытных фактов, не используя какую-либо определенную модель строения вещества и не высказывая предположения о законах взаимодействия атомов и молекул.
В термодинамике изучаются тепловые процессы — процессы, связанные с изменением температуры тела, а также с изменением его агрегатного состояния.
Термодинамический и молекулярно кинетический методы, применяемые к одним и тем же объектам, дополняют друг друга.
Специфическим признаком, который позволяет физические системы и их свойства отнести к категории термодинамических — это строение этих систем. Макросистемы состоят из большого числа частиц, движение которых очень сложное. Такие системы называют статистическими. К статистическим системам динамические методы описания состояния применить нельзя. В таких системах используют методы математической статистики: теорию вероятностей, тот раздел, который занимается приближенным описанием сложных систем с большой массой элементов. Статистические методы заведомо неточны, однако статистическая неопределённость тем меньше, чем большее число элементов образует систему.
Итак, существует два способа (метода) описания процессов, происходящих в макроскопических телах: статистический и термодинамический. Макроскопическим телом называют тело, состоящее из очень большого числа частиц (атомов или молекул).
Раздел физики, который использует статистический метод, называется статистической физикой. Он посвящен изучению свойств образующих тело частиц и взаимодействий между ними. Статистическая физика изучает статистические закономерности, используя при этом вероятностные методы и объясняет свойства тел, наблюдаемые на опыте (такие как давление, температура), как результат суммарного действия отдельных частиц. Статистическая физика оперирует микропараметрами, которые относят к характеристикам отдельных частиц (скорость частицы, масса частицы и т.д.). Статистическая физика делится на статистическую термодинамику и физическую кинетику. Статистическая термодинамика исследует системы в состоянии равновесия, физическая кинетика изучает неравновесные процессы. Основной метод физической кинетики: решение кинетического уравнения Больцмана.
Термодинамический метод
Эти вопросы изучает термодинамика. В основе термодинамики лежит небольшое количество фундаментальных законов (начал термодинамики), установленных путем обобщения опытных фактов. Термодинамический метод, в отличие от статистического, не связан с каким—либо конкретным представлением о внутреннем строении тел и характером движения отдельных частиц. Термодинамика оперирует макроскопическими величинами, которые характеризуют состояние системы в целом (давление, температура, объем и т.д.). Термодинамический метод используется для теоретического анализа общих закономерностей разнообразных явлений. В силу общности исходных предположений методы термодинамики обладают большой строгостью. В этом их достоинство. Термодинамика, именно из-за ее общности, часто не в состоянии вывести частные закономерности, характеризующие специфические свойства тех или иных конкретных физических систем. Роль дополнения выполняет молекулярно-кинетическая теория. Эта теория целиком опирается на статистические методы. Молекулярно-кинетическая теория исходит из модели молекулярного строения рассматриваемого объекта. Опираясь на механику (атомы рассматриваются как механические системы) и статистику, она выводит затем те или иные термодинамические закономерности. Главное ее достоинство — большая глубина объяснений, наблюдаемых свойств и явлений. Статистическая физика начинает изучение явлений с описания строения тел.
Разница между этими двумя методами касается не предмета изучения, а применяемых подходов. Термодинамика хотя и изучает статистические закономерности физических процессов, но строится по дедуктивному плану (наподобие механики) исходя из небольшого числа начальных принципов, в формулировке которых статистика никак не отражается.
Так как в макросистемах динамические методы описания не применяются, то возникает вопрос о способах описания таких систем. Движения микрочастиц описывается законами квантовой механики. Их положение в принципе не может быть предсказано, положение частицы в некоторой области является случайным событием. Поэтому необходим специальный математический аппарат. Так, в идеальном газе координаты и скорости отдельных молекул являются случайными величинами. Задача теории по предсказанию случайных событий сводится к нахождению количественной характеристики возможности наступления события, коей является вероятность.
Разделим объем, занятый идеальным газом, на две равные части. Пусть N — число наблюдений, $N_A$ — число наблюдений в которых «маркированная» частица находилась в правой части объема, А — само событие. Тогда Вероятность наступления события А определяется формулой:
[Wleft(Aright)={mathop{lim}_{Nto infty } frac{N_A}{N} } left(1right).]
Вычисление вероятности с помощью формулы (1) и комбинаторных методов производится следующим образом: если испытание может приводить к N равным исходам и из этих исходов $N_A$ раз наступало событие А, то его вероятность дается формулой (1).
Если множество событий не является счетным, их описание осуществляется с помощью плотности вероятности. Представим замкнутый сосуд с газом, находящийся в неизменных внешних условиях. Молекулы в сосуде беспорядочно движутся. Разделим все пространство на небольшие объемы $triangle V_i, i=1,2,dots $ Число актов наблюдения N. При каждом акте наблюдения молекула окажется обнаруженной в каком-то объеме $triangle V_i.$ Пусть при N актах наблюдения ($Nto infty ) $молекула обнаружена $N_i $ раз в объеме $triangle V_i.$ Тогда плотность вероятности определяется равенством:
[fleft(x,y.zright)={mathop{lim}_{triangle V_ito infty } frac{W(triangle V_i)}{triangle V_i} }={mathop{lim}_{ begin{array}{c}
triangle V_ito infty \
Nto infty end{array}
} frac{N_i}{triangle V_iN}left(2right) },]
где x, y, z — координаты точки, к которой стягивается бесконечно малый объем $triangle V_i$.
Вероятность $Wleft(V_1right)$ для молекулы быть обнаруженной в объеме $V_1$ равна:
[Wleft(V_1right)=frac{Nleft(V_1right)}{N_0}=intnolimits_{V_1}{fleft(x,y,zright)}dxdydz left(3right).]
Если в качестве $V_1$ взять все пространство, то вероятность нахождения частицы равна 1:
[intnolimits_{V_1to infty }{fleft(x,y,zright)}dxdydz=1 left(4right).]
Уравнение (4) называется условием нормировки плотности вероятности.
Если молекула находится в замкнутом объеме, то условие нормировки:
[intnolimits_V{f}dV=1 left(5right)]
Рассмотрим событие, заключающееся в том, что частица находится либо в объеме $V_1$, либо в объеме $V_2$. Вероятность этого события:
[Wleft(V_1+V_2right)=frac{V_1+V_2}{V}=Wleft(V_1)+W(V_2right) left(6right).]
Формула (6) выражает правило сложения вероятностей для взаимно исключающих друг друга событий.
Формула, выражающая вероятность совместного наступления событий имеет вид:
[Wleft(A+Bright)=Wleft(Aright)+Wleft(Bright)-Wleft(ABright) left(7right),]
где $Wleft(ABright)=frac{N_{AB}}{N}$ — вероятность совместного наступления событий A и B.
Вероятность наступления события A при условии, что произошло событие B, называется условной вероятностью:
[Wleft(frac{A}{B}right)=frac{N_{AB}}{N_B}=frac{W(AB)}{W(B)}left(8right).]
(8) — формула умножения вероятностей.
Для независимых событий:
[Wleft(ABright)=Wleft(Aright)Wleft(Bright)left(9right).]
Важное значение в статистической физике имеет понятие средней дискретной величины. Если случайная величина X принимает ряд значений: $x_1,x_2,dots x_n $, то ее среднее значение определяется равенством:
[leftlangle xrightrangle =frac{1}{N}sumlimits^N_{i=1}{ begin{array}{c}
\
x_i end{array}
}=sumlimits_j{W_jx_j}left(10right)]
где $W_j$- вероятность того, что X принимает значение $x_j$.
Для непрерывно изменяющейся величины среднее значение находят по формуле:
[leftlangle xrightrangle =intnolimits^{infty }_{-infty }{xfleft(xright)dx left(11right),}]
где $fleft(xright)$- плотность вероятности распределения величины x.
Молекулярная физика и термодинамика – это разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул. Для исследования этих процессов применяют два количественно различных и взаимно дополняющих друг друга метода – статистический и термодинамический.
ОПРЕДЕЛЕНИЕ: Молекулярная физика – это раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода. Этот метод основан на том, что свойства макроскопической системы, в конечном счете, определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц.
Например, температура тела определяется скоростью движения его молекул, но так как в любой момент времени различные молекулы имеют различные скорости, то температура может быть выражена через усредненное значение скорости движения молекул.
Таким, образом, макроскопические характеристики имеют физический смысл только в случае большого числа молекул.
ОПРЕДЕЛЕНИЕ: Термодинамика – это раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений – этим термодинамический метод отличается от статистического. Термодинамический метод несколько ограничен, т.к. термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества.
Молекулярно-кинетическая теория (МКТ) и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования. Термодинамика имеет дело с термодинамической системой – это совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как между собой, так и с другими телами, т.е. внешней средой. Основа термодинамического метода – это определить состояние термодинамической системы в любой момент времени. Состояние системы задается термодинамическими параметрами, или параметрами состояния, – это совокупность физических величин, характеризующих свойства термодинамической системы (температуру, давление, объем).
ОПРЕДЕЛЕНИЕ: Температура – это физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
В соответствии с решением 11ой Генеральной конференции по «мерам и весам» (1960 год), в настоящее время можно применять только две температурные шкалы – термодинамическую и международную практическую, градуированные соответственно в Кельвинах и в градусах Цельсия.
В международной практической, в качестве основных, взяты точки замерзания и кипения воды при давлении 1,013105 Па соответственно 0C и 100C (реперные точки). Термодинамическая температурная шкала определяется по одной реперной точке, в качестве которой взята тройная точка воды (температура, при которой лед и насыщенный пар при давлении 609 Па находятся в термодинамическом равновесии). Температура этой точки по термодинамической шкале равна 273,16 К. Градус Цельсия равен Кельвину
T = 273 + t.
ОПРЕДЕЛЕНИЕ: Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом.
Макроскопическая система находится в термодинамическом равновесии, если ее состояние с течением времени не меняется (предполагается, что внешние условия рассматриваемой системы при этом тоже не изменяются). В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствует сила взаимодействия;
3) столкновение молекул газа между собой и стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, т.к. они в условиях близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, модно перейти к теории реальных газов.
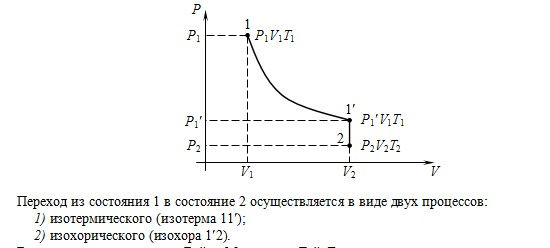
Рассмотреть законы, описывающие поведение идеальных газов (закон Бойля-Мариотта, закон Гей-Люссака), самостоятельно.
Закон Авогадро: 1 моль любых газов при одинаковой температуре и давлении занимают одинаковые объемы (при нормальных условиях этот объем равен 22,4110–3 м3/моль).
По определению в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро.
NA = 6,0221023 моль–1
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в эту смесь газов.
P = P1 + P2 + … + Pn.
ОПРЕДЕЛЕНИЕ: Парциальное давление – это давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем равный объему смеси при той же температуре.
Далее читайте в PDF, т.к. в тексте присутствую формулы и графики.
Читать онлайн:
Скачать с облака:
Облако.mail.ru: Запись только для зарегистрированных
Поделиться:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Особенностью молекулярной физики является то, что в ней рассматриваются свойства тел (систем), состоящих из очень большого числа одинаковых молекул. Состояние системы, содержащей небольшое число частиц, можно полностью определить, т.е. найти координаты и скорости всех частиц в любой момент времени, решив систему дифференциальных уравнений движения при известных значениях координат и скорости движения всех частиц системы в начальный момент времени и заданном законе их взаимодействия.
Макроскопические тела состоят из очень большого числа молекул. Например, в 1см 3 газа при температуре 0° С и давлении 760 мм pm. cm. содержится ~ 2,7-10 19 молекул. Систему дифференциальных уравнений движения для такого огромного числа молекул, считая, что движение каждой молекулы описывается законами классической механики, практически невозможно даже записать, не хватило бы всей бумаги, имеющейся на Земле. Кроме того, характеристики движения каждой отдельной молекулы изменяются со временем случайным образом.
Физические свойства макроскопических тел, состоящих из очень большого числа молекул, изучаются двумя методами — статистическим и термодинамическим. Они взаимно дополняют друг друга.
Для изучения свойств макроскопических тел и явлений, происходящих в них, не нужно знать характер движения отдельных молекул тела. Наличие очень большого числа молекул в макроскопических телах приводит к появлению новых статистических закономерностей в их поведении. Движение совокупности огромного числа молекул приобретает новые свойства, не свойственные чисто механическому движению. Хаотическое тепловое движение совокупности молекул описывается статистическими законами и характеризуется физическими величинами, не присущими отдельным молекулам: температурой, давлением и т. д.
В статистическом методе используется математический аппарат теории вероятности и определённые модели строения рассматриваемого макроскопического тела. Статистический метод применяется только к совокупности огромного числа молекул. Он основан на том, что свойства макротел рассматриваются, как результат суммарного осредненного теплового хаотического движения и взаимодействия всех молекул. Микроскопические характеристики молекул (скорость, импульс, энергия) являются случайными величинами. В теории, описывающей статистические закономерности, вычисляются не точные значения физических величин, а их средние по времени значения.
Существует определённая количественная связь между свойствами макроскопических тел и средними значениями физических величин, характеризующих поведение и свойства отдельных молекул. Например, средняя кинетическая энергия молекул газа прямо пропорциональна абсолютной температуре.
В основе кинетической теории лежит статистический метод. Одной из основных задач кинетической теории является нахождение законов распределения физических величин по всем их численным значениям. Статистический метод позволяет определить средние значения случайных величин и оценить вероятности всех возможных численных значений этих величин.
Вероятность наблюдаемых численных значений случайной величины выражается определённой формулой, которая называется законом распределения данной физической величины.
Физический смысл основных физических величин, таких как давление, температура, энтропия и т. д., которые не применимы к отдельным молекулам, хотя и являются следствием их теплового хаотического движения, можно объяснить, используя статистический метод.
Кинетическая теория газов устанавливает связь макроскопических параметров состояния системы (давления, температуры, плотности) со свойствами и параметрами движения молекул (скоростью, энергией и т.д.). Результаты, полученные в кинетической теории газов, носят статистический, вероятностный характер. Для реальных макроскопических тел, состоящих из очень большого, но конечного числа молекул, всегда наблюдаются отклонения от законов распределения, причём, чем больше молекул в системе, тем меньше отклонения от этих законов.
В термодинамическом методе исследования физических явлений не рассматривается внутреннее строение макроскопических тел и характер движения молекул. Термодинамический метод основан на анализе условий и количественных соотношений при различных превращениях энергии, происходящих в системе. Учёные разработали термодинамический метод в то время, когда не было экспериментальных доказательств того, что вещество состоит из молекул, но уже был открыт закон сохранения и превращения энергии. Соотношения между разными видами энергии позволяют изучать физические свойства систем при самых различных процессах, в которых они участвуют.
Раздел физики, в котором физические свойства макроскопических систем изучаются с помощью термодинамического метода, называется термодинамикой.
Термодинамика рассматривает наиболее общие свойства макросистем, находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями.
