Какие изменения свойств элементов наблюдаются при увеличении атомных масс
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
253,5 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху вниз): увеличивается… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Как определить валентность по таблице менделеева?
Номер группы, в которой расположен атом в периодической таблице равен его высшей валентности. Низшая валентность определяется разницей между числом восемь и номером группы. Натрий и алюминий имеют только одно значение валентности, равное номеру группы.
Как построена периодическая система химических элементов?
Интересы часто менялись, поэтому во многих областях знаний что-то знаю:)
В периодической системе отражаются сходства свойств различных элементов.
Выделяют:
- группы (столбцы таблицы), в рамках которых элементы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках.
- периоды (строки таблицы), в рамках которых элементы демонстрируют определённые закономерности в атомном радиусе, энергии ионизации и электроотрицательности, а также в энергии сродства к электрону.
- блоки, элементы в которых объединены тем, на какой оболочке находится последний электрон. Блоковая структура выглядит так:
Подробнее почитать обо всех закономерностях периодической системы можно здесь
Чем отличаются атомы щелочных металлов?
Особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне. Он может быть легко удален, так как атому проще отдать его, чтобы приобрести энергетическую конфигурацию инертного газа (как раз после инертных газов в периодической таблице и расположены щелочные металлы). Именно по этой причине для всех элементов этой группы характерны восстановительные свойства.
Прочитать ещё 1 ответ
Почему в группе сверху вниз радиус атомов увеличивается, и металлические свойства усиливаются?
Химия / Медицина / Биология / Русский язык / Физика / Математика / География /…
В группах (сверху вниз) радиусы атомов увеличиваются за счёт увеличения числа электронных уровней (слоёв).
В группе металлические свойства усиливаются (сверху вниз), так как радиус, по которому движутся внешние электроны увеличивается, а следовательно притяжение между ядром и электронами становится меньше — внешние электроны легче отдаются.
Надеюсь, что помог.
Чем определяется различие свойств изотопов калия 40,19 и аргона 40,18?
Различие определяется различием количества, и соответственно заполнения электронных орбиталей электронами (в следствие различия в заряде ядра).
Химические свойство определяются прежде всего заполнением орбиталей электронами, отсюда и свойства.
У аргона все орбитали заполнены полностью, поэтому он инертен. У калия появляется новый уровень с одном электроном, слабо связанным с ядром — отсюда его готовность вступать в химические реакции, отдавая валентный электрон.
Раздел 3.1 Периодический закон и периодическая система химических элементов
Д.И. Менделеева. Строение атома. Химическая связь
3.1. Периодический
закон и периодическая система химических элементов Д. И. Менделеева
Периодический
закон – один из важнейших законов химии.
Этот
закон открыл в 1869 г. великий русский ученый-химик Дмитрий Иванович Менделеев.
В
середине XIX в. было известно около 60 химических элементов. Д. И. Менделеев
полагал, что должен существовать закон, который объединяет все химические
элементы. Менделеев считал, что главной характеристикой элемента является
его атомная масса. Поэтому он
расположил все известные элементы в один ряд в порядке увеличения их атомной
массы.
В
ряду от Li до F металлические свойства
элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются
свойства элементов в ряду от Na до Cl.
Такой
характер изменения свойств элементов и их соединений, какой наблюдается при
увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при
увеличении атомной массы изменяются периодически.
Это
периодическое изменение называется периодической
зависимостью свойств элементов и их соединений от величины атомной массы.
Поэтому
Д. И. Менделеев сформулировал открытый им закон так:
Свойства
элементов, а также формы и свойства соединений элементов находятся в
периодической зависимости от величины атомной массы элементов.
Менделеев
расположил периоды элементов друг под другом и в результате составил периодическую систему элементов.
Периодическая
система
– это графическое выражение периодического закона. Каждый элемент занимает
определенное место в периодической системе и имеет свой порядковый номер.
Например:
Структура
периодической системы
Периодическая
система состоит из семи периодов, десяти рядов и восьми групп.
Период – это
последовательность элементов, которая начинается щелочным металлом и
заканчивается благородным газом.
Исключения: первый период, который начинается водородом; седьмой период, который является
незавершенным.
Периоды
разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый,
второй и третий периоды являются малыми. Большие
периоды состоят из двух горизонтальных
рядов. Четвертый, пятый и шестой периоды являются большими. Верхние ряды больших периодов
называются четными, нижние ряды –
нечетными.
В
шестом периоде после лантана находятся
14 элементов, которые похожи по свойствам на лантан и называются лантаноидами.
Они располагаются в нижней части периодической системы.
В
незавершенном седьмом периоде после актиния
находятся 14 элементов, которые похожи по свойствам на актиний и называются актиноидами.
Как и лантаноиды, они располагаются в нижней части периодической системы.
Число элементов в периодах
В каждом периоде
слева направо металлические свойства элементов ослабляются, а неметаллические
свойства усиливаются.
В
четных рядах больших периодов находятся только металлы.
Группа – это
совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и
в других соединениях. Эта валентность равна номеру группы.
Исключения:
Каждая
группа состоит из двух подгрупп: главной и побочной. Главная подгруппа содержит элементы
малых и больших периодов. Побочная
подгруппа содержит элементы только больших периодов.
Например,
рассмотрим 1-ю группу периодической системы:
В главных
подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические
свойства ослабевают. Все элементы побочных подгрупп являются металлами.
УПРАЖНЕНИЯ
1.
Приведите современную формулировку периодического закона.
Объясните, почему в периодической системе элементов аргон, помещены
соответственно перед калием, хотя имеют бóльшую атомную массу. Как называются
пары таких элементов?
Решение: Свойства элементов и их соединений находятся в периодической зависимости
от заряда ядра атома, или порядкового номера элемента.
При
увеличении порядкового номера (заряда ядра) в атомах элементов последовательно
увеличивается общее число электронов, а число электронов на внешнем электронном
слое изменяется периодически, что приводит к периодическому изменению свойств
химических элементов.
Положение
элементов в Периодической таблице не зависит от атомной массы
элемента, а зависит от заряда ядра, поэтому Ar+18 помещен перед K+19, Co+27 –
перед Ni +28, Te+52 – перед I+53, Th+90 – перед Pa+91 (хотя аргон, кобальт,
теллур и торий имеют большую массу, чем калий, никель, йод и протактиний соответственно).
Пары
элементов с различным числом протонов и нейтронов, но с одинаковым числом
нуклонов называют изобарами, например
элемент | Число протонов | Число нейтронов | Число |
Ar | 18 | 22 | 40 |
K | 19 | 21 | 40 |
_____________________________________________________________
2.
Как изменяются свойства гидроксидов
элементов в периодах и группах с увеличением порядкового номера? Почему?
Решение: Металлы могут образовывать и основные, и кислотные, и
амфотерные гидроксиды. При этом с увеличением степени окисления металла (при
движении слева направо в периодической таблице) основной
характер его оксидов и гидроксидов ослабляется, а кислотный усиливается.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
Сила оснований слева направо уменьшается, а сверху вниз растет, так
же как металлические свойства растут сверху вниз.
Например,
Cs (цезий) более активный металл, чем К (калий), так как у Cs валентный
электрон находится дальше от ядра, чем у К (калия) и Cs легче отдает электрон
(так как притяжение ядра ослабевает).
Если один элемент может иметь разные степени
окисления, то с увеличением степени окисления элемента сила основания
уменьшается, больше проявляется кислотный характер образуемого соединения, например
Cr+2(OH)2
Cr+3(OH)3≡H3CrO3
H2CrO4
основание
амфотерный гидроксид
кислота
основной характер ослабляется, кислотный характер
усиливается
Неметаллы не образуют основные и амфотерные оксиды. Практически
все оксиды неметаллов являются кислотными.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
В коком периоде, в какой группе и в какой подгруппе
находятся элементы с порядковыми номерами 14, 29, 52, 56, 78.
2.
Напишите символы, названия и порядковые номера всех
элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы.
3.
Какие элементы главной подгруппы пятой группы
являются элементами малых периодов. Напишите их символы, названия, порядковые
номера.
4.
Напишите формулы оксидов элементов с порядковыми
номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
5.
Какой элемент имеет более выраженные металлические
свойства: Са (Z = 20) или Ва
(Z = 56). Почему?
6.
Какой элемент имеет более выраженные неметаллические
свойства: Р (Z = 15) или Cl (Z = 17). Почему?
7.
Какой элемент четвертого периода является самым
активным неметаллом. Почему?
8.
Исходя из положения галлия в периодической системе
элементов Д. И. Менделеева, опишите важнейшие свойства простого вещества и
соединений элемента.
9.
Один из элементов образует оксид, массовая доля
кислорода в котором составляет 0,305. Элемент проявляет в этом оксиде степень окисления, равную + 4. Определите
относительную атомную массу этого элемента и назовите его.
10.
Элемент образует высший оксид состава ЭО3.
С водородом этот же элемент образует летучее соединение, массовая доля водорода
в котором составляет 5,88%. Рассчитайте относительную атомную массу элемента и
назовите его.
1. Среди всех элементов главной подгруппы | |
а) наиболее выраженными металлическими свойствами | б) самой маленькой плотностью |
в) самой большой относительной атомной массой | г) |
2. Гипотетическая формула высшего оксида | |
а) ЭО2 | б) Э2О5 |
в) ЭО4 | г) Э2О11 |
3. Порядковый номер элемента с наибольшей | |
а) 6 | б)72 |
в)82 | г)12 |
4. Сколько энергетических уровней | |
а) 4 | б)3 |
в)6 | г)5 |
5. При сгорании 1,86 г органического | |
а) 3 | б)2 |
в)15 | г)13 |
6. В каких рядах химические элементы | |
а) | б) S, |
в) Li, Na, K | г) B, Be, Li |
7. В порядке возрастания энергии | |
а) Na, Mg, Al, Si | б) Na, Mg, Ca, Si |
в) | г) Si, Al, Mg, Na |
8. По происхождению (этимологии) названий | |
а) селен | б) теллур |
в) ниобий | г) церий |
9. Одинаковое по абсолютной величине, но | |
а) бор | б) азот |
в) сера | г) углерод |
10. Свойства | |
а) амфотерные, основные, кислотные | б) основные, кислотные, амфотерные |
в) основные, амфотерные, кислотные | г) кислотные, амфотерные, основные |
Ответы:
1 | б |
2 | б |
3 | а |
4 | б |
5 | г |
6 | а |
7 | а |
8 | в |
9 | г |
10 | в |
26-Авг-2012 | комментарий 21 | Лолита Окольнова
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Не надо учить наизусть химические свойства каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по химии находится в Периодической системе элементов.

Как изменяются электронные конфигурации s-, p-элементов (по группам и периодам) и d-элементов, тоже можно почитать отдельно.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и в периодах.
1. Изменения свойств химических элементов и их соединений в группах:

В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
- В группах сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:

В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений
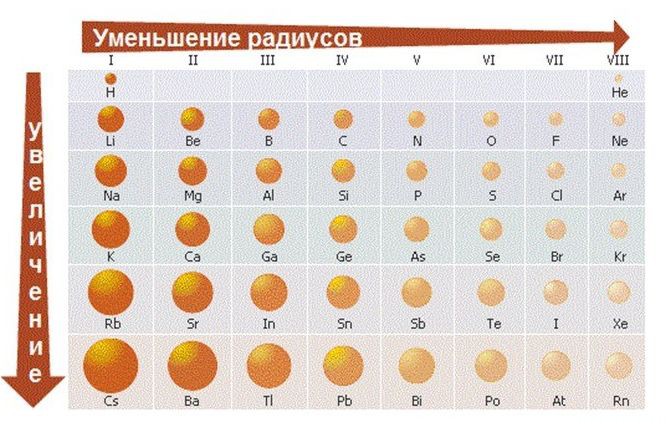

Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
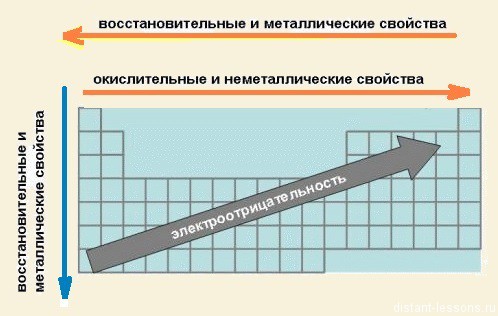
Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.
К ним относятся:
- Zn
- Cr
- Al
- Sn
- Pb
- Mn
- Fe
- Be
- вопросы заданий ЕГЭ по этой теме — А2
- А2 ГИА (ОГЭ)
Тест
1. В ряду Li → Ве → В → С
усиливаются восстановительные свойства простых веществ
усиливается основность соединений
усиливаются кислотные свойства соединений
кислотные свойства элементов ослабевают
2. Усиление металлических свойств элементов представлено в ряду:
N → Р → As
S → Р → Si
Sb → As → P
Al → C → N
3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0)имеет ион
Ca(0)
Al(3+)
Cs(+)
K(+)
4. В каком ряду кислотность соединений возрастает
Cr(0), Cr(3+), Cr(+6)
Mn(+6), Mn(+4), Mn(+2)
Cl(+7), Cl(+3), Cl(+1)
S(+6), S(+4), S(0)
5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO — Cr2O3 — CrO3
основной — кислотный — амфотерный
основной — амфотерный — кислотный
все основные
все несолеобразующие
6. Даны элементы: F, O, N, Cl. Какие утверждения верны?
в заданном ряду элементов электроотрицательность уменьшается
основные свойства оксидов этих элементов ослабевают, а кислотные усиливаются
неметаллические свойства простых веществ усиливаются
степень окисления атомов в высших оксидах одинакова
7. Наиболее выражены металлические свойства у:
фософра
азота
рубидия
водорода
8. Только амфотерные оксиды указаны в ряду:
Na2O, ZnO, CuO
ZnO, Al2O3, Cr2O3
Al2O3, FeO, SO3
CO2, CO, N2O5
9. Выберите правильное утверждение: А 9.в ряду элементов: Na – Si – Cl неметалличность простых веществ, образуемых этими элементами, усиливается B. в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
утвеждение А верно
веное утверждение — B
оба утверждения верны
оба неверны
10. Соединения элемента с порядковым номером 20
простое вещество проявляет металлические свойства
оксид элемента — кислотный
при взаимодействии с водой оксид элемента образует кислоту
в соединениях проявляет отрицательную степень окисления
Категории:
|
Обсуждение: «Закономерности изменения химических свойств элементов и их соединений»
(Правила комментирования)
ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ [c.25]
Чем обусловлено периодическое изменение свойств химических элементов [c.148]
Периодическое изменение свойств химических элементов [c.54]
Такой характер изменения свойств элементов и их соединений, какой наблюдается при увелич( нии атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов прк увеличении атомной массы изменяются периодически. [c.53]
Периодическое изменение свойств элементов представлено в периодической таблице современного вида. При расположении элементов в порядке возрастания атомных номеров и группировке на основании общих свойств они образуют семь горизонтальных рядов, называемых периодами. Каждый вертикальный столбец — группа элементов — содержит элементы с близкими свойствами. Группа лития (Ы), состоит, например, из шести элементов. Все эти элементы — крайне реакционноспособные металлы, образующие хлориды и оксиды общей формулы ЭС1 и Э2О соответственно. Так же, как хлорид натрия, все хлориды и оксиды этих элементов — ионные соединения. В противоположность этому группа гелия, расположенная по правому краю таблицы, состоит из крайне инертных элементов (к настоящему времени известны соединения только ксенона и криптона). Элементы группы гелия известны под названием благородные газы. [c.127]
Периодические изменения свойств [c.325]
При решении задач старайтесь привлекать сведения из самых различных разделов изучаемой дисциплины. Здесь вам несомненную помощь должно оказать знание содержания и структуры изучаемой науки. Так, общая химия имеет дело со следующими учениями 1) о строении вещества, 2) о направлении химического процесса, 3) о скорости химического процесса и 4) о периодическом изменении свойств элементов и их соединений. Творческий подход к решению проблемы будет состоять в, одновременном использовании знаний этих четырех учений. Вам встретится немало задач, когда для решения возникшей проблемы необходим многосторонний подход (использование знаний по строению вещества, химической термодинамики и кинетики и приложения предсказательной силы периодического закона Д. И. Менделеева). Можно посоветовать именно так подойти и к другим изучаемым наукам, чтобы при решении профессиональных задач пользоваться основными учениями наук. [c.8]
УЧЕНИЕ О ПЕРИОДИЧЕСКОМ ИЗМЕНЕНИИ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИИ [c.148]
Периодическое изменение свойств элементов и их соединений 812—901, 906, 937, 939, 940, 943. [c.181]
Структура периодической системы элементов. В соответствии с периодическим изменением свойств элементов система Д. И. Менделеева состоит из семи периодов. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми, остальные — большими. Вследствие различия периодов по длине и дру-1ИМ признакам может быть много способов их относительного [c.36]
Содержит задачи и вопросы, охватывающие важнейшие разделы общей химии строение вещества, направление и скорость процессов, периодическое изменение свойств элементов и соединений. Предпочтение отдано задачам проблемного и качественного характера, формирующим химическое мышление, при решении которых требуется поиск дополнительных сведений. Для проверки химических знаний даются расчетные задачи традиционного типа. [c.2]
На основе системного подхода параграфы в предлагаемом сборнике подобраны соответственно выделенным разделам химии 1) строение вещества, 2) направление химических процессов, 3) скорость химических процессов и 4) периодическое изменение свойств элементов и их соединений. [c.5]
Химия —наука и учебный предмет содержит следующие учения 1) о строении вещества, 2) о направлении химических процессов (химическая термодинамика), 3) о скорости химических процессов (химическая кинетика), 4) о периодическом изменении свойств элементов и соединений. Посмотрите содержание этого пособия и определите, насколько оно отвечает перечисленным учениям. Просмотрите другие учебники химии. Насколько их содержание отвечает этим учениям [c.10]
Изучение структуры электронных слоев атома показало, что периодическое изменение свойств атомов элементов происходит вследствие периодического возвраш,ения к однотипным электронным группировкам в оболочках атомов. С увеличением зарядов атомных [c.83]
ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТАРНЫХ ВЕЩЕСТВ [c.48]
Структура периодической системы. В соответствии с периодическим изменением свойств элементов система Д. И. Менделеева состоит из нескольких периодов. Схематически это представлено на рис. 27, на котором указаны порядковые номера первого, предпоследнего и последнего элемента каждого периода. Три периода (1, 2 и 3) — малые, однорядные первый содержит лишь два элемента, второй и третий по восемь. Остальные периоды — большие в двух из них [c.59]
Периодическое изменение свойств [c.27]
Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется (см. табл. 1). Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т. д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень. [c.61]
Таким образом, электронное строение атомов всех элементов можно вывести из положения элементов в Периодической системе. В ряду элементов с последовательно возрастающим порядковым номером (числом электронов, зарядом ядра) аналогичные электронные конфигурации атомов периодически повторяются. Этот периодически повторяющийся характер изменения электронных конфигураций атомов объясняет периодическое изменение свойств элементов, т. е. Периодический закон Д. И. Менделеева. [c.39]
Чтобы обратиться к объяснению периодического изменения свойств элементов, т. е. к периодическому закону, а также к отображению этого закона в виде системы элементов, уместно кратко суммировать то, что нам известно о строении атомов. [c.37]
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона. [c.53]
Менделеев открыл периодический закон, но не мог объяснить природу периодичности. Не была вскрыта причина периодического изменения свойств элементов и их соединений. [c.79]
Теперь, когда новейшие исследования позволили принять за основную количественную характеристику химического элемента порядковый номер, т. е. величину положительного электрического заряда ядра атома, и на основе его вскрыть периодическую изменяемость структуры электронной оболочки, можно сказать, что с изменяемостью последней связано периодическое изменение свойств элементов. Прежняя форма периодической системы (табл. 21) не может отразить в полной мере сложную картину многообразия химической природы элементов и закономерности изменения их различных свойств. [c.101]
Изучение строения атомов позволило понять причину периодичности. Периодическое изменение свойств элементов связано с периодическим повторением сходных электронных структур. [c.139]
Чтобы подчеркнуть закон периодичности и превратить непрерывный ряд элементов в периодическую систему, естественно было разбить весь ряд элементов, расположенных по величине атомных весов, на отдельные отрезки, внутри которых начинается и заканчивается периодическое изменение свойств. Менделеев подписывает каждый такой отрезок ряда один под другим и получает первый набросок таблицы элементов. [c.75]
Физический смысл периодического закона состоит в том, что периодическое изменение свойств элементов находится в полном соответствии с периодически возобновляющимися на все более высоких энергетических уровнях сходными электронными структурами атомов. С их закономерным изменением закономерно изменяются физические и химические свойства. Так образуются подгруппы системы, т. е. вертикальные ряды элементов-аналогов по их электронной структуре. Например, в подгруппе углерода [c.95]
Отсюда видно, что резкое изменение свойств при переходе от галогена к щелочному металлу и уменьшение основных свойств при переходе от щелочного металла к щелочноземельному периодически повторяется, если все элементы расположить в порядке ио величине их атомного веса . Это периодическое изменение свойств элементов обнаруживается независимо от того, сколько элементов отсутствует в ряду между магнием и хлором, кальцием и бромом, стронцием и иодом. [c.46]
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 приводит к периодическому повторению строения электронных оболочек. А поскольку от них зависят химические свойства элементов, то они периодически повторяются. В этом ф и-зический смысл периодического закона. [c.53]
Предшественники Д. И. Менделеева (Доберейнер, Ньюлендс, Лотар Майер и др.) сравнивали только сходные элементы, а потому и не смогли открыть периодический закон. В отличие от них Д. И. Менделеев обнаружил периодическое изменение свойств элементов с изменением значений их атомных масс, сравнивая между собой несходные естественные группы элементов. В то время были известны такие группы элементов, как, например, галогены, щелочные и щелочноземельные металлы. Менделеев следуюш,им образом выписал и сопостав]1л элементы этих групп, расположив их в порядке возрастания значений атомной массы [c.35]
Теперь мы можем объяснить причину периодического изменения свойств элементов и их соединений лри увеличении порядкового номера, т. е. раскрыть физический смысл периодического закона Д. И. Менделеева [c.82]
Теория строения атомов объясняет периодическое изменение свойств элементов при увеличении порядкового номера. [c.87]
Таблицы периодической системы. На основании открытого им периодического закона Менделеев составил периодическую систему элементов. Он разбил весь ряд элементов на отдельные отрезки, внутри которых начинается и заканчивается периодическое изменение свойств, и расположил эти отрезки один под другим. Как известно, таблица Менделеева в ее так называемой коротко-пернодной форме (табл. 2 на первом форзаце книги) подразделяется на семь горизонтальных периодов и восемь вертикальных групи. [c.36]
Периодическяя система и ее связь со строением атомов. Заполнение электронных слоев и оболочек атомов. Периодическое изменение свойств элементов.. Атомшле и ионные радиусы. Энергия ионизации, сродство к электрону, гэлектроотрицательность. [c.179]
Московитин Н. Н. Развитие понятия масса атома мера сложности структуры и периодического изменения свойств атомов // Научно-технической конф. Московского лесотехнического ин-та Тез. докл.— 1963.— С. 5. [c.203]
Из приведенных примеров ясно, что концепция электроотрицательностей не всегда приводит к правильным результатам, поэтому пользоваться ею можно при качественных прогнозах с известной осторожностью. Попытки улучшить ппсалу ЭО и придать ей квантовомеханическую основу продолжаются до настоящего вермени [44]. Это только подчеркивает, что в отличие от ПИ и СЭ понятие ЭО не имеет строгого физического обоснования. Удачные во многих случаях коореляции между Л(ЭО) и свойс?
