Какие ионы проявляют только окислительные свойства
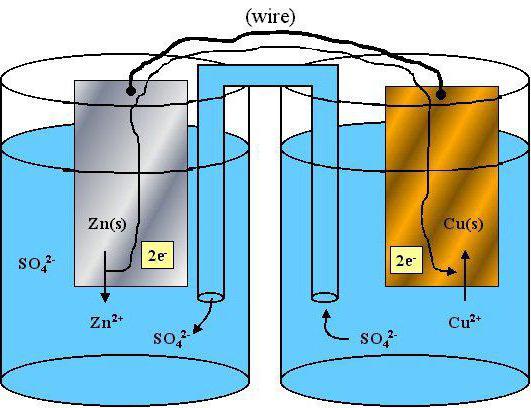
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
— S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn+7 принимает 5 e = Mn+2 2 является окислителем,
— 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
— Mn+7 принимает 5 e= Mn+2 2,
— S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
— нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
— Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
— 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Окислителями могут быть нейтральные атомы и молекулы; положительно Заряженные ионы металлов; сложные ионы и молекулы, содержащие атомы металла в состоянии высокой степени окисления; сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления; положительно заряженные ионы водорода (в некоторых кислотах, щелочах и воде).
Нейтральные атомы. Окислителями являются атомы элементов, имеющие на внешнем уровне 7, 6, 5 и 4 электрона. Это p-элементы ( — ). Из них типичными окислителями являются неметаллы (в виде простых веществ и др.), которые характеризуются большим сродством к электрону. Проявляя окислительные свойства, они могут принимать электроны (до 8):
Самые сильные окислители — атомы галогенов и кислород — принимают соответственно один и два электрона.
Самые слабые окислители — атомы четвертой главной подгруппы — принимают четыре электрона.
В главных подгруппах IV, V, VI и VII окислительные свойства падают с возрастанием величин радиусов атомов. Следоватедьно, из нейтральных атомов самый сильный окислитель — фтор, самый слабый — свинец.
Все перечисленные элементы (за исключением и ) могут при взаимодействии с сильными окислителями отдавать электроны, т. е. проявлять восстановительные свойства:
Поэтому их называют также окислителями — восстановителями. У неметаллов окислшельные свойства выражены сильнее, чем восстановительные.
Положительно заряженные ионы металлов. Все положительно заряженные ионы металлов в той или иной степени проявляют окислительные свойства.
Из них более сильными окислителями являются положительно заряженные ионы в высокой степени окисления. Так, например, для ионов характерны восстановительные свойства, а для ионов , — окислительные. Последние в зависимости от условий реакции могут восстанавливаться как до ионов в низшей степени окисления, так и до нейтральных атомов, например:
Однако и ионы в низшей степени окисления (или катионы), обладая большим запасом энергии, чем нейтральные атомы, могут проявлять окислительные свойства при взаимодействии с типичными восстановителями, например:
Ионы благородных металлов ( и ) даже в низкой степени окисления являются сильными окислителями
Следует еще раз отметить, что чем более активен металл как восстановитель, тем менее он активен в состоянии иона как окислитель. И наоборот, чем менее активен металл как восстановитель, тем более он активен в состоянии иона как окислитель. Так, например, при переходе нейтральных атомов калия и серебра в ионное состояние и потенциалы ионизации первого порядка соответственно равны 415,6 и 724,5 кдж. Поэтому ион серебра обладает значительно большим сродством к электрону, чем ион так как энергия, выделяющаяся при присоединении электрона к положительному иону, равна энергии ионизации с обратным знаком.
Сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления.
Типичными окислителями являются вещества, содержащие атомы металла в состоянии наиболее высокой степени окисления (например, ), из которого они стремятся перейти в состояние с меньшей степенью окисления или в состояние с нулевой степенью окисления .
Например:
Сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления. Сильные окислительные свойства проявляют также неметаллы в состоянии высокой, а некоторые и в низкой положительной степени окисления. К числу этих окислителей относятся кислородные кислоты, их ангидриды и соли (например, , концентрированная и др.). Из данного состояния эти неметаллы стремятся перейти в состояния с более низкой степенью окисления.
Азотная кислота в зависимости от ее концентрации и активности восстановителя может принимать от 1 до 8 электронов:
Сильными окислителями являются также концентрированные серная, селеновая и теллуровая кислоты. В ряду окислительные свойства возрастают от серной к теллуровой кислоте. При этом в зависимости от активности восстановителя и условий протекания реакции они могут восстанавливаться до .
Например:
Общая характеристика кислородных соединений галогенов в зависимости от степени окисления может быть выражена следующим образом:
В ряду — — окислительные свойства и устойчивость уменьшаются. Помимо окислительной способности для и характерны реакции диспропорционирования:
В ряду окислительные свойства двух первых кислот очень похожи и выражены сильно, тогда как окислительные (и кислотные) свойства йодноватой кислоты выражены значительно слабее.
Хлорная кислота единственная из кислородных кислот хлора известна в свободном виде. При нагревании выше 92° С она подвергается внутримолекулярной реакции окисления — восстановления (нередко со взрывом):
или
Окислительные свойства значительно слабее, чем , и в разбавленных растворах она окислительных свойств практически не проявляет.
Окислительные свойства выражены сильнее, чем .
Ортоиодная кислота также проявляет окислительные свойства:
Как и кислородные кислоты галогенов, окислительно-восстановительные свойства проявляют их соли, которые используются главным образом как окислители.
Кислородные соединения хлора, брома и иода, проявляя окислительные свойства, восстанавливаются в зависимости от условий реакции до свободного состояния или до отрицательно заряженного иона, например:
Окислительные свойства проявляют также положительно заряженные ионы водорода (в некоторых кислотах, щелочах и воде), что может быть использовано для получения в лабораторных условиях водорода. Его получают взаимодействием разбавленных растворов соляной, серной, ортофосфорной и уксусной кислот с цинком, железом, магнием, марганцем, алюминием и др., например:
Из оснований (, КОН, ) положительные ионы водорода восстанавливаются алюминием, кремнием, цинком, оловом и др., например:
Ионами водорода воды окисляются наиболее активные металлы (I и II главных подгрупп, кроме магния).
Таким образом, если атомы находятся в степенях окисления (например, азот, мышьяк, сера, селен и теллур в соединениях , ), то они, являясь в отрицательной степени окисления ( и ), могут быть только восстановителями, так как на их внешнем уровне находится по 8 электронов и они не могут более принимать электроны.
Азот, мышьяк, сера, селен, теллур, марганец и хром в кислотах и их солях, а также в находятся в высшей (т. е. максимальной) степени окисления , , и ), и следовательно, могут проявлять только окислительные свойства.
В кислотах , и их солях, а также в , азот, мышьяк, сера, селен, теллур и марганец находятся в промежуточной степенях окисления и . Эти соединения в зависимости от реакционной способности компонентов, с которыми они реагируют, и условий реакции могут проявлять как восстановительные, так и окислительные свойства.
Ниже показано, какие степени окисления могут иметь в соединениях азот, сера и марганец.
Окислительные свойства
Окислительные и восстановительные свойства
Только восстановительные свойства
Приведем примеры реакций, в которых вещества с промежуточной степенью окисления проявляют восстановительные или окислительные свойства:
Перекись водорода в зависимости от условий реакции проявляет окислительные или восстановительные свойства. Сера, селен, теллур в свободном состоянии при взаимодействии с водородом или металлами проявляют окислительные свойства, а с кислородом, фтором или хлором — восстановительные. Водород, как правило, является восстановителем, но по отношению к щелочным и щелочноземельным металлам он выступает как окислитель:
Иод при взаимодействии с сильными восстановителями ведет себя как окислитель, а с сильными окислителями — как восстановитель:
