Какие химические свойства кислорода

 Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16О, 17О и 18О (преобладает 16О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.

Строение молекулы озона
3О2 = 2О3 – 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2
2. В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:
2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
Оксида марганца (+4) MnO2:
4MnO2 = 2Mn2O3 + O2↑ (700 oC),
3MnO2 = 2Mn3O4 + O2↑ (1000 oC),
Пероксид бария BaO2 :
2BaO2 = 2BaO + O2↑
3. Разложением пероксида водорода:
2H2O2 = H2O + O2↑ (катализатор MnO2)
4. Разложение нитратов:
2KNO3 → 2KNO2 + O2
На космических кораблях и подводных лодках кислород получают из смеси K2O2 и K2O4:
2K2O4 + 2H2O = 4KOH +3O2↑
4KOH + 2CO2 = 2K2CO3 + 2H2O
Суммарно:
2K2O4 + 2CO2 = 2K2CO3 + 3О2 ↑
Когда используют K2O2, то суммарная реакция выглядит так:
2K2O2 + 2CO2 = 2K2CO3 + O2 ↑
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода
 Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
 Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
 Кислород легко реагирует с щелочными и щелочноземельными металлами:
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O2 → 2Li2O,
2K + O2 → K2O2,
2Ca + O2 → 2CaO,
2Na + O2 → Na2O2,
2K + 2O2 → K2O4
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O2 → Fe3O4
2Mg + O2 → 2MgO
2Cu + O2 → 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O2 → SO2,
C + O2 → CO2,
2H2 + O2 → H2O,
4P + 5O2 → 2P2O5,
Si + O2 → SiO2, и т.д
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H2S + 3O2 → 2SO2 + 2H2O (избыток кислорода),
2H2S + O2 → 2S + 2H2O (недостаток кислорода),
4NH3 + 3O2 → 2N2 + 6H2O (без катализатора),
4NH3 + 5O2 → 4NO + 6H2O (в присутствии катализатора Pt ),
CH4 (метан) + 2O2 → CO2 + 2H2O,
4FeS2 (пирит) + 11O2 → 2Fe2O3 + 8SO2.
Известны соединения, содержащие катион диоксигенила O2+, например, O2+ [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).

Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I— в растворе Kl:
O3 + 2Kl + H2O = I2 + O2 + 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.

Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)

В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Взаимодействие кислорода с простыми веществами
Кислороду присуща высокая химическая активность. Многие вещества реагируют с кислородом при комнатной температуре. Так, например, свежий срез яблока довольно быстро приобретает бурую окраску, это происходит вследствие химических реакций между органическими веществами, содержащимися в яблоке, и кислородом, содержащимся в воздухе. С простыми веществами кислород, как правило, реагирует при нагревании. В металлическую ложечку для сжигания веществ поместим уголек, нагреем его в пламени спиртовки докрасна и опустим в сосуд с кислородом. Наблюдаем яркое горение уголька в кислороде. Уголь – простое вещество, образованное элементом углеродом. В реакции кислорода с углеродом образуется углекислый газ:
C + O2 = CO2
Стоит отметить, что многие химические вещества имеют тривиальные названия. Углекислый газ – это тривиальное название вещества. Тривиальные названия веществ используются в повседневной жизни, многие из них имеют давнее происхождение. Например, пищевая сода, бертолетова соль. Однако у каждого химического вещества есть и систематическое химическое название, составление которого регламентируется международными правилами – систематической химической номенклатурой.
Так, углекислый газ имеет систематическое название оксид углерода (IV).
Углекислый газ является сложным веществом, бинарным соединением, в состав которого входит кислород. Поместим в ложечку для сжигания веществ серу и нагреем. Сера плавится, затем загорается. На воздухе сера горит бледным, почти незаметным, синим пламенем. Внесем серу в сосуд с кислородом – сера горит ярким синим пламенем. В реакции серы с кислородом образуется сернистый газ:
S + O2 = SO2
Сернистый газ, как и углекислый газ, относится к группе оксидов. Это оксид серы (IV) – бесцветный газ с резким едким запахом. Теперь внесем в сосуд с кислородом подожженный красный фосфор. Фосфор горит ярким, ослепительным пламенем. Сосуд заполняется белым дымом. Белый дым – это продукт реакции, мелкие твердые частицы оксида фосфора (V):
4P + 5O2 = 2P2O5
В кислороде способны гореть не только неметаллы. Металлы также энергично взаимодействуют с кислородом. Например, магний горит в кислороде и на воздухе ослепительным белым пламенем. Продукт реакции – оксид магния:
2Mg + O2 = 2MgO
Попробуем сжечь в кислороде железо. Раскалим в пламени спиртовки стальную проволоку и быстро опустим в сосуд с кислородом. Железо горит в кислороде с образованием множества искр. Вещество, полученное в результате реакции, называют железной окалиной:
3Fe + 2O2 = Fe3O4.
Снопы искр, образующихся при горении бенгальского огня, объясняются сгоранием порошка железа, входящего в состав этих пиротехнических изделий. После рассмотренных реакций можно сделать важные выводы: кислород реагирует как с металлами, так и неметаллами; часто эти реакции сопровождаются горением веществ. Продуктами реакций кислорода с простыми веществами являются оксиды. Обратите внимание, что при взаимодействии кислорода с простыми веществами – металлами и неметаллами образуются сложные вещества – оксиды. Такой тип химических реакций называют реакциями соединения.
Реакция соединения – реакция, в результате которой из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
Взаимодействие кислорода со сложными веществами
Кислород способен вступать в реакции и со сложными веществами. В качестве примера рассмотрим реакцию, которая протекает при горении бытового газа, который состоит из метана CH4. По горению метана в конфорке печи можно сделать выводы, что реакция протекает с выделением энергии в виде тепла и света. Каковы продукты этой реакции?
СН4 + 2О2 = СО2 + 2Н2О.
Продукты реакции оксиды: углекислый газ (оксид углерода (IV)) и вода (оксид водорода). В реакции кислорода с минералом пиритом FeS2 (важный минерал железа и серы) получают оксиды серы и железа. Реакция происходит при нагревании:
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
Окисление – горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
С химической точки зрения горение – это химическая реакция, сопровождающаяся выделением потока раскаленных газов и энергии в виде тепла и света. Можно сказать, что кислород, вступая в реакцию с простыми веществами, окисляет их:
Простое вещество + Кислород окисление → Продукты окисления (оксиды) + Энергия.
Окисление веществ может и не сопровождаться горением, то есть выделением пламени. Такие процессы называют медленным окислением. Медленное окисление – процесс постепенного взаимодействия веществ с кислородом, с медленным выделением теплоты, не сопровождающийся горением. Так, например, углекислый газ образуется не только при горении углерода в кислороде, но и при медленном окислении органических веществ кислородом воздуха (гниении, разложении).
Итог статьи:
- В реакции простых веществ с кислородом, образуются оксиды
- Реакции простых веществ с кислородом протекают, как правило, при нагревании
- Реакции простых веществ с кислородом – это реакции соединения
- Тривиальные названия химических веществ не отражают химического состава веществ, используются в повседневной практике, многие из них сложились исторически
- Систематические названия химических веществ отражают химический состав вещества, соответствуют международной систематической номенклатуре
- Реакция соединения – реакция, в результате которой, из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
- Кислород способен реагировать со сложными веществами
- Горение – химическая реакция, сопровождающаяся выделением энергии в виде тепла и света
- Медленное окисление – процесс постепенного взаимодействия веществ с кислородом, с медленным выделением теплоты, не сопровождающийся горением
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]() С в электрической дуге, в природе – при грозовом разряде). Например:
С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t![]() );
);
4NH3 + 3O2 = 2N2↑ + 6H2O (t![]() );
);
4NH3 + 5O2 = 4NO↑ + 6H2O (t![]() , kat);
, kat);
2PH3 + 4O2 = 2H3PO4 (t![]() );
);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t![]() ).
).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t![]() );
);
2SO2 + O2 = 2SO3 (t![]() , V2O5);
, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t![]() ).
).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
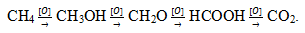
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]() С растворяется 3
С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
