Какие химические свойства характерны для всех металлов чем это обусловлено
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
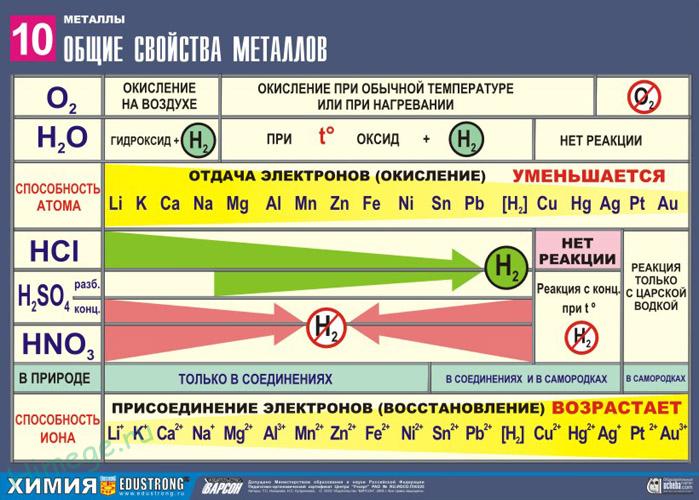
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
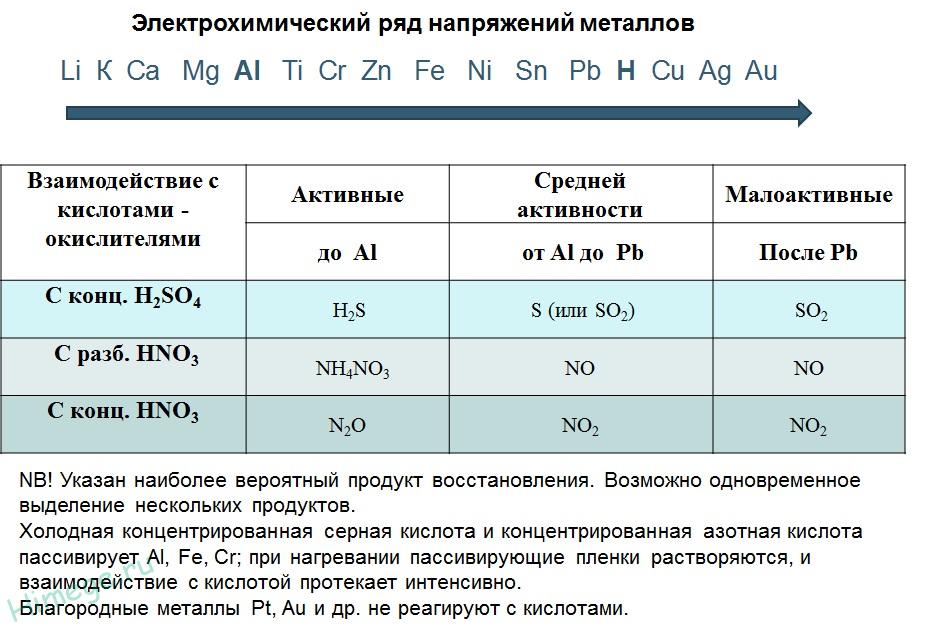
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4

В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.

Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития
пероксид натрия
надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
При взаимодействии с активными металлами вариантов реакций ещё больше:
Задания для подготовки к экзамену по неорганической химии
Укажите важнейшие классы неорганических соединений и приведите по одному примеру каждого из них.
2. Что такое основные оксиды? Напишите уравнения взаимодействия одного из них с: а) водой; б) кислотным оксидом; в) соляной кислотой.
3. Что такое основания и чем определяется кислотность оснований? Приведите по одному примеру: а) одно- ; б) двух- ; и в) трёхкислотного основания.
4. Как называются соединения, которые образуются при взаимодействии растворов кислот и оснований? На какие типы они классифицируются? Приведите соответствующие формулы.
Какая реакция называется гомогенной? Какая из реакций относится к этому типу: а) ;б) ; в) ?
6. От каких основных факторов, зависит скорость химической реакций? Кратко охараутеризуйте действие каждого из них.
7. Зависитли скорость реакции от температуры? Сформулируйте правило Вант-Гоффа, для каких реакций оно применимо?
8. Сформулируйте закон действия масс. Напишите кинетические уравнения прямой и обратной реакций: .
Какие реакции называются гетерогенными? Какая из реакций относится к этому типу: а) ; б) ; в) ?
10. Сформулируйте закон Гесса и следствия из закона.
11. Что такое энтальпия системы, как она обозначается и в каких единицах измеряется?
12. Что такое амфотерность? Какие металлы относятся к амфотерным?
13. В чем сущность основных способов защиты металлов от коррозии?
14. Какое явление называется электрохимической коррозией металлов? Приведите пример.
15. Какое явление называется химической коррозией металлов? Приведите пример.
16. Что такое ряд активности металлов? Каким образом активность металлов связана с положением металла в ряду активности?
17. Составьте электронные формулы атома в нормальном и возбужденном состояниях. Какая степень окисления характерна для этого элемента?
18. Какие металлы относятся к щелочным и к щелочноземельным, почему они так называются?
19. В чем сущность процесса электролиза? Какие процессы происходят на аноде и катоде?
Какие общие физические свойства характерны для металлов? Чем они обусловлены?
Какие общие химические свойства характерны для металлов? Чем они обусловлены?
22. Сформулируйте закон Фарадея для процесса электролиза и напишите его обобщенную математическую формулу.
23. Что такое: а) окисление; б) восстановление; в) степень окисления?
24. Какой физический смысл константы скорости химической реакции? От каких факторов она зависит?
25. Что такое степень окисления? В чем отличие между степенью окисления и валентностью атомов?
26. Составьте электронные формулы атома и иона .
27. Что такое моль вещества, сколько структурных единиц вещества входит в состав одного моля?
28. Какой вид связи характерен для металлов? Каковы особенности возникновения и свойства связи?
29. Как называются соединения, которые образуются при взаимодействии растворов кислот и оснований? На какие типы они классифицируются? Приведите соответствующие формулы.
30. Какие устройства называются химическими источниками тока? На какие типы они подразделяются? Дайте краткую характеристику каждого типа.
31. Рассчитайте стехиометрические коэффициенты в уравнении реакции: .
32. Рассчитайте стехиометрические коэффициенты в уравнении реакции: .
33. Рассчитайте стехиометрические коэффициенты в уравнении реакции: .
34. Рассчитайте стехиометрические коэффициенты в уравнении реакции: .
35. Рассчитайте стехиометрические коэффициенты в уравнении реакции: .
36. Электролиз водного раствора сульфата калия проводили при силе тока 2 А в течение двух часов. Рассчитайте объем газа, выделившегося на катоде, если выход по току равен 88%.
37. При электролизе водного раствора сульфата меди на аноде выделилось 0,168 дм3 кислорода (н.у.). Какая масса меди образовалась при этом на катоде?
38. Масса анода в процессе электролиза водного раствора нитрата серебра уменьшилась на 5,4 г. Какое количество электричества израсходовано?
39. При электролизе водного раствора сульфата цинка в течение 5 часов образовалось 6 дм3 кислорода. При какой силе тока проводился электролиз, если выход по току составляет 67%?
40. Рассчитайте количество электричества (Кл), необходимое для получения 400 г едкого натра при электролизе водного раствора сульфита натрия, если выход по току составляет 95%.
41. Температурный коэффициент скорости реакции равен двум. Во сколько раз уменьшится её скорость, если понизить температуру на 40 градусов?
42. Вычислите температуру кристаллизации водного раствора мочевины (NH2)2CO,содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86.
43. При температуре , скорость реакции равна . Какова скорость реакции при , если температурный коэффициент скорости реакции равен двум?
44. Раствор, содержащий 3,04 г камфоры C10H16O в 100 г бензола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислите эбуллиоскопическую константу бензола.
45. Как изменится скорость реакции ,если концентрация увеличилась в 2 раза, а концентрация уменьшилась в 2 раза?
46. Во сколько раз изменится скорость химической реакции при увеличении температуры на , если температурный коэффициент скорости реакции равен трем?
47. При увеличении температуры на скорость реакции возросла в 9 раз. Во сколько раз изменится её скорость, при увеличении температуры на ?
48. 200г газообразного вещества с молярной массой 29г/моль находятся под давлением 200кПа при температуре 200К. Определите объем системы.
49. 100г газообразного вещества с молярной массой 10г/моль при температуре 310К занимают объем 200дм3. Определите давление в системе.
50. 100г газообразного вещества с молярной массой 10г/моль при температуре 310К занимают объем 200дм3. Определите давление в системе.
51. Как изменится скорость реакции: ,если: а) увеличить концентрацию водорода в 3 раза; б) уменьшить давление в системе в 3 раза?
52. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения этана С2Н6 (г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделяется при сгорании 1 м3 этана в пересчете на н.у.?
53. Вычислите Δ Go298 реакции, протекающей по уравнению: СО (г) + 3 Н2 (г) = СН4 (г) + Н2О (г). Возможна ли эта реакция при стандартных условиях?
54. Как изменится скорость реакции: , если концентрация увеличилась в 2 раза, а концентрация уменьшилась в 2 раза?
55. Рассчитайте теоретическое количество электричества, которое следует пропустить через водный раствор хлорида меди, чтобы выделить 6,5 г металла.
56. При электролизе водного раствора сульфата меди на аноде выделилось 0,168 дм3 кислорода (н.у.). Какая масса меди образовалась при этом на катоде?
57. Какой объем газа (н.у.) выделится при электролизе расплава хлорида лития, если затрачено 5200 Кл электричества, а выход по току составляет 75%.
58. Составьте уравнения реакций последовательных превращений: Fe2O3 → FeCl3 → Fe(OH)3 → Fe2O3
59. Рассчитайте массу чугуна, содержащего 2% углерода, которую можно получить из 5 т железной руды, содержащей 70% FeS2.
60. Определите какой процент примесей содержится в техническом цинке, если при растворении 16 г этого металла в избытке соляной кислоты выделилось 4,48 дм3 водорода (н.у.).
61. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/дм3. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
62. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/ дм3. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/ дм3?
63. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
64. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизируется при 5,296 0С. Температура кристаллизации бензола 5,5 0С. Криоскопическая константа 5,1. Вычислите молярную массу растворенного вещества.
65. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора?
66. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5×10-4. Начальная концентрация N2O = 6,0 моль/дм3. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O.
67. Какой объём 10%-ного раствора карбоната натрия (пл. 1, 105 г/см3) требуется для приготовления 5 дм3 2%-ного раствора (пл. 1,02 г/см3)?
68. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора.
69. В гомогенной системе A + 2B = C равновесные концентрации реагирующих газов: [A] = 0,06 моль/ дм3; [B] = 0,12 моль/ дм3; [C] =0,216 моль/ дм3. Вычислите константу равновесия системы и исходные концентрации веществ A и B.
70. Реакция идет по уравнению Н2 + I2 = 2 HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2] = 0,04 моль/ дм3 ; [I2] = 0,05 моль/ дм3. Вычислите начальную скорость реакции и её скорость, когда [Н2] = 0,03 моль/ дм3.
71. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж).
72. Реакция идет по уравнению N2 + O2 = 2 NO. Концентрация исходных веществ до начала реакции были: [N2] = 0,049 моль/ дм3; [О2] = 0,01 моль/ дм3. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/ дм3.
73. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив её тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 дм3 аммиака в пересчете на н.у.?
74. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерода CS2 (г). Напишите термохимическое уравнение этой реакции, вычислив её тепловой эффект.
75. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей у атомов последнего элемента?
76. Напишите электронные формулы ионов Zn2+, Cl¯ и Al 3+ . К какому электронному семейству относится каждый из этих элементов?
77. Сколько молей заключает в себе 3 м3 любого газа при н.у.? Какое число молекул содержится в этом объёме?
78. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
79. Какая масса NaOH потребуется для полной нейтрализации 9,797 г ортофосфорной кислоты?
80. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 дм3 водорода (н.у.). Вычислите молярную массу металла.
81. Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
82. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в растворе сульфата никеля с концентрацией 0,001 моль/дм3, а другой такой же электрод – в растворе сульфата никеля с концентрацией 0,01 моль/ дм3.
83. Цинковую пластинку и цинковую пластинку, частично покрытую медью опустили в раствор соляной кислоты. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
84. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KBr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А?
85. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде?
86. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения реакций, протекающих на катоде и аноде. Какой концентрации надо было бы взять ионы железа (моль/ дм3), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/ дм3?
87. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/дм3. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/дм3?.
88. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH.
89. Могут ли происходить окислительно-восстановительные реакции между веществами: а) PH3 и HBr; б) K2Cr2O7 и H3PO3; в) HNO3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: AsH3+HNO3 → H3AsO4+NO2+H2O.
90. Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) K2CO3 и HCl; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
Дата добавления: 2017-02-11; просмотров: 388 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
