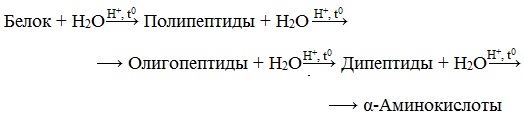Какие химические свойства белков

По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
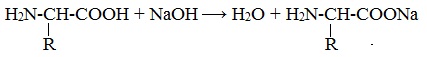
При действии же кислот он выступает в форме катиона:
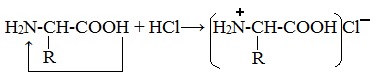
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
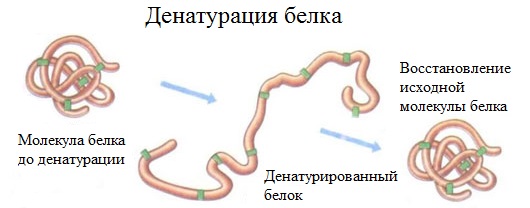
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.

![]()
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: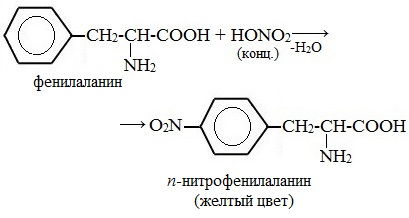
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

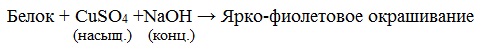
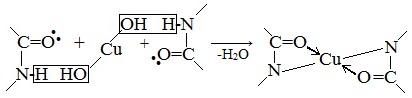
Причина появления окраски – образование комплексных соединений с координационным узлом: 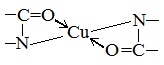
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

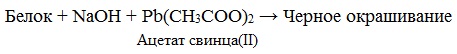
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Áåëêè – ïðèðîäíûå ïîëèïåïòèäû ñ îãðîìíîé ìîëåêóëÿðíîé ìàññîé. Îíè âõîäÿò â ñîñòàâ âñåõ æèâûõ îðãàíèçìîâ è âûïîëíÿþò ðàçëè÷íûå áèîëîãè÷åñêèå ôóíêöèè.
Ñòðîåíèå áåëêà.
Ó áåëêîâ ñóùåñòâóåò 4 óðîâíÿ ñòðîåíèÿ:
- ïåðâè÷íàÿ ñòðóêòóðà áåëêà – ëèíåéíàÿ ïîñëåäîâàòåëüíîñòü àìèíîêèñëîò â ïîëèïåïòèäíîé öåïè, ñâåðíóòûõ â ïðîñòðàíñòâå:

- âòîðè÷íàÿ ñòðóêòóðà áåëêà – êîíôîðìàöèÿ ïîëèïåïòèäíîé öåïè, ò.ê. ñêðó÷èâàíèå â ïðîñòðàíñòâå çà ñ÷åò âîäîðîäíûõ ñâÿçåé ìåæäó NH è ÑÎ ãðóïïàìè. Åñòü 2 ñïîñîáà óêëàäêè: α-ñïèðàëü è β— ñòðóêòóðà.
α-ñïèðàëü Íà îäíîì âèòêå óêëàäûâàþòñÿ 4 àìèíîêèñëîòíûõ îñòàòêà, êîòîðûå íàõîäÿòñÿ ñíàðóæè ñïèðàëè. |
β-ñòðóêòóðà. Ïîëèïåïòèäíàÿ öåïü ðàñòÿíóòà, åå ó÷àñòêè ðàñïîëàãàþòñÿ ïàðàëëåëüíû äðóã äðóãó è óäåðæèâàþòñÿ âîäîðîäíûìè ñâÿçÿìè. |
- òðåòè÷íàÿ ñòðóêòóðà áåëêà – ýòî òðåõìåðíîå ïðåäñòàâëåíèå çàêðó÷åííîé α-ñïèðàëü èëè β-ñòðóêòóðû â ïðîñòðàíñòâå:

Ýòà ñòðóêòóðà îáðàçóåòñÿ çà ñ÷åò äèñóëüôèäíûõ ìîñòèêîâ –S-S- ìåæäó öèñòåèíîâûìè îñòàòêàìè.  îáðàçîâàíèè òàêîé ñòðóêòóðû ó÷àñòâóþò ïðîòèâîïîëîæíî çàðÿæåííûå èîíû.
- ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà îáðàçóåòñÿ çà ñ÷åò âçàèìîäåéñòâèÿ ìåæäó ðàçíûìè ïîëèïåïòèäíûìè öåïÿìè:

Ñèíòåç áåëêà.
 îñíîâå ñèíòåçà ëåæèò òâåðäîôàçíûé ìåòîä, â êîòîðîì ïåðâàÿ àìèíîêèñëîòà çàêðåïëÿåòñÿ íà ïîëèìåðíîì íîñèòåëå, à ê íåé ïîñëåäîâàòåëüíî ïîäøèâàþòñÿ íîâûå àìèíîêèñëîòû. Ïîñëå ïîëèìåð îòäåëÿþò îò ïîëèïåïòèäíîé öåïè.
Ôèçè÷åñêèå ñâîéñòâà áåëêà.
Ôèçè÷åñêèå ñâîéñòâà áåëêà îïðåäåëÿþòñÿ ñòðîåíèåì, ïîýòîìó áåëêè äåëÿò íà ãëîáóëÿðíûå (ðàñòâîðèìûå â âîäå) è ôèáðèëëÿðíûå (íåðàñòâîðèìûå â âîäå).
Õèìè÷åñêèå ñâîéñòâà áåëêîâ.
1. Äåíàòóðàöèÿ áåëêà (ðàçðóøåíèå âòîðè÷íîé è òðåòè÷íîé ñòðóêòóðû ñ ñîõðàíåíèåì ïåðâè÷íîé). Ïðèìåð äåíàòóðàöèè – ñâåðòûâàíèå ÿè÷íûõ áåëêîâ ïðè âàðêå ÿèö.
2. Ãèäðîëèç áåëêîâ – íåîáðàòèìîå ðàçðóøåíèå ïåðâè÷íîé ñòðóêòóðû â êèñëîì èëè ùåëî÷íîì ðàñòâîðå ñ îáðàçîâàíèåì àìèíîêèñëîò. Òàê ìîæíî óñòàíîâèòü êîëè÷åñòâåííûé ñîñòàâ áåëêîâ.
3. Êà÷åñòâåííûå ðåàêöèè:
Áèóðåòîâàÿ ðåàêöèÿ – âçàèìîäåéñòâèå ïåïòèäíîé ñâÿçè è ñîëåé ìåäè (II) â ùåëî÷íîì ðàñòâîðå. Ïî îêîí÷àíèþ ðåàêöèè ðàñòâîð îêðàøèâàåòñÿ â ôèîëåòîâûé öâåò.
Êñàíòîïðîòåèíîâàÿ ðåàêöèÿ — ïðè ðåàêöèè ñ àçîòíîé êèñëîòîé íàáëþäàåòñÿ æåëòîå îêðàøèâàíèå.
Áèîëîãè÷åñêîå çíà÷åíèå áåëêà.
1. Áåëêè – ñòðîèòåëüíûé ìàòåðèàë, èç íåãî ïîñòðîåíû ìûøöû, êîñòè, òêàíè.
2. Áåëêè — ðåöåïòîðû. Ïåðåäàþò è âîñïðèíèìàþò ñèãíàë, ïîñòóïàþùèõ îò ñîñåäíèõ êëåòîê èç îêðóæàþùåé ñðåäû.
3. Áåëêè èãðàþò âàæíóþ ðîëü â èììóííîé ñèñòåìå îðãàíèçìà.
4. Áåëêè âûïîëíÿþò òðàíñïîðòíûå ôóíêöèè è ïåðåíîñÿò ìîëåêóëû èëè èîíû â ìåñòî ñèíòåçà èëè íàêîïëåíèÿ. (Ãåìîãëîáèí ïåðåíîñèò êèñëîðîä ê òêàíÿì.)
5. Áåëêè – êàòàëèçàòîðû – ôåðìåíòû. Ýòî î÷åíü ìîùíûå ñåëåêòèâíûå êàòàëèçàòîðû, êîòîðûå óñêîðÿþò ðåàêöèè â ìèëëèîíû ðàç.
Åñòü ðÿä àìèíîêèñëîò, êîòîðûå íå ìîãóò ñèíòåçèðîâàòüñÿ â îðãàíèçìå — íåçàìåíèìûå, èõ ïîëó÷àþò òîëüêî ñ ïèùåé: òèçèí, ôåíèëàëàíèí, ìåòèíèí, âàëèí, ëåéöèí, òðèïòîôàí, èçîëåéöèí, òðåîíèí.
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
Урок №58. Белки – природные полимеры. Состав и строение белков.
«Жизнь, есть способ существования
белковых тел»
Ф. Энгельс.
Прочитайте материал:
Ни один из известных нам живых организмов не обходится
без белков. Белки служат питательными веществами, они регулируют обмен веществ,
исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу
кислорода по всему организму и его поглощению, играют важную роль в
функционировании нервной системы, являются механической основой мышечного
сокращения, участвуют в передаче генетической информации и т.д.
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными
(амидными) связями. В состав этих биополимеров входят мономеры 20 типов.
Такими мономерами являются аминокислоты. Каждый белок по своему химическому
строению является полипептидом. Некоторые белки состоят из нескольких
полипептидных цепей. В составе большинства белков находится в среднем 300-500
остатков аминокислот. Известно несколько очень коротких природных белков,
длиной в 3-8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500
аминокислот. Образование белковой
макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Аминокислоты соединяются друг с другом за счёт
образования новой связи между атомами углерода и азота – пептидной (амидной):
Из двух
аминокислот (АК) можно получить дипептид, из трёх – трипептид, из большего
числа АК получают полипептиды (белки).
Функции белков
Функции белков в природе универсальны. Белки входят в
состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д.
Основным источником α — аминокислот
для живого организма служат пищевые белки, которые в результате ферментативного
гидролиза в желудочно-кишечном тракте дают α — аминокислоты. Многие α —
аминокислоты синтезируются в организме, а некоторые необходимые для синтеза
белков α — аминокислоты не
синтезируются в организме и должны поступать извне. Такие аминокислоты
называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин,
триптофан и др. (см. таблицу). При некоторых заболеваниях человека перечень
незаменимых аминокислот расширяется.
· Каталитическая функция — осуществляется с помощью специфических белков — катализаторов (ферментов).
При их участии увеличивается скорость различных реакций обмена веществ и
энергии в организме.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их
синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК. Известно
несколько тысяч ферментов. Среди них такие, как, например пепсин, расщепляют
белки в процессе пищеварения.
·
Транспортная функция — связывание и
доставка (транспорт) различных веществ от одного органа к другому.
Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом,
превращаясь в оксигемоглобин. Достигая с током крови органов и тканей,
оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения
окислительных процессов в тканях.
· Защитная функция — связывание и
обезвреживание веществ, поступающих в организм или появляющихся в результате
жизнедеятельности бактерий и вирусов.
Защитную функцию
выполняют специфические белки (антитела — иммуноглобулины), образующиеся в
организме (физическая, химическая и иммунная защита). Так, например, защитную
функцию выполняет белок плазмы крови фибриноген, участвуя в свертывании крови и
тем самым уменьшая кровопотери.
·
Сократительная функция (актин, миозин) –
в результате взаимодействия белков происходит передвижение в пространстве,
сокращение и расслабление сердца, движение других внутренних органов.
Структурная функция — белки
составляют основу строения клетки. Некоторые из них (коллаген соединительной
ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки, кератин шерсти,
фиброин шелка и др.) выполняют почти исключительно структурную функцию.
В комплексе с
липидами белки участвуют в построении мембран клеток и внутриклеточных
образований.
· Гормональная (регуляторная) функция —
способность передавать сигналы между тканями, клетками или организмами.
Выполняют
белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в
железах внутренней секреции, некоторых органах и тканях организма.
·
Питательная функция — осуществляется
резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин,
яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки
молока служат источником питания для новорожденного.
Разнообразные функции белков определяются
α-аминокислотным составом и строением их высокоорганизованных макромолекул.
Физические свойства белков
Белки – очень длинные молекулы,
которые состоят из звеньев аминокислот, сцепленных пептидными связями. Это –
природные полимеры, молекулярная масса белков колеблется от нескольких тысяч до
нескольких десятков миллионов. Например, альбумин молока имеет молекулярную
массу 17400, фибриноген крови – 400.000, белки вирусов – 50.000.000. Каждый
пептид и белок обладают строго определенным составом и последовательностью
аминокислотных остатков в цепи, это и определяет их уникальную биологическую специфичность.
Количество белков характеризует степень
сложности организма (кишечная палочка – 3000, а в человеческом организме более
5 млн. белков).
Первый белок, с которым мы знакомимся в
своей жизни, это белок куриного яйца альбумин — хорошо растворим в воде, при
нагревании свертывается (когда мы жарим яичницу), а при долгом хранении в тепле
разрушается, яйцо протухает. Но белок спрятан не только под яичной скорлупой.
Волосы, ногти, когти, шерсть, перья, копыта, наружный слой кожи — все они почти
целиком состоят из другого белка, кератина. Кератин не растворяется в воде, не
свертывается, не разрушается в земле: рога древних животных сохраняются в ней так
же хорошо, как и кости. А белок пепсин, содержащийся в желудочном соке,
способен разрушать другие белки, это процесс пищеварения. Белок инрерферон
применяется при лечении насморка и гриппа, т.к. убивает вызывающие эти болезни
вирусы. А белок змеиного яда способен убивать человека.
Классификация белков
С точки зрения пищевой ценности белков,
определяемой их аминокислотным составом и содержанием так называемых
незаменимых аминокислот, белки подразделяются на полноценные и неполноценные.
К полноценным белкам относятся преимущественно белки животного происхождения,
кроме желатины, относящейся к неполноценным белкам. Неполноценные белки —
преимущественно растительного происхождения. Однако некоторые растения
(картофель, бобовые и др.) содержат полноценные белки. Из животных белков
особенно большую ценность для организма представляют белки мяса, яиц, молока и
др.
В состав многих белков помимо пептидных
цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две
большие группы — простые и сложные белки (протеиды).
Простые белки содержат только аминокислотные цепи, сложные белки содержат также
неаминокислотные фрагменты (Например,
гемоглобин содержит железо).
По общему типу
строения белки можно разбить на три группы:
1.
Фибриллярные белки —
нерастворимы в воде, образуют полимеры, их структура обычно высокорегулярна и
поддерживается, в основном, взаимодействиями между разными цепями. Белки,
имеющие вытянутую нитевидную структуру. Полипептидные цепи многих фибриллярных
белков расположены параллельно друг другу вдоль одной оси и образуют длинные
волокна (фибриллы) или слои.
Большинство
фибриллярных белков не растворяются в воде. К фибриллярным белкам относят
например, α-кератины (на их
долю приходится почти весь сухой вес волос, белки шерсти, рогов, копыт, ногтей, чешуи, перьев), коллаген — белок сухожилий и хрящей, фиброин — белок шёлка).
2.
Глобулярные
белки —
водорастворимы, общая форма молекулы более или менее сферическая. Среди
глобулярных и фибриллярных белков выделяют подгруппы. К глобулярным белкам
относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы
(например, инсулин) а также другие белки, выполняющие транспортные,
регуляторные и вспомогательные функции.
3.
Мембранные белки — имеют
пересекающие клеточную мембрану домены, но части их выступают из мембраны в
межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию
рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают
трансмембранный транспорт различных веществ. Белки-транспортеры специфичны,
каждый из них пропускает через мембрану только определённые молекулы или
определённый тип сигнала.
Белки – неотъемлемая часть пищи животных
и человека. Живой организм отличается от неживого в первую очередь наличием
белков. Для живых организмов характерно огромное разнообразие белковых молекул
и их высокая упорядоченность, что и определяет высокую организацию живого
организма, а также способность двигаться, сокращаться, воспроизводиться,
способность к обмену веществ и к многим физиологическим процессам.
Строение белков
Фишер Эмиль Герман, немецкий химик-органик и биохимик. В 1899 начал
работы по химии белков. Используя созданный им в 1901 эфирный метод анализа
аминокислот, Ф. впервые осуществил качественные и количественные определения
продуктов расщепления белков, открыл валин, пролин (1901) и оксипролин (1902),
экспериментально доказал, что аминокислотные остатки связываются между собой
пептидной связью; в 1907 синтезировал 18-членный полипептид. Ф. показал
сходство синтетических полинептидов и пептидов, полученных в результате
гидролиза белков. Ф. занимался также изучением дубильных веществ. Ф. создал
школу химиков-органиков. Иностранный член-корреспондент Петербургской АН (1899).
Нобелевская премия (1902).
Разнообразные
функции белков определяются α-аминокислотным составом и строением их высокоорганизованных
макромолекул.
Выделяют 4 уровня структурной
организации белков:
1. | |
2. А) Б) | А Б |
3. | |
4. |
Молекула белка стремится не только к
реализации своей биоактивности, но и к наиболее компактной структуре, позволяющей
ей максимально реализовать свои функции.
Посмотрите учебный видеоматериал:
Перейдите по ссылке к знакомству с химическими свойствами белков: Свойства белков. Превращение белков в организме. Успехи в изучении и синтезе белков.
ЦОР:
Белки
Продукты,
содержащие животные белки
Продукты,
содержащие растительные белки
Строение
белков: вторичная структура
Строение
белков: третичная структура
Иллюстрация.
Четвертичная структура белка (на примере гемоглобина)
ТРЕНАЖЁРЫ:
Интерактив.
Биологические функции белков
Интерактив.
Свойства белков
ВИДЕО:
Качественные
реакции на белки: биуретовая и ксантопротеиновая
Свертывание
белков при нагревании
Осаждение
белков солями тяжелых металлов
Осаждение
белков спиртом
Биуретовая
реакция белков
Ксантопротеиновая
реакция белков
Качественное
определение азота в органических соединениях
«Нуклеиновые кислоты в биосинтезе белка» (источник YouTube)