Какие физические свойства неметаллов

1. Галогены
1) С кислородом из галогенов реагирует только фтор:
F2 + O2 → O2F2 (или OF2)
Cl2 + O2 → реакция не идет.
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
3) Все галогены взаимодействуют с водородом:
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaBr2 → CaCl2 + Br2
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
С сульфидами:
Br2 + Na2S → 2NaBr + S.
Если можем окислить металл:
Cl2 + 2FeCl2 → 2FeCl3
5) Все галогены реагируют с металлами:
3F2 + 2Fe → 2FeF3
3Br2 + 2Fe → 2FeBr3
Cl2 + Cu → CuCl2
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
I2 + Fe → FeI2
I2 + 2Cu — > 2CuI
6) Галогены — сильные окислители, окисляют такие сложные вещества, как H2S, H2O2, NH3, SO2 и др:
Br2 + H2S → S + 2HBr
H2O2 + Cl2 → 2HCl + O2
3Cl2 + 8NH3 → N2 + 6NH4Cl
Cl2 + 2FeCl2 → 2FeCl3
7) Не реагируют с оксидами
8) Не реагируют с кислотами за исключением одной реакции (только I2 и только с концентрированной азотной кислотой):
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t)
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
S + O2 → SO2
2) Реагирует с водородом:
S + H2 <=> H2S
3) Реагирует с металлами
S + Fe → FeS (t)
2Na + S → Na2S
4) Реагирует со всеми неметаллами, кроме N2, I2 и благородных газов:
S + N2 → реакция не идет
S + I2 → реакция не идет
5S + 2P → P2S5
2S + C → CS2
S + 3F2 → SF6
S + Br2 → SBr2
5) Реагирует с кислотами-окислителями:
S + 6HNO3(конц.)  → H2SO4 + 6NO2 + 2H2O
S + 2HNO3(разб.) → H2SO4 + 2NO
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
N2 + O2 → 2NO
2) Реагирует с водородом (обратимая, экзотермическая реакция):
N2 + 3H2 <=> 2NH3
3) Реагирует с металлами с образованием нитридов (с Li без нагревания, с остальными — только при нагревании):
N2 + 2Al → 2AlN (t)
N2 + 3Mg → Mg3N2 (t)
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
Основные аллотропные модификации: красный (атомная кристаллическая решетка) и белый (P4, молекулярная кристаллическая решетка). Белый фосфор — ядовитое вещество, самовоспламеняется на воздухе. Красный фосфор стабилен и ядовитым не является.
1) Реагирует с кислородом:
4P + 3O2 → 2P2O3 (недостаток O2)
4P + 5O2 → 2P2O5 (избыток O2)
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
4) Реагирует с кислотами-окислителями:
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
5) Окисляется сильными окислителями:
6P + 5KClO3 → 3P2O5 + 5KCl
6) Реагирует с металлами с образованием фосфидов:
P + Na → Na3P
2P + 3Ca → Ca3P2
7) Реагирует с серой, галогенами:
2P + 3Cl2  → 2PCl3 (недостаток Cl2)
2P + 5Cl2 → 2PCl5 (избыток Cl2)
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)
8) Реагирует с соединениями P+5:
3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
C + O2 → CO2
2) Реагирует с водородом:
С + 2H2 → CH4
3) Реагирует с кислотами-окислителями:
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
C + 4HNO3(конц.)  → CO2 + 4NO2 + 2H2O (t)
4) Используется при получении фосфора:
Ca3(PO4)2 + 5C + 3SiO2 → 5CO + 2P + 3CaSiO3
6. Кремний
1) Реагирует с кислородом:
Si + O2 → SiO2 (кварц, песок)
2) Не реагирует с водородом:
Si + H2 → реакция не идет.
3) Растворяется в щелочах:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
4) Не реагирует с растворами кислот. Реагирует только с HF:
Si + 4HF → SiF4 + 2H2 (t).
Все химические элементы условно можно разделить на неметаллы и металлы. Знаете ли вы, по каким признакам они отличаются? Как определить их положение в таблице химических элементов? На эти и другие вопросы вы найдете ответы в нашей статье.
Положение неметаллов и металлов: таблица Менделеева
По внешним признакам и физическим свойствам не всегда можно выяснить, к какой группе относится химический элемент. Свойства металлов и неметаллов можно определить по расположению в периодической таблице.
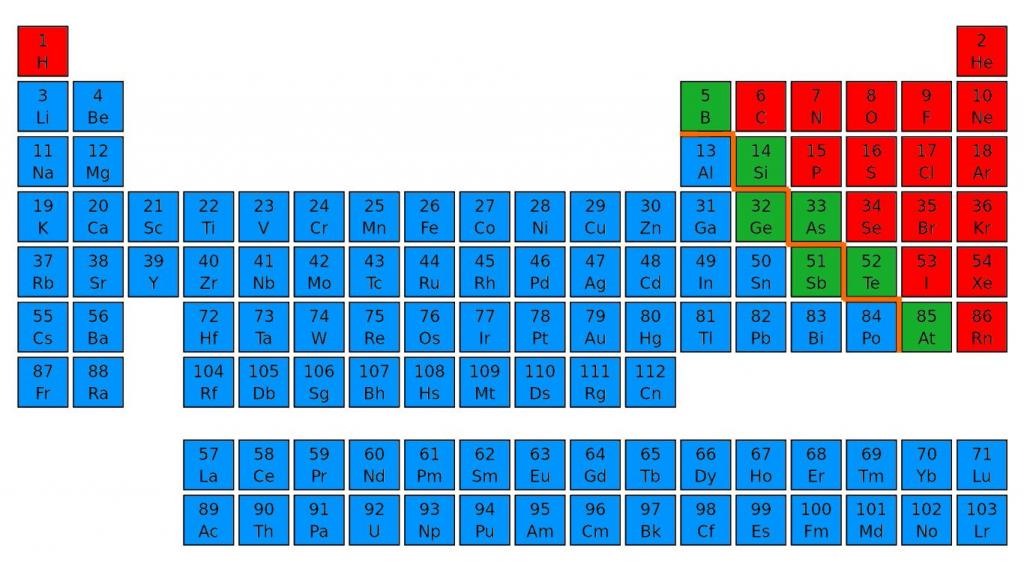
Для этого нужно зрительно провести диагональ от бора до астата, от 5 до 85 номера. В правом верхнем углу будут преимущественно находиться неметаллы. Их в таблице меньшинство, всего 22 элемента. Металлы находятся в правой части периодической таблицы наверху — в основном в I, II и III группах.
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.

Строение металлов и неметаллов: кристаллические решетки
Физические свойства веществ определяются порядком расположения элементарных частиц. Если условно соединить их воображаемыми линиями, то получится структура, которая называется кристаллической решеткой. В ее узлах могут находиться разные структуры: атомы, молекулы или заряженные частицы — ионы.
У некоторых неметаллов формируется атомная кристаллическая решетка, частицы которой соединены ковалентными связями. Вещества с таким строением твердые и нелетучие. К примеру, фосфор, кремний и графит.
В молекулярной кристаллической решетке связь между элементарными частицами слабее. Обычно подобные неметаллы находятся в жидком или газообразном агрегатном состоянии, но в некоторых случаях — это твердые легкоплавкие неметаллы.
В любом образце металла часть атомов теряет наружные электроны. При этом они превращаются в положительно заряженные частицы — катионы. Последние снова соединяются с электронами, образуя нейтрально заряженные частицы — в металлической решетке одновременно находятся катионы, электроны и атомы.

Физические свойства
Начнем с агрегатного состояния. Традиционно принято считать, что все металлы — твердые вещества. Исключением является только ртуть, тягучая жидкость серебристого цвета. Ее пары являются контаминантом — токсичным веществом, вызывающим отравление организма.
Еще одна характерная черта — металлический блеск, который объясняется тем, что поверхность металла отражает световые лучи. Еще одна важная особенность — электро- и теплопроводность. Это свойство обусловлено наличием в металлических решетках свободных электронов, которые в электрическом поле начинают двигаться направленно. Лучше всех проводит тепло и ток ртуть, наименьшими показателями обладает серебро.
Металлическая связь обусловливает ковкость и пластичность. По этим показателям лидирует золото, из которого можно раскатать лист толщиной в человеческий волос.
Чаще всего физические свойства металлов и неметаллов противоположны. Так, последние характеризуются невысокими показателями электро- и теплопроводности, отсутствием металлического блеска. При обычных условиях неметаллы находятся в газообразном или жидком состоянии, а твердые всегда хрупкие и легкоплавкие, что объясняется молекулярным строением неметаллов. Алмаз, красный фосфор и кремний — тугоплавкие и нелетучие, это вещества с немолекулярным строением.

Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли — типичные металлические свойства. С другой стороны, сурьма — очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.
