Какие физические свойства характерны для всех металлов


Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития
пероксид натрия
надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
При взаимодействии с активными металлами вариантов реакций ещё больше:
Общие физические свойства мекталлов:
1) Пластичность — способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду — Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду — Ag, Cu, Al, Fe уменьшается. При нагревании электропроводность уменьшается, т. к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло) ; самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий — литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т. пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Все металлы являются восстановителями. Для металлов главных подгрупп восстановительная активность (способность отдавать электроны) возрастает сверху вниз и справа налево. Например, Натрий и кальций вытесняют водород из воды уже при обычных условиях:
Ca + 2H2O Ca(OH)2 + H2¬ ; 2Na + 2H2O 2NaOH + H20
А магний при повышении температуры:
Mg + H2O –t MgO + H2
Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе окисляется, а золото нет; медь вытесняет серебро из его соли) :
Cu + 2AgNO3 → 2Ag ↓ + Cu(NO3)2
Cu0 -2 ē → Cu+2 1 О. О. В.
Ag+ + ē → Ag0 2 В. В. О.
Высшая положительная степень окисления для металлов главных подгрупп в их соединениях равна номеру группы (например, NaCl, MgCl2, AlCl3, SnCl4), а для металлов побочных подгрупп в их кислородосодержащих соединениях также часто совпадает с номером группы (например, ZnO, TiO2, V2O5, CrO3, KMnO4).
Свойства оксидов металлов слева направо по периоду и снизу вверх по группе изменяются от основных к амфотерным для металлов главных подгрупп (Na2O и MgO – основные оксиды, Al2O3 и BeO – амфотерные) . Для металлов побочных подгрупп свойства оксидов, в которых металлы проявляют свою высшую степень окисления, изменяются от основных через амфотерные к кислотным ( CuO — основной, ZnO — амфотерный, CrO3 — кислотный) .
Сила оснований, образуемых металлами главных подгрупп увеличивается справа налево по периоду и сверху вниз по группе ( Be(OH)2 и Al(OH)3– амфотерные гидроксиды, Mg(OH)2 — слабое основание, NaOHи – Ca(OH)2 сильные основания) . Гидраты оксидов металлов побочных подгрупп с высшими степенями окисления металла вдоль периода слева направо меняют свои свойства от оснований через амфотерные гидроксиды к кислотам ( Cu(OH)2 — основание, Zn(OH)2 — амфотерный гидроксид, H2CrO4 — кислота) .
В природе металлы встречаются в основном в виде соединений – оксидов или солей. Исключение составляют такие малоактивные металлы, как серебро, золото, платина, которые встречаются в самородном состоянии.
Все способы получения металлов основаны на процессах их восстановления из природных соединений.
Анонимный вопрос · 3 апреля 2018
14,0 K
Свойства металлов делятся на несколько групп: физические, химические, механические и технологические.
1) Физические свойства: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность.
2) Химические свойства: окисляемость, растворимость и коррозионная стойкость.
3) Механические свойства: прочность, твердость, упругость, пластичность.
4) Технологические свойства: прокаливаемость, жидкотекучесть, ковкость, обрабатываемость резанием.
Слишком примитивно, кое-что неверно, что-то устарело (терминология). Не советую использовать.
Существуют ли сплавы железа с пластиками?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Сплавов таких точно нет. Уж слижком разные это материалы. Железо — чистый металл. А пластмассы — это многокомпонентная смесь на основе полимеров. Можно создать сталь: добавляя легирующие элементы в железо: другие металлы и неметаллы (кремний, углерод и т.д..). Но в чем то Вы правы и ваша мысль выражена уже давно: в создании композитных материалов. Композитные материалы это многокомпонентные материалы, состоящие, как правило, из пластичной основы (матрицы), армированной наполнителями, обладающими высокой прочностью, жёсткостью и т. д..
Какие свойства характеризуют графит?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Физические: цвет от черного до стального серого, металлический блеск, жирный, пачкает пальцы, хрупкий, при воздействии расслаивается на части-чешуйки. Огнеупорен, проводит электричество, невысокая плотность.
Химические: не растворяется в кислотах, с некоторыми солями и щелочными металлами образует соединения наподобие включений. С кислородом реагирует при очень высокой температуре, образуя в итоге углекислый газ.
Что применяется для получения металлов?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Так как металлы в земной коре встречаются преимущественно в виде соединений в различных минералах (как правило: оксидов, гидроксидов, солей и т.д..), а в самородном состоянии могут находиться лишь неактивные металлы (такие как: медь, золото, серебро, платиновые металлы, ртуть). Поэтому металлы в основном получают из руд с помощью металлургических процессов. Любой металлургический процесс – это процесс восстановления металла с помощью различных восстановителей. Он состоит из трех основных этапов: обогащение руды, восстановление металлов из их соединений, очистка технических металлов.
Восстановительные процессы способов получения металлов делятся на следующие:
Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, алюминия, магния и др.
Гидрометаллургия – восстановление металлов из солей в растворе.
Электрометаллургия – восстановление металлов в процессе электролиза растворов и расплавов солей.
Как обозначается металл в химии?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Возможно, что под обозначением вы имеете в виде «Ме», так обозначают металлы в химии на общих схемах различных химических реакций (окисления, восстановления и т.д..) Но у каждого металла, как у простого вещества, есть свое принятое обозначение в таблице Менеделева: Fe (железо); Na (натрий) и т.д..

Металлы, это группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. В данной статье все свойства металлов будут представлены в виде отдельных таблиц.
Содержание

Свойства металлов
Свойства металлов делятся на физические, химические, механические и технологические.
Физические свойства металлов
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании.
Удельный вес металла — это отношение веса однородного тела из металла к объему металла, т.е. это плотность в кг/м3 или г/см3.
Плавкость металла — это способность металла расплавляться при определенной температуре, называемой температурой плавления.
Электропроводность металлов — это способность металлов проводить электрический ток, это свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля. Под электропроводностью подразумевается способность проводить прежде всего постоянный ток (под воздействием постоянного поля), в отличие от способности диэлектриков откликаться на переменное электрическое поле колебаниями связанных зарядов (переменной поляризацией), создающими переменный ток.
Магнитные свойства металлов характеризуются: остаточной индукцией, коэрцетивной силой и магнитной проницаемостью.
Теплопроводность металлов — это их способность передавать тепло от более нагретых частиц к менее нагретым. Теплопроводность металла определяется количеством теплоты, которое проходит по металлическому стержню сечением в 1см2, длиной 1см в течение 1сек. при разности температур в 1°С.
Теплоемкость металлов — это количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной).
Расширяемость металлов при нагревании.Все металлы при нагревании расширяются, а при охлаждении сжимаются. Степень увеличения или уменьшения первоначального размера металла при изменении температуры на один градус характеризуется коэффициентом линейного расширения.
Химические свойства металлов
К химическим — окисляемость, растворимость и коррозионная стойкость.
Окисление металлов — это реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). Если рассмотреть окисляемость шире, то это реакции, в которых атомы теряют электроны и образуются различные соединения, например, хлориды, сульфиды. В природе металлы находятся в основном в окисленном состоянии, в виде руд, поэтому их производство основано на процессах восстановления различных соединений.
Растворимость металлов — это их способность образовывать с другими веществами однородные системы — растворы, в которых металл находится в виде отдельных атомов, ионов, молекул или частиц. Металлы растворяются в растворителях, в качестве которых выступают сильные кислоты и едкие щелочи. В промышленности наиболее часто используются: серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкий калий.
Коррозионная стойкость металлов — это их способность сопротивляться коррозии.
Механические свойства металлов
К механическим — прочность, твердость, упругость, вязкость, пластичность.
Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь.
Твердостью металлов называется способность тела противостоять проникновению в него другого, более твердого тела.
Упругость металлов — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию).
Вязкость металлов — это способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам. Вязкость — свойство обратное хрупкости.
Пластичность металлов — это свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность—свойство обратное упругости.
Технологические свойства металлов
К технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
Прокаливаемость металлов – это их способность получать закаленный слой определенной глубины.
Жидкотекучесть металлов — это свойство металла в жидком состоянии заполнять литейную форму и воспроизводить ее очертания в отливке.
Ковкость металлов —это технологическое свойство, характеризующее их способность к обработке деформированием, например, ковкой, вальцеванием, штамповкой без разрушения.
Свариваемость металлов — это их свойство образовывать в процессе сварки неразъемное соединение, отвечающее требованиям, обусловленным конструкцией и эксплуатацией производимого изделия.
Обрабатываемость металлов резанием — это их способность изменять геометрическую форму, размеры, качество поверхности за счет механического срезания материала заготовки режущим инструментом. Обрабатываемость металлов зависит от их механических свойств, в первую очередь прочности и твердости.
Современными методами испытания металлов являются механические испытания, химический анализ, спектральный анализ, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах, а также определить качество готовых изделий.
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
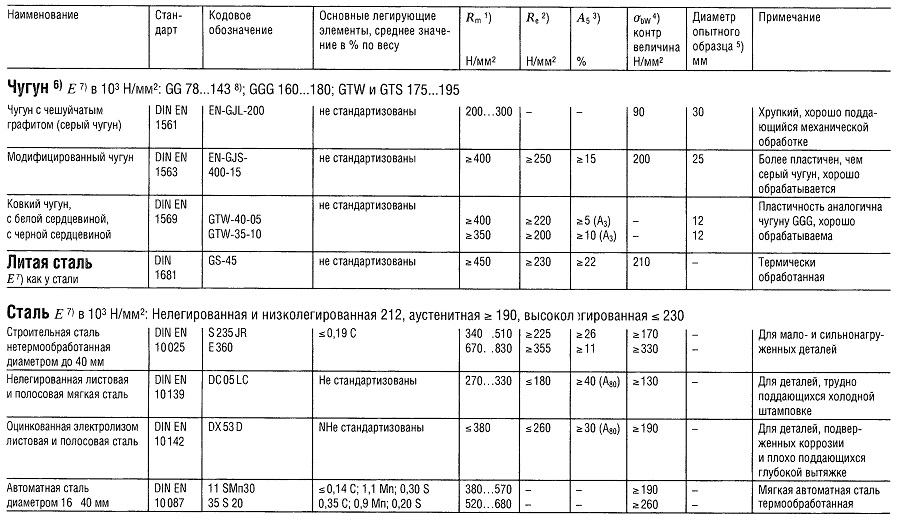
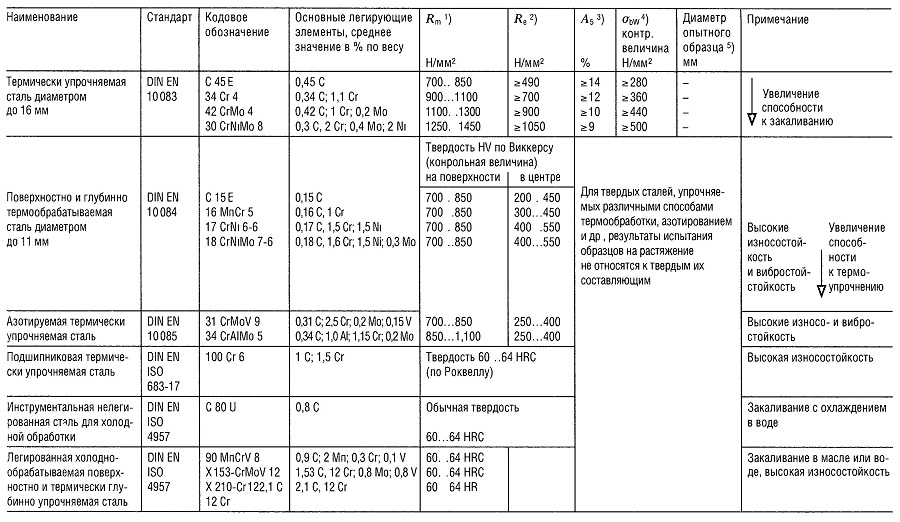
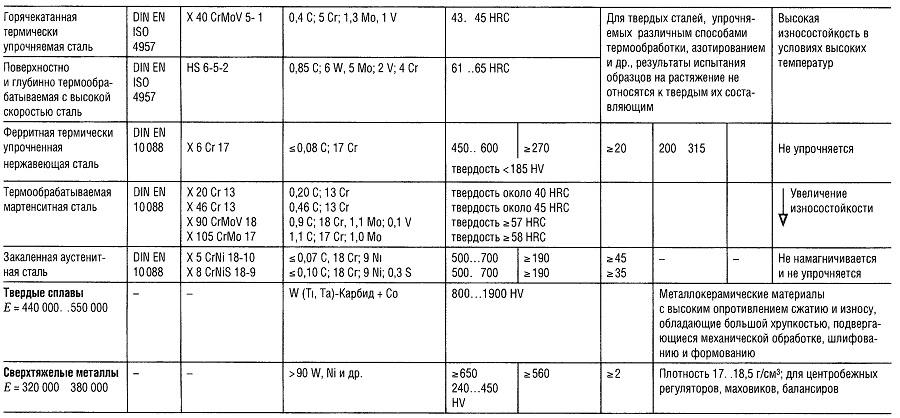
- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»
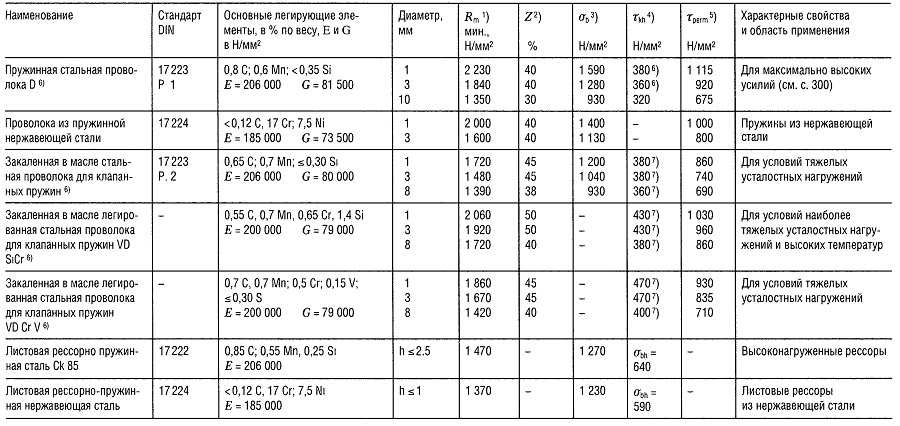
- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 107,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»,
- см. раздел «Способы соединения деталей»;
- 480 Н/мм2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
Таблица «Свойства кузовных тонколистовых металлов»
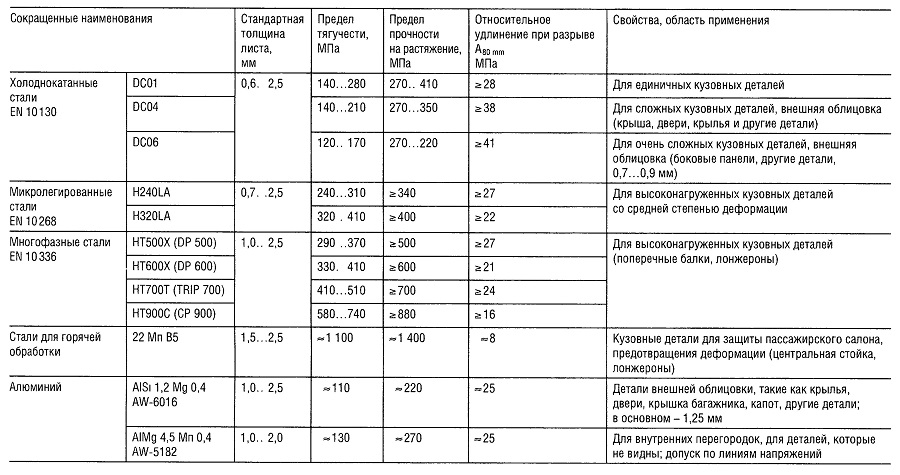
Таблица «Свойства цветных металлов»
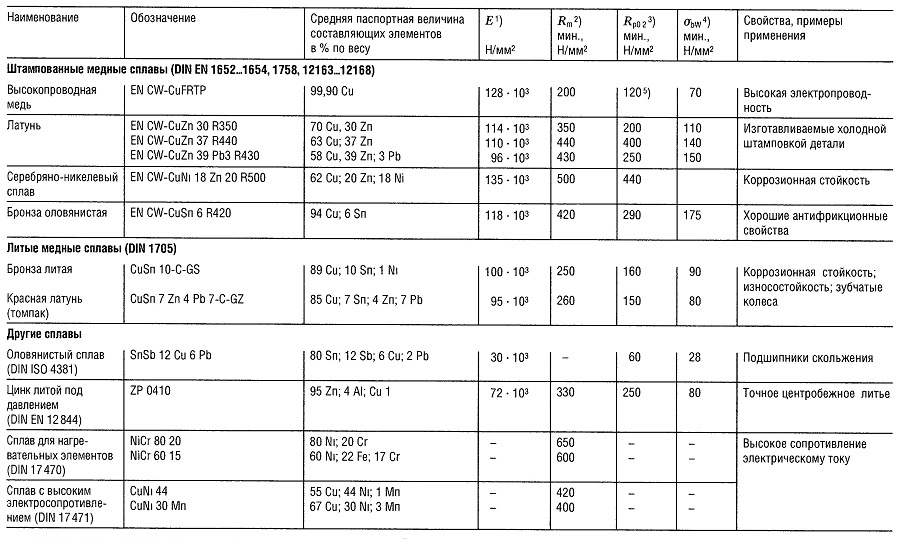
- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
Таблица «Свойства легких сплавов»
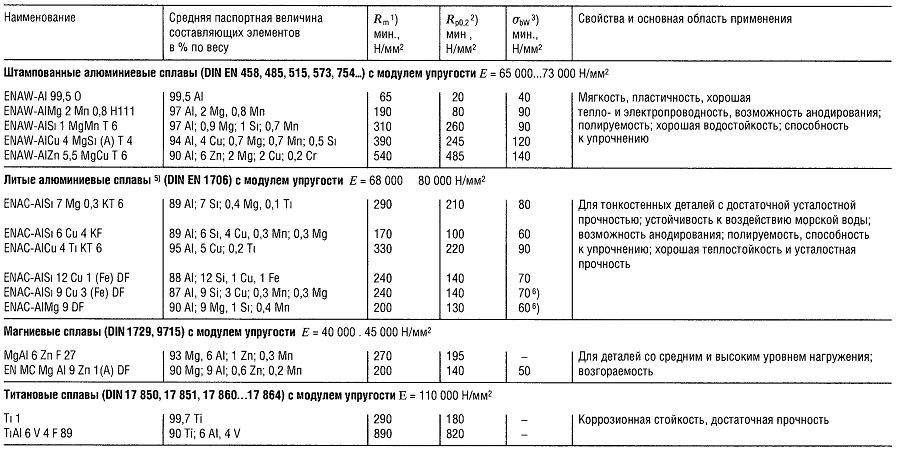
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»
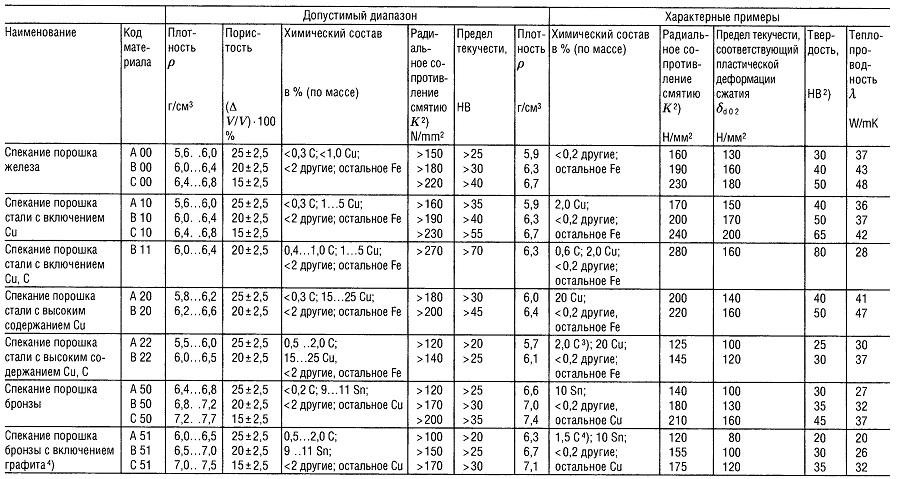
- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Таблица «Свойства металлокерамических материалов (РМ)1 для конструкционных деталей»
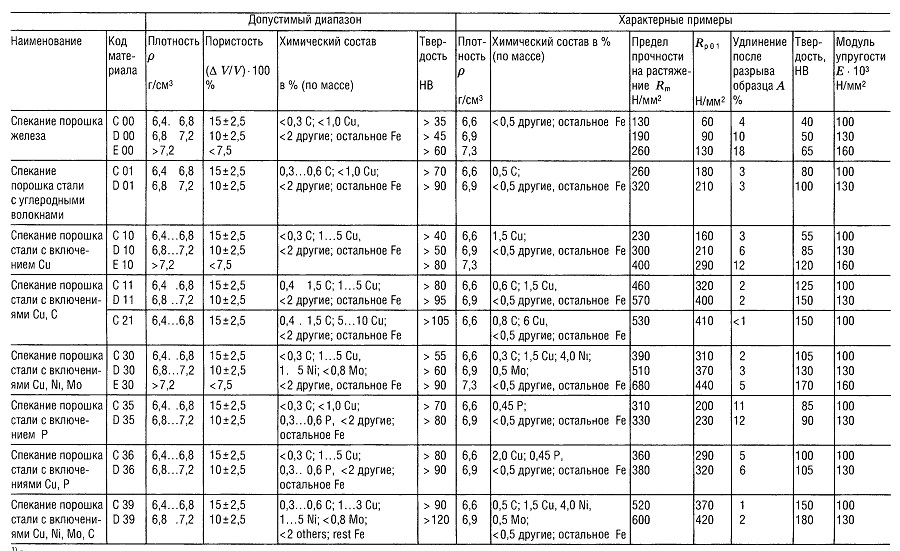
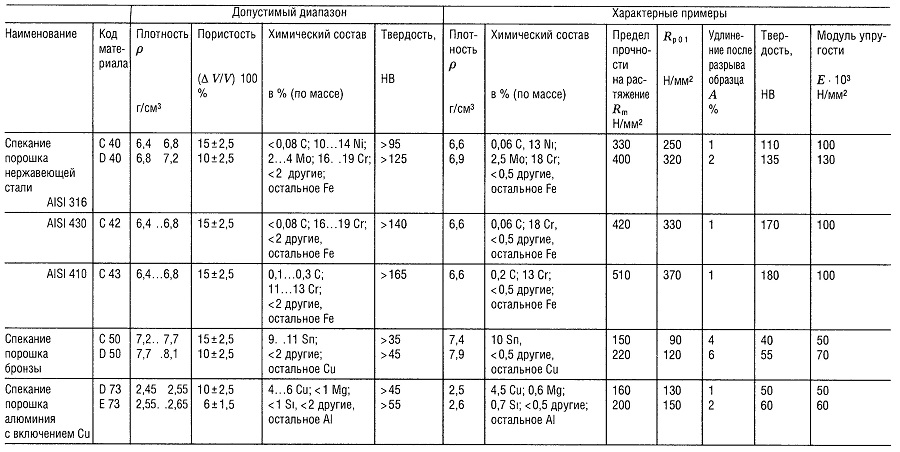
- В соответствии со стандартом DIN 30 910,1990 г. издания;
Магнитные материалы
Таблица «Свойства магнитомягких материалов»
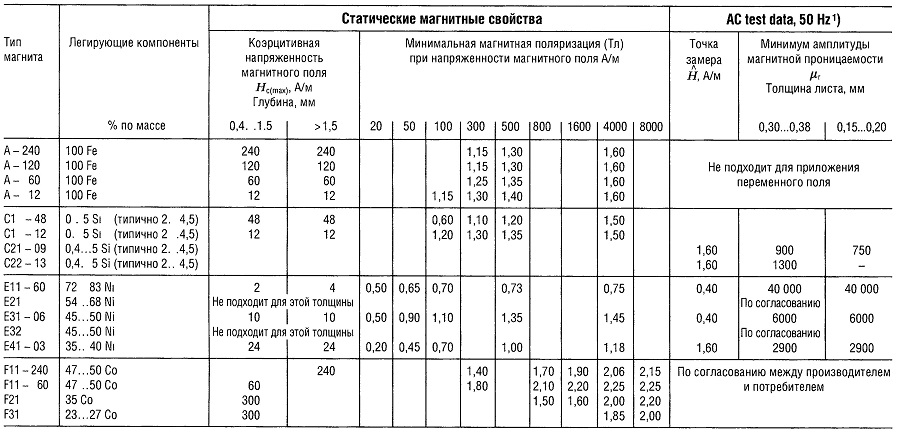
- Данные относятся только к магнитным кольцам.
Магнитомягкие металлы
Таблица «Свойства магнитной листовой и полосовой стали»
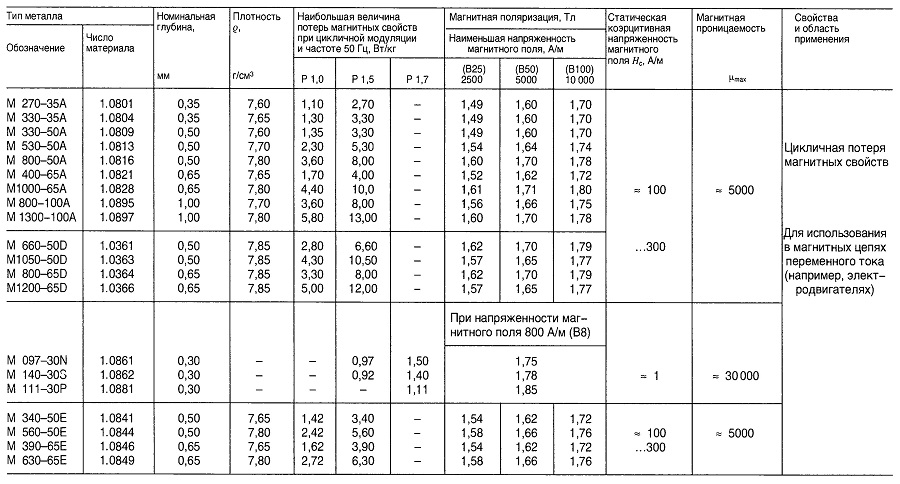
Материалы для преобразователей и электрических реакторов
Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
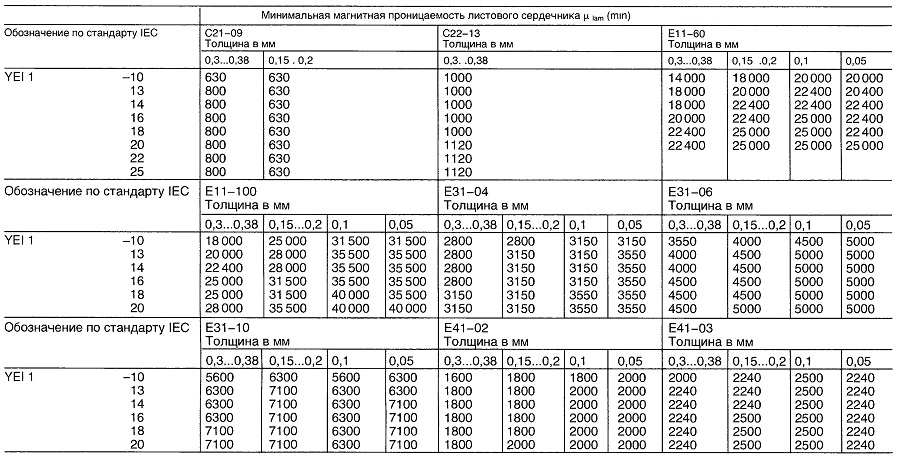
Материалы для реле постоянного тока
Таблица «Свойства материалов для реле постоянного тока»
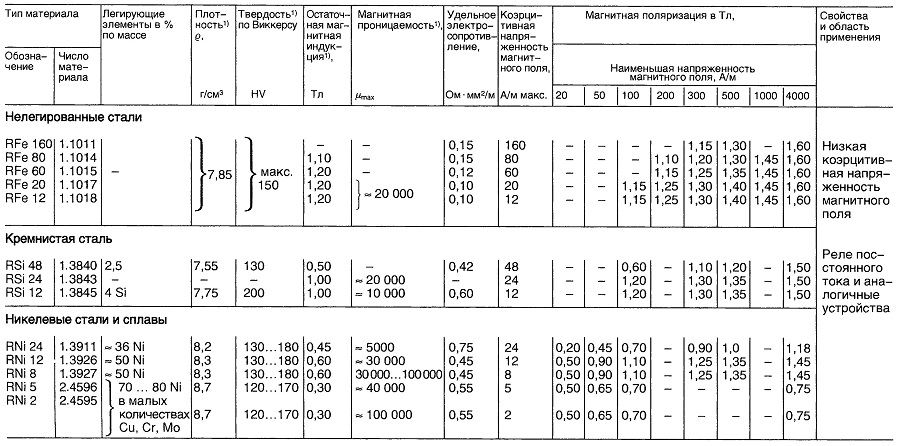
- Нормируемые величины
Металлокерамические материалы для магнитомягких компонентов
Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
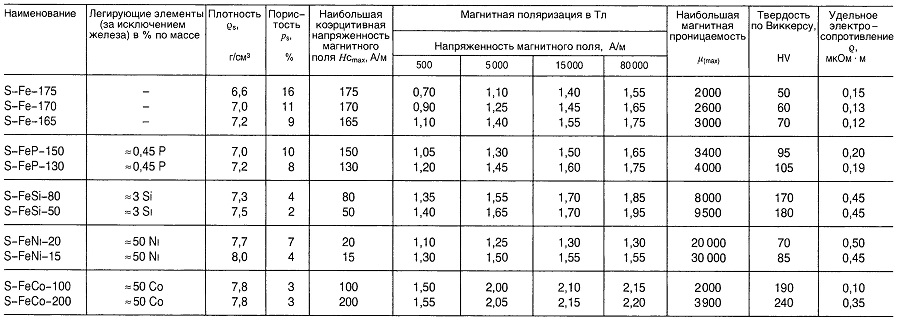
Магнитомягкие ферриты
Таблица «Свойства магнитомягких ферритов»

- Нормируемые величины;
- Потеря материалом магнитных свойств в зависимости от частоты при низкой плотности магнитного потока (В < 0,1 мТл);
- Потери магнитных свойств при высокой плотности магнитного потока; замеряются предпочтительно при f = 25 кГц, В = 200 мТл, Θ = 100°С;
- Магнитная проницаемость при строго синусоидальном магнитном поле; замеряется при f<; 25 кГц, В = 320 мТл, Θ = 100°С;
- Температура Кюри Θс, при которой начальная магнитная проницаемость μ, снижается ниже 10% от значения при температуре 25°С;
- Нормируемые величины.
Материалы для постоянных магнитов
Таблица «Свойства материалов для постоянных магнитов»
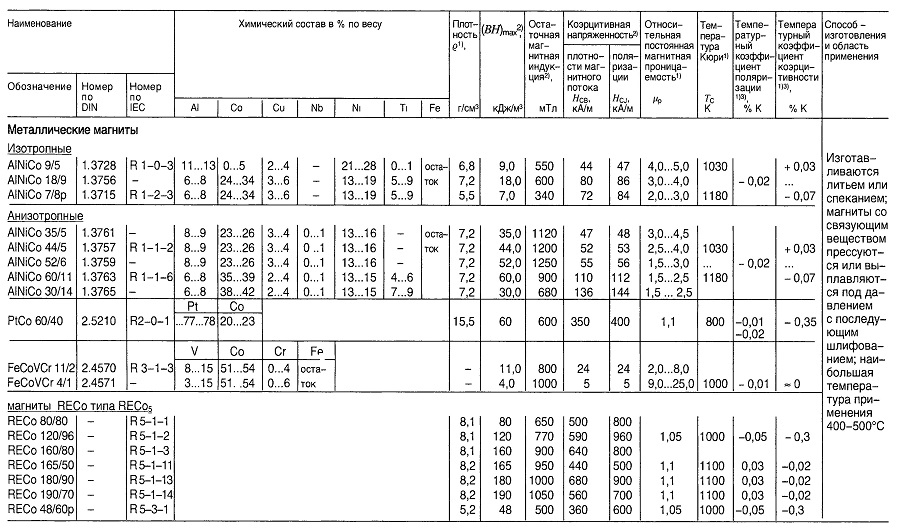
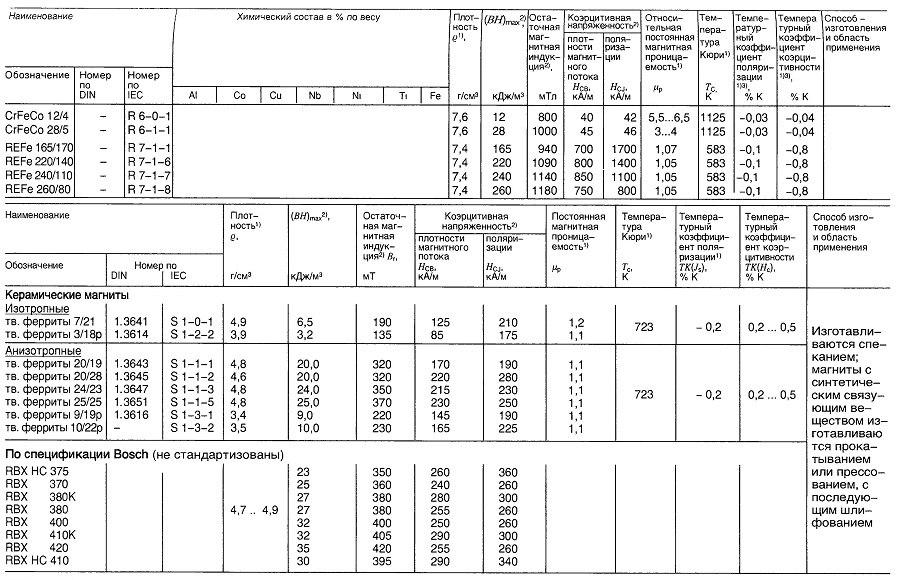
- Нормируемые величины;
- Наименьшее значение;
- В диапазоне температур 273…373 К.
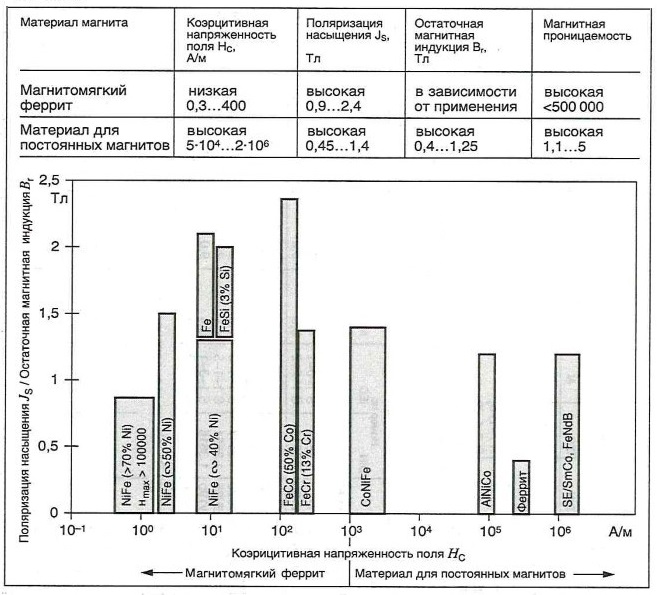
Сравнение материалов для постоянных магнитов и магнитомягких ферритов
Таблица «Диапазон магнитных характеристик некоторых широко используемых кристаллических материалов»
Материалы для пайки
Таблица «Свойства материалов для пайки»
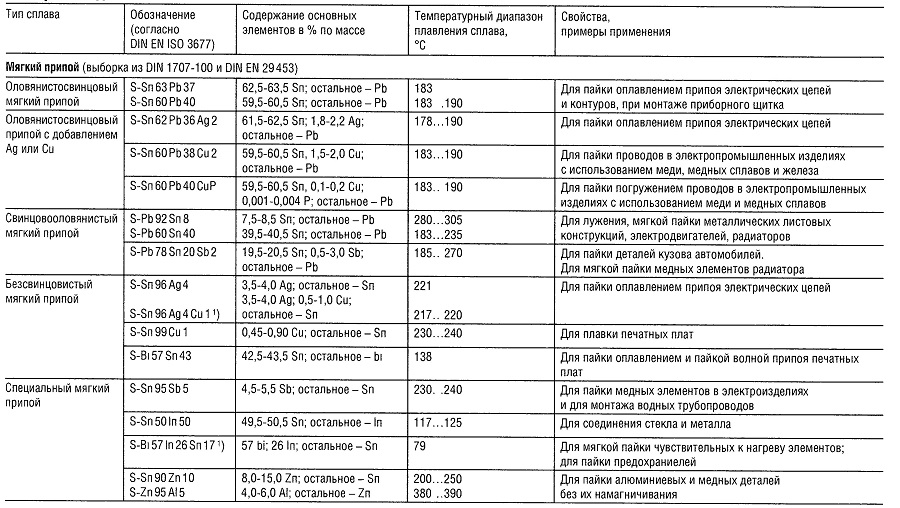
- Нет перечисленных в DIN 1707-100 или DIN EN 29453
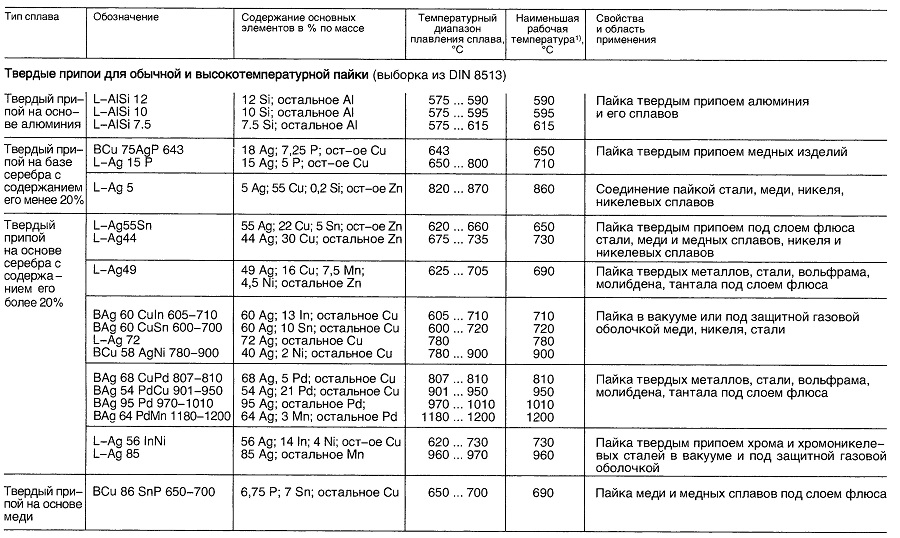
- В зависимости от выполняемой операции.
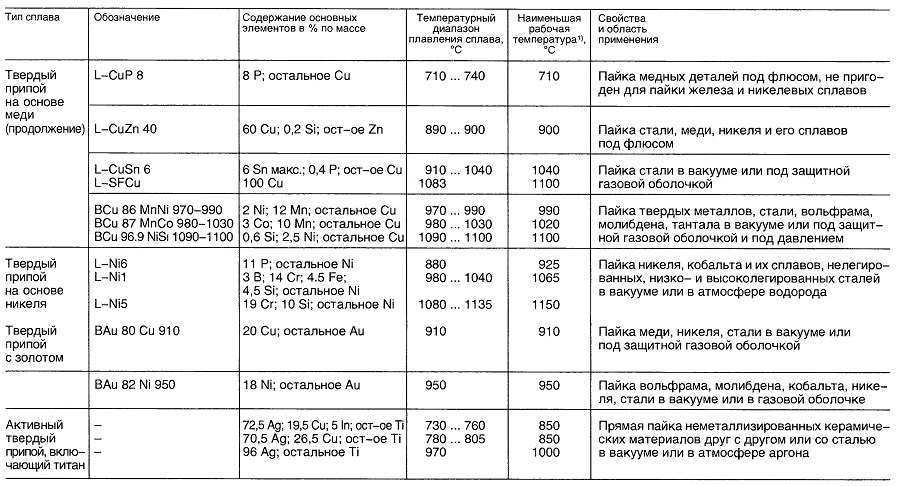
- В зависимости от выполняемых операций
В следующей статье я расскажу о бензине и дизельном топливе.
РЕКОМЕНДУЮ ЕЩЁ ПОЧИТАТЬ:
