Какая связь называется водородной как она определяет физические свойства
ГДЗ по классам
2 класс
- Математика
3 класс
- Математика
4 класс
- Математика
5 класс
- Математика
- Русский язык
- Английский язык
6 класс
- Математика
- Русский язык
- Английский язык
7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
10 класс
- Геометрия
- Химия
11 класс
- Геометрия
ГДЗ и решебники
вип уровня
- 2 класс
- Математика
- 3 класс
- Математика
- 4 класс
- Математика
- 5 класс
- Математика
- Русский язык
- Английский язык
- 6 класс
- Математика
- Русский язык
- Английский язык
- 7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- 8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 10 класс
- Геометрия
- Химия
- 11 класс
- Геометрия
- ГДЗ
- 9 класс
- Химия
- О. С. Габриелян, 2014г.
- Вопрос 2, Параграф 20

Назад к содержанию
Условие
Какая связь называется водородной? Как она определяет физические свойства воды?
Решение 1

Другие задачи из этого учебника
- 1
- 2
- 3
- 4
- 5
- 6
- 7
Поиск в решебнике
Популярные решебники
 ГДЗ по Химии за 9 класс Габриелян О.С.
ГДЗ по Химии за 9 класс Габриелян О.С.
Издатель: О. С. Габриелян, 2014г.
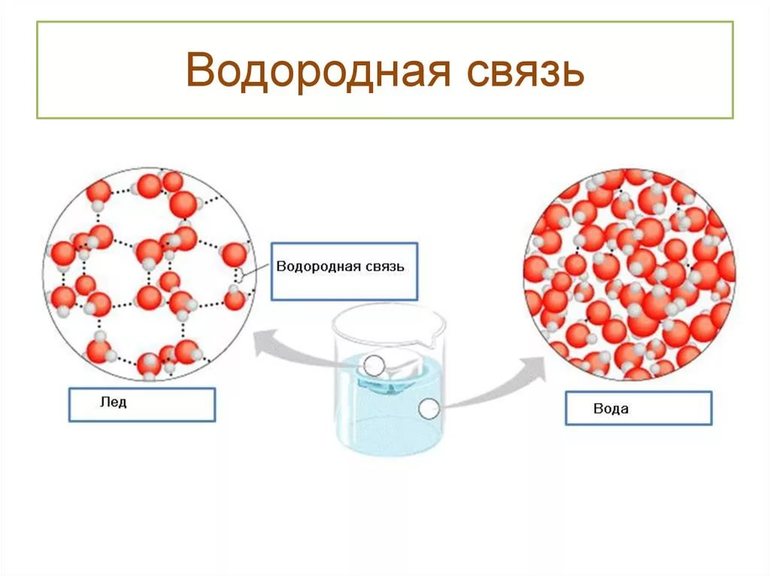
Пример межмолекулярных водородных связей
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1]
Природа[править | править код]
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость
взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR’. Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-).
История[править | править код]
В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга, впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу. Они использовали водородную связь, чтобы обосновать факт, что гидроксид триметиламмония является более слабым основанием, чем гидроксид тетраметиламмония.[4] Описание водородных связей в воде было сделано в 1920 году Латимером и Родебушем[5].
Свойства[править | править код]
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+, образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
В воде[править | править код]
Механизм Гротгуса[править | править код]
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5—6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Водные кластеры[править | править код]
Водородная связь между молекулами воды обозначена чёрными пунктирными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной связи O-H в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций. Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул , соединённых водородными связями[6].
В нуклеиновых кислотах и белках[править | править код]
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
В полимерах[править | править код]
Многие полимеры усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
См. также[править | править код]
- Химическая связь
- Фолдинг белка
Примечания[править | править код]
- ↑ Определение по IUPAC
- ↑ Энергия связи H···N = 8 кДж/моль, связи H···O — около 21 кДж/моль, связи H···F около 36 кДж/моль [1]. Для сравнения, энергия ковалентной связи — 400—900 кДж/моль [2]
- ↑ Например, водородными связями обусловлена форма молекулы ДНК
- ↑ T. S. Moore and T. F. Winmill. The state of amines in aqueous solution (англ.) // J. Chem. Soc.. — 1912. — Vol. 101. — P. 1635-1676. — doi:10.1039/CT9120101635.
- ↑ Wendell M. Latimer, Worth H. Rodebush. POLARITY AND IONIZATION FROM THE STANDPOINT OF THE LEWIS THEORY OF VALENCE. (англ.) // J. Am. Chem. Soc.. — 1920. — Vol. 42. — P. 1419–1433. — doi:10.1021/ja01452a015.
- ↑ Dominik Marx. Proton Transfer 200 Years after von Grotthuss: Insights fromAb Initio Simulations (англ.) // ChemPhysChem. — 2006. — Vol. 7. — P. 1848—1870. — doi:10.1002/cphc.200600128.
Литература[править | править код]
- Химическая Энциклопедия. Советская Энциклопедия. — М., 1988.
- В. В. Москва. Водородная связь в органической химии. Соросовский образовательный журнал, 11999,N 2, с.58-64 [3]
- Пиментел Дж., О. Мак-Клеллан. Водородная связь, пер. с англ.. — М., 1964.
- Эпштейн Л.М, Шубина Е.С. Многоликая водородная связь // «Природа». — 2003. — № 1.
- Водородная связь. Сб. ст.. — М., 1964.
- Pauling L. The chemical bond. — N. Y., 1967.
Ссылки[править | править код]
- Водородная связь — статья из энциклопедии «Кругосвет»
- Водородная связь / Иогансен А. В. // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
Евгения Золотухина · 29 августа 2018
14,6 K
Студент Massachusetts Institute of Technology, получил приглашения от Harvard… · ischemist.ru/blog
Немного уточню.
Водородная связь образуется между атомами водорода, которые связаны с электроотрицательными атомами, а значит несут на себе частично положительный зарят (δ+) и атомами с неподеленной электронной парой. Последними, как правило, являются электроотрицательные атомы.
При этом, стоит заметить, что у атомов водорода электроны находятся на 1s орбитали. Для образования прочного взаимодействия с неподеленными электронными парами на других атомах, эти самые пары должны находиться на орбиталях со схожей геометрией. Иными словами, если мы возьмем элементы третьего и ниже периодов, у которых пары сидят на 3p орбиталях, например, разница в размере между 3p и 1s настолько велика, что водородная связь образовываться не будет.
Таким образом, водородная связь может образовываться между а) атомами водорода с δ+ и б) атомами N, O, F.
Всем, привет! Тема семьи и отношений очень близка мне, но, став мамой, нужно…
Водородной называется связь, которая образуется между положительно заряжанными частицами водорода и сильно отрицательными элементами. Пример: HF, H2O,CH3OH.
Отличаются ли чем-нибудь атомы различных элементов, кроме количества в них протонов/нейтронов/электронов?
Сусанна Казарян, США, Физик
В вопросе есть проблема, которая затрудняет ответ. Если заменить слово вещество на слово химический элемент, то ответ однозначный — НЕТ. Число протонов (Z) определяет элемент (порядковый номер) в Таблице Менделеева. Число нейтронов определяет изотоп элемента (или массовое число A), число электронов определяет состояние атома (основное, возбужденное), химические свойства атома зависят от строения электронной оболочки, зависящей от Z.
Если же речь идет именно о веществах, которые в основном состоят из молекул, то ответ ДА, отличаются. Они отличаются типами химических связей между атомами в молекуле (ионные, ковалентныe, Ван-дер-Ваальса).
Откуда взялся первоначальный водород во Вселенной?
Пролетая по своим электронным делам в мрачной пустоте космоса отрицательно заряженный из-за жизненных неурядиц Электрон заметил одинокую, но довольно симпатичную и всю из себя положительную частицу по имени Протон. Замедлил свой полет и решил присмотреться повнимательней на нее со всех сторон. Так и остался вращаться вокруг нее. Разноименные частицы притягиваются. Так и появилась первая семья — Протон+Электрон, вполне себе устойчивая по имени Водород.
Существует ли мгновенная связь между всеми частицами (материи и света) во вселенной? Если да, то возможная совокупность этих связей и есть Бог?
Отвечаю на вопросы о буддийских традициях. Проектирую шрифты.
Смотря что считать связью. Например считать ли связью взаимозависимость запутанных фотонов, теоретически вероятное на противоположных краях вселенной?
Для совокупности связей есть более подходящее чем Бог слово — сингулярность или целостность. Можно представить что наша вселенная — это вязанный свитер. Каждая петелька — это частица. Можно ли связать весь свитер из одной нитки? Да. Можно связать из нескольких ниток разного цвета, но с возможностью взаимодействия между ними. Если мы тянем за одну петлю (фотон), а затягивается другая, значит они находятся на одной нитке, имеют одну природу, одну прошлую причину существования.
Слово Бог чаще всего означает разум в каком-то виде. Разум предполагает какие-то процессы, протекающие внутри него и снаружи. То есть взаимодействие внутренних частей с внешним миром. Если вся вселенная это одно большое сознание, как она может понять, что она — сознание? Представьте мыслящего человека, лишенного органов чувств. Какие процессы могут протекать в таком сознании? Это будут внешне случайные процессы определяемые только внутренними условиями взаимодействия частей, не имеющие никаких целей, кроме реализации возможности движения. Можно ли такой такой цельный, но бесцельный ) процесс назвать сознанием?
Если в итоге вселенная достигнет состояния равноудалённых невзаимодействующих частиц, если свитер распустится в длинную нитку с отдельными узелками, или даже если все петли распустятся и останется только сама нитка — нулевые колебания волн, значит в нашем мире-разуме не осталось больше мыслей? Так что ли? Получается бог не бессмертный?
Прочитать ещё 3 ответа
Каким путем в лаборатории можно получить водород?
Существует много способов, достаточно придумать реакцию, результатом которой будет молекулярный водород. Один из способов, который изучается в школе — электролиз воды. Сильное электрическое поле «разрывает» молекулы воды на катионы H+ и анионы OH-. Катионы водорода забирают свободные электроны и, слепившись парами, улетают. При электролизе воды, солей активных металлов и гидроксидов, на катоде происходит:
2H2O + 2(e-) => H2 + 2OH−
Прочитать ещё 1 ответ
В чём сходство и в чём различие молекул ДНК и РНК?
Молекулы ДНК и РНК представляют собой биологические полимеры, нуклеиновые кислоты со схожими химическими составами.
Основные сходства молекул ДНК и РНК:
- химическая основа — нуклеиновая кислота;
- общий план строения мономер — нуклеотид;
- содержание остатков фосфорной кислоты.
Основные отличия молекул ДНК и РНК:
- молярная масса молекулы: ДНК > РНК;
- функция: молекула ДНК хранит наследственную информацию, РНК — переносит ее;
- количество цепей: ДНК — двухцепочечная молекула, РНК — одноцепочечная;
- местонахождение в клетке: ДНК — ядро, РНК — ядро и цитоплазма;
- сахар: ДНК — дезоксирибоза, РНК — рибоза.
Прочитать ещё 1 ответ
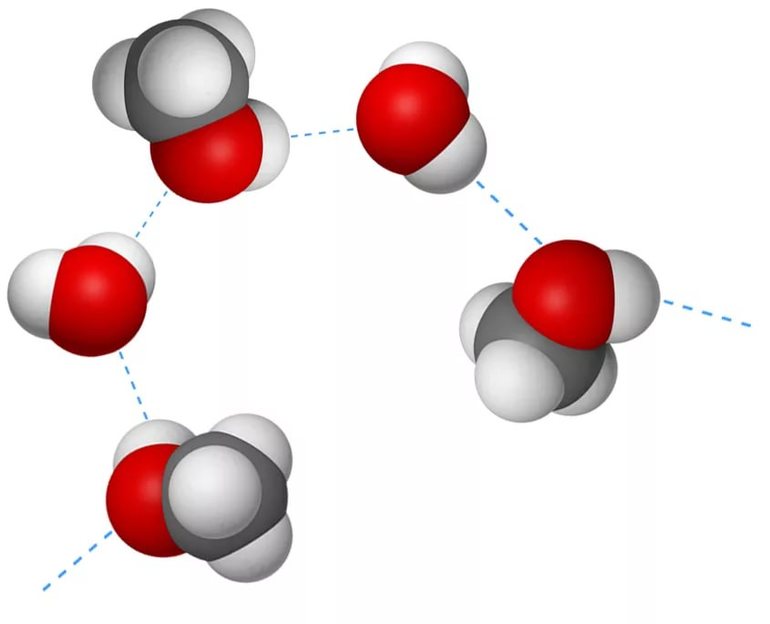
Характерные особенности
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:

- Межмолекулярная. Возникает между различными молекулами веществ: для этого необходимо присутствие водорода и одного из элементов с хорошей способностью притягивать электроны других атомов. Высокая электроотрицательность фтора (F), кислорода (O), азота (N), хлора (Cl) и серы (S) служит этому надёжной поддержкой. Общие пары взаимодействующих электронов смещаются к атомам отрицательно заряженных элементов, а положительные электрические заряды водорода концентрируются в малых объёмах. Протоны взаимодействуют с электронными парами соседних атомов, что приводит к их обобществлению.
- Внутримолекулярная. Образуется в пределах одной молекулы, для чего в ней наряду с положительно заряженными атомами водорода должны присутствовать отрицательно поляризованные группы. Явление обнаруживается в природе у многоатомных спиртов, белков, углеводов и ряда других органических соединений.
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:

- вода H2O в виде льда;
- кристаллы йода I;
- хлор Cl;
- бром Br;
- диоксид углерода CO2 в форме «сухого льда»;
- твёрдый аммиак NH3;
- конденсированная органика (метан CH4, бензол C6H6, фенол C6H5OH, нафталин C10H8, различные белки).
Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
- первый атом приобретает частично отрицательный заряд (d-);
- второй участник заряжается положительно (d+);
- происходит поляризация химической связи (Аd-) — (Hd+).
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
- атом-донор протона;
- атом-акцептор протона;
- атом водорода Н.
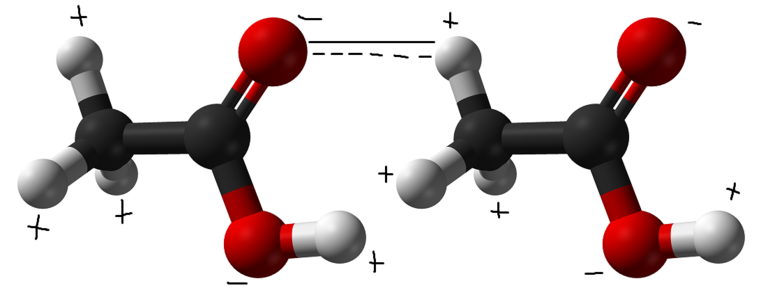
Такое донорство в обычных условиях никогда не осуществляется на все 100%. Атом-донор остается химически связанным с водородом. Графически это обозначается в виде линии из точек, указывающей, что сила взаимодействия слабее ковалентной связи. Схема записи структуры выглядит следующим образом: Б ··· Нd+ — Аd-.
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Проявление в неорганической химии
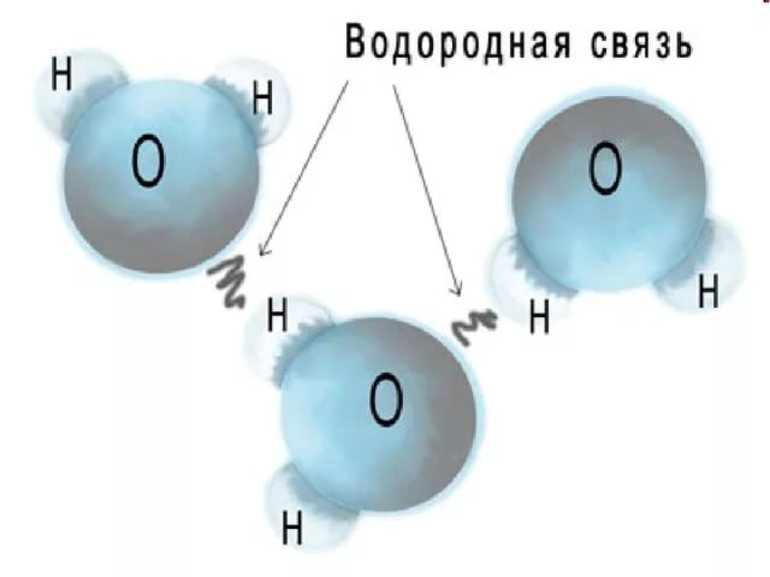
Определение «водородная связь» появилось в 1920 году. Его применили учёные Латимер и Родебуш для объяснения сущности аномалий, наблюдавшихся при кипении воды, предельных одноатомных спиртов и жидкого фтороводорода. При сопоставлении точек кипения в ряду водородсодержащих родственных соединений Н2O (вода), Н2S (сероводород), Н2Se (селеноводород) и Н2Te (теллуроводород) обнаружилось, что первый участник этого списка (H2O) переходит из жидкости в пар гораздо раньше, чем можно было бы ожидать, следуя закономерности, которой подчиняются остальные члены. Истинное значение точки кипения воды оказалось на 200° C выше ожидаемого.
Это справедливо и для другого ряда — NH3 (аммиак), PH3 (фосфин), H3As (арсин), Н3Sb (стибин), где фактическая (-33 °C) температура кипения аммиака на 80 градусов превышает ожидаемую. Если считать, что молекулы в жидкости удерживаются исключительно Ван-дер-Ваальсовыми силами, разрушающимися при переходе в газообразную фазу, то эти скачки не должны наблюдаться, а объяснить их невозможно.
Неожиданные повышения температур кипения привели к выводам о присутствии дополнительно связывающих молекулы сил, изменяющих физические свойства. Водородной связи принадлежит роль в создании аномальных температур кипения спиртов, если их сравнивать с аналогами без гидроксильных групп (-ОН). В перечне заслуг H-связей не только изменение точек кипения веществ, но и упрочнение их кристаллических решёток, вызывающее повышение температур плавления, поверхностного натяжения и вязкости.
Например, борная кислота с формулой H3BO3 имеет слоистую триклинную кристаллическую решётку, где каждая из молекул посредством H-связей крепится к трём другим. В результате образуются плоские слои, которые за счёт межмолекулярных связей создают кристаллическую структуру — «паркет» из шестиугольников.
При помощи инфракрасной спектроскопии сегодня можно достоверно выявить любой тип межмолекулярного взаимодействия: группы с Н-связями заметно отличаются по спектральным характеристикам от остальных случаев. Исследования структуры вещества помогают измерить дистанцию между водородом и атомом-акцептором, сравнить её с суммой радиусов и, если первое значение не превышает второе, доказать существование явления.
Понятие водных кластеров

Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
Присутствие H-связей в молекулах воды обуславливает образование водных кластеров или комплексов, а димеры воды служат их простейшими примерами. Энергия их водородных связей ненамного больше энергии броуновского движения при нормальных условиях, но сильно отличается от мощности ковалентных связей в гидроксильных группах, а они в 200 раз превышают тепловые показатели. Вода из простой жидкости превращается в сложную, «связанную» сетью H-связей, хотя они относительно слабы и неустойчивы, самопроизвольно возникают и исчезают при температурных изменениях.
Кристаллическая структура льда имеет объёмную сетку из этих связей, и молекулы H2O расположены так, чтобы атомы водорода одних молекул оказывались направленными к атомам кислорода соседей. В ледяном кристалле между молекулами обязательно присутствуют пустоты, их объёмы немного превышают размеры отдельных молекул воды. Именно благодаря таким «карманам» плотность льда меньше, чем у его жидкой фазы, а гигантские айсберги остаются дрейфовать на поверхности, в то время как замерзание большинства других веществ существенно увеличивает их плотность.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.

Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Начинает проступать голубой участок спектра, уравновешивающий отсутствие красного. Вода самостоятельно окрасится в волшебный небесный цвет. Для этого необходимо, чтобы солнечные лучи прошли через двухметровую толщу чистой воды и потеряли достаточное количество красного спектра.
Значение для органических соединений
Многие органические вещества не могут растворяться в воде. Но если это происходит, то процесс не обходится без активного участия H-связей. Кислород и азот, главные доноры протонов, часто играют роли акцепторов. Органические соединения, содержащие O и N, легко растворяются в воде: здесь кислород и азот выступают в качестве атомов-акцепторов, а атомом-донором является кислород из молекул воды. Возникающие H-связи перемещают органическое вещество в раствор, «растаскивая» его на молекулы.

Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород. Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.

Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.

