Какая группа определяет основные свойства аминов

АМИНЫ
Вариант 1
Часть А
А1.Основные свойства аминов определяет:
А) | Гидроксильная группа | В) | Нитрогруппа |
Б) | Карбонильная группа | Г) | Аминогруппа |
А2.В водном растворе этиламина среда:
А) | Кислотная | В) | Щелочная |
Б) | Нейтральная | Г) | Изменяется в зависимости от температуры |
А3.Анилин:
А) | Реагирует с кислотами с образованием солей |
Б) | Построен из цепочек, образованных остатками аминокислот |
В) | Содержит карбоксильную группу |
Г) | В растворе создает кислотную среду |
А4.Укажите вещество, которое будет реагировать с метиламином:
А) | Br2 (р-р) | В) | HCl (p-p) |
Б) | NaOH (р-р) | Г) | Na2CO3 (p-p) |
А5.Укажите, к какому типу реакций относится взаимодействие анилина с раствором брома в воде:
А) | Присоединение | В) | Отщепление |
Б) | Замещение | Г) | Полимеризации |
А6.Этиламин способен реагировать:
А) | Этанолом | В) | Муравьиной кислотой |
Б) | Ацетоном | Г) | Ацетиленом |
А7. В молекуле анилина влияние аминогруппы на бензольное кольцо подтверждает реакция с:
А) | Соляной кислотой | В) | Хлорметаном |
Б) | Бромной водой | Г) | Уксусным ангидридом |
А8. Реакцией Зинина называют:
А) | Гидратацию ацетилена в присутствии солей ртути |
Б) | Тримеризацию ацетилена с образованием бензола |
В) | Нитрование предельных углеводородов |
Г) | Восстановление нитробензола до анилина |
Часть Б
Б1. Этиламин:
1) | Проявляет амфотерные свойства |
2) | Растворяется в воде |
3) | Реагирует со щелочами |
4) | Способен к полимеризации |
5) | В водном растворе изменяет окраску индикатора |
6) | Можно получить взаимодействием бромэтана с аммиаком |
Б2. Метиламин можно получить взаимодействием:
1) | Метанола с аммиаком |
2) | Бромметана с аммиаком |
3) | Хлорида метиламмония с гидроксидом калия |
4) | Метана с азотной кислотой |
5) | Метанола с азотом |
6) | Метана с аммиаком |
Б3. Анилин
1) | Относится к нитросоединениям |
2) | Получают нитрованием бензола |
3) | Является ароматическим амином |
4) | Взаимодействует с бромной водой |
5) | Относится к третичным амином |
6) | Реагирует с соляной кислотой |
Вариант 2
Часть А
А1.Соединение С6Н5NHC6H5 – это:
А) | Вторичный амин | В) | Первичный амин |
Б) | Соль аммония | Г) | Аминокислота |
А2.Укажите, сколько изомеров может образовывать амин с формулой C6H4(CH3)(NH2)
А3.В водном растворе метиламина среда:
А) | Кислотная | В) | Щелочная |
Б) | Нейтральная | Г) | Изменяется в зависимости от температуры |
А4.Этиламин:
А) | Реагирует с кислотами с образованием солей |
Б) | Построен из цепочек, образованных остатками аминокислот |
В) | Содержит карбоксильную группу |
Г) | В растворе создает кислотную среду |
А5.Укажите вещество, которое будет реагировать с анилином:
А) | Br2 (р-р) | В) | NaCl (p-p) |
Б) | NaOH (р-р) | Г) | Na2CO3 (p-p) |
А6.Укажите, к какому типу реакций относится взаимодействие анилина с раствором бромоводорода в воде:
А) | Нейтрализация | В) | Отщепление |
Б) | Замещение | Г) | Полимеризации |
А7.Этиламин способен реагировать:
А) | Этанолом | В) | Кислородом |
Б) | Ацетоном | Г) | Водородом |
А8. Получение анилина в промышленности основано на реакции:
А) | Восстановления нитробензола |
Б) | Нитрования толуола |
В) | Хлорирования бензола |
Г) | Декарбоксилирования бензойной кислоты |
Часть Б
Б1. Диметиламин в отличии от метиламина:
1) | Является вторичным амином |
2) | Относится к алифатическим аминам |
3) | Проявляет более сильные основные свойства |
4) | Растворяется в воде |
5) | Реагирует с соляной кислотой |
6) | Имеет более высокую температуру кипения |
Б2. Этиламин можно получить взаимодействием:
1) | Этанола с аммиаком |
2) | Этана с азотной кислотой |
3) | Бромэтана с аммиаком |
4) | Хлорида этиламмония с гидроксидом калия |
5) | Метиламина с метаном |
6) | Этана с азотом |
Б3. Какие утверждения справедливы для анилина?
1) | Устойчив к окислению |
2) | Относится к алифатическим аминам |
3) | Проявляет основные свойства |
4) | Получают восстановлением нитробензола |
5) | Является вторичным амином |
6) | Реагирует с соляной кислотой |
Вариант 3
Часть А
А1.Соединение С6Н5NH2– это:
А) | Вторичный амин | В) | Первичный амин |
Б) | Соль аммония | Г) | Аминокислота |
А2.Укажите, сколько изомеров может образовывать пропиламин:
А3.В водном растворе анилина среда:
А) | Кислотная | В) | Щелочная |
Б) | Нейтральная | Г) | Изменяется в зависимости от температуры |
А4.Метиламин:
А) | Реагирует с кислотами с образованием солей |
Б) | Построен из цепочек, образованных остатками аминокислот |
В) | Содержит карбоксильную группу |
Г) | В растворе создает кислотную среду |
А5.Укажите вещество, которое будет реагировать с этиламином:
А) | Br2 (р-р) | В) | NaCl (p-p) |
Б) | NaOH (р-р) | Г) | HCl (p-p) |
А6.Укажите, к какому типу реакций относится взаимодействие фениламина с раствором бромоводорода в воде:
А) | Нейтрализация | В) | Отщепление |
Б) | Замещение | Г) | Полимеризации |
А7. Метиламин не взаимодействует с:
А) | Кислородом | В) | Гидроксидом натрия |
Б) | Соляной кислотой | Г) | Уксусной кислотой |
А8. Амин не образуется в реакции:
А) | Восстановления нитробензола | В) | Пропена с аммиаком |
Б) | Иодэтана с аммиаком | Г) | Хлорбензола с аммиаком |
Часть Б
Б1. И анилин, и метиламин:
1) | Хорошо растворяются в воде |
2) | Реагируют с гидроксидом натрия |
3) | Проявляют основные свойства |
4) | Реагируют с соляной кислотой |
5) | Содержат в своем составе аминогруппу |
6) | Способны к реакциям электрофильного замещения |
Б2. Анилин взаимодействует с:
1) | Соляной кислотой |
2) | Бензолом |
3) | Гидроксидом натрия |
4) | Бромметаном |
5) | Пропаном |
6) | Бромной водой |
Б3. И метиламин, и диметиламин
1) | Является первичными аминами |
2) | Относятся к ароматическим аминам |
3) | Имеют более слабые основные свойства, чем анилин |
4) | Реагируют с кислотами |
5) | Хорошо растворяются в воде |
6) | Могут взаимодействовать с хлорэтаном |
Вариант 4
Часть А
А1.Укажите, сколько изомеров может образовывать этиламин:
А2.В водном растворе фениламина среда:
А) | Кислотная | В) | Щелочная |
Б) | Нейтральная | Г) | Изменяется в зависимости от температуры |
А3. Диметиламин:
А) | Является гомологом вещества N(CH3)3 |
Б) | Плохо растворим в воде |
В) | Не взаимодействует с серной кислотой |
Г) | Реагирует с бромэтаном |
А4. Укажите вещество, которое не будет реагировать с анилином:
А) | Br2 (р-р) | В) | СН3СООН (p-p) |
Б) | NaOH (р-р) | Г) | HCl (p-p) |
А5. Метиламин взаимодействует с:
А) | Кислородом | В) | Гидроксидом натрия |
Б) | Медью | Г) | Карбонатом натрия |
А6. Гомологом метиламина является:
А) | Анилин | В) | Амид уксусной кислоты |
Б) | Нитроэтан | Г) | Бутиламин |
А7. В порядке усиления основных свойств вещества расположены в ряду:
А) | Аммиак, анилин, диметиламин, металамин |
Б) | Анилин, аммиак, метиламин, диметиламин |
В) | Диметиламин, метиламин, аммиак, анилин |
Г) | Анилин, метиламин, диметиламин. аммиак |
А8. В молекуле анилина влияние аминогруппы на бензольное кольцо подтверждает реакция с:
А) | Соляной кислотой | В) | Хлорметаном |
Б) | Бромной водой | Г) | Уксусным ангидридом |
Часть Б
Б1. Анилин, в отличие от метиламина:
1) | Плохо растворим в воде |
2) | Проявляет основные свойства |
3) | Вступает в реакции электрофильного замещения |
4) | Более слабое основание |
5) | Реагирует с кислотами |
6) | Содержит аминогруппу |
Б2. Метиламин можно получитьвзаимодействием:
1) | Метанола с аммиаком |
2) | Метана с азотной кислотой |
3) | Хлорметана с азотом |
4) | Хлорида метиламмония со щелочью |
5) | Метана с аммиаком |
6) | Хлорметана с аммиаком |
Б3. Для триметиламина верны утверждения:
1) | Проявляет амфотерные свойства |
2) | Относится к ароматическим аминам |
3) | Является основанием |
4) | Входит в состав нуклеиновых кислот |
5) | Реагирует с соляной кислотой |
6) | Является третичным амином |
Ответы:
№ варианта | Часть А | Часть Б | |||||||||
А 1 | А 2 | А 3 | А 4 | А 5 | А 6 | А 7 | А 8 | Б 1 | Б 2 | Б 3 | |
Вариант 1 | г | в | а | в | б | в | б | г | 256 | 146 | 346 |
Вариант 2 | а | в | в | а | а | а | в | а | 136 | 134 | 346 |
Вариант 3 | в | г | в | а | г | а | в | в | 345 | 146 | 456 |
Вариант 4 | б | в | а | б | а | г | б | б | 134 | 146 | 356 |
Литература:
1.О.С.Габриелян, И.Г.Остроумов, С.А.Сладков. Готовимся к ЕГЭ 2011 Химия. Москва. Дрофа, 2011
2.Е.В.Савинкина Химия. Экспресс-диагностика 10 класс. Москва. Национальное образование, 2011.
Амины– азотсодержащие органические вещества,
производные аммиака (NH3), в молекулах
которых один или несколько атомов водорода замещены на углеводородный радикал
(- R или – CnH2n+1)
2. Функциональная
группа:
— NH2 аминогруппа
3. Классификация
аминов:
4. Нахождение
аминов в природе
Амины широко распространены в природе,
так как образуются при гниении живых организмов. Например, с триметиламином вы
встречались неоднократно. Запах селедочного рассола обусловлен именно этим
веществом. Обиходное словосочетание “трупный яд”, встречающиеся в
художественной литературе, связано с аминами.
5. Номенклатура аминов
1. В большинстве случаев названия аминов
образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов
используют приставки ди и три.
(CH3)2NH Диметиламин
2. Первичные амины часто называют как
производные углеводородов, в молекулах которых один или несколько атомов
водорода замещены на аминогруппы -NH2. В этом случае аминогруппа
указывается в названии суффиксами амин (одна группа -NH2),
диамин (две группы -NH2) и т.д. с добавлением цифр,
отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
6. Изомерия аминов
Структурная
изомерия
— углеродного скелета, начиная с С4H9NH2:
— положения аминогруппы, начиная с С3H7NH2:
— изомерия аминогруппы, связанная с
изменением степени замещенности атомов водорода при азоте, т.е. между типами
аминов:
Пространственная
изомерия
Возможна оптическая изомерия, начиная с
С4H9NH2:
7. Получение аминов
Из-за запаха низшие амины долгое время
принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на
воздухе с образованием углекислого газа. Он же синтезировал метиламин и
этиламин.
1842 г Н. Н. Зинин
получил анилин восстановлением нитробензола — в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Feв кислой среде →R-NH2 +3S↓
+6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1).
Промышленный
CH3Br + 2NH3 t, ↑p →
CH3-NH2 + NH4Br
2).
Лабораторный — Действие
щелочей на соли алкиламмония
(получение первичных, вторичных,
третичных аминов):
[R-NH3]Г + NaOH
t → R-NH2 + NaГ
+ H2O
3). Действием
галогеналканов на первичные алифатические и ароматические амины получают
вторичные и третичные амины, в том числе, смешанные.
8. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние
члены алифатического ряда — жидкости, высшие — твердые вещества. Низшие амины
имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому
первичные и вторичные амины образуют межмолекулярные водородные связи
(несколько более слабые, чем Н-связи с участием группы О–Н).
Это объясняет относительно высокую
температуру кипения аминов по сравнению с неполярными соединениями со сходной
молекулярной массой. Например:
Третичные амины не образуют
ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их
температуры кипения ниже, чем у изомерных первичных и вторичных аминов
(триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
По сравнению со спиртами алифатические
амины имеют более низкие температуры кипения (т. кип. метиламина
-6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о
том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность
водородных связей с атомом азота меньше, чем с участием более
электроотрицательного кислорода.
При обычной температуре только низшие
алифатические амины CH3NH2, (CH3)2NH
и (CH3)3N – газы (с запахом аммиака), средние гомологи –
жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных
связей с водой:
Поэтому низшие амины хорошо растворимы в
воде. С увеличением числа и размеров углеводородных радикалов растворимость
аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия
образованию водородных связей. Ароматические амины в воде практически не
растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из
ароматических аминов:
Анилин представляет собой бесцветную
маслянистую жидкость с характерным запахом (т. кип. 184 °С,
т. пл. – 6 °С). На воздухе быстро окисляется и приобретает
красно-бурую окраску. Ядовит.
ВИДЕО:
Изучениефизических свойств анилина
9. Свойства аминов
I. Основные свойства
Для аминов характерны основные свойства,
которые обусловлены наличием не поделённой электронной пары на атоме азота
Алифатические
амины
– более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают
электронную плотность на атоме азота за счет +I-эффекта. По этой причине
электронная пара атома азота удерживается менее прочно и легче взаимодействует
с протоном.
Ароматические
амины
являются более слабыми основаниями, чем аммиак, поскольку неподеленная
электронная пара атома азота смещается в сторону бензольного кольца, вступая в
сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH
————————————————-→
возрастание основных свойств
В растворах оснoвные свойства третичных
аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три
радикала создают пространственные препятствия для сольватации образующихся
аммониевых ионов. По этой же причине основность первичных и вторичных аминов
снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов
имеют щелочную реакцию (амины
реагируют с водой по донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+
+ OH-
ион алкиламмония
ВИДЕО:
Получениегидроксида диметиламмония и изучение его свойств
Анилин с водой не
реагирует и не изменяет окраску индикатора!!!
ВИДЕО:
Изучение среды раствора анилина
Взаимодействие с кислотами
(донорно-акцепторный
механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль — гидросульфатметиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль
— сульфат метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH
→ 2CH3-NH2
↑ + Na2SO4 + H2O
Способность
к образованию растворимых солей с последующим их разложением под действием
оснований часто используют для выделения и очистки аминов, не растворимых в
воде. Например, анилин, который практически не растворяется в воде, можно
растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив
раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном
состоянии.
II. Реакции окисления
Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические
амины легко окисляются даже кислородом воздуха. Являясь в чистом виде
бесцветными веществами, на воздухе они темнеют. Неполное окисление
ароматических аминов используется в производстве красителей. Эти реакции обычно
очень сложны.
ВИДЕО:
Получение диметиламина и его горение
III. Особые свойства анилина
Для анилина характерны реакции как по
аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным
влиянием атомов.
1).
Для анилина характерны свойства бензольного кольца – действие
аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в
кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо
ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и
даже с аммиаком.
С другой
стороны, под влиянием аминогруппы бензольное кольцо становится более активным в
реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина
(белый осадок). Эта реакция может использоваться для качественного и количественного
определения анилина:
ВИДЕО:
Бромированиеанилина
2). Свойства аминогруппы:
С6Н5NН2 +
HCl → [С6Н5NН3 ]+Сl-
хлорид фениламмония
ВИДЕО:
Взаимодействиеанилина с соляной кислотой
ВИДЕО:
Окисление анилина раствором хлорной извести – качественная реакция
Взаимодействие анилина с дихроматом калия – получение красителей
10. Применение
Амины используют при
получении лекарственных веществ, красителей и исходных продуктов для
органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой
кислотой дает полиамидные волокна.
Анилин находит широкое
применение в качестве полупродукта в производстве красителей, взрывчатых
веществ и лекарственных средств (сульфаниламидные препараты).
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

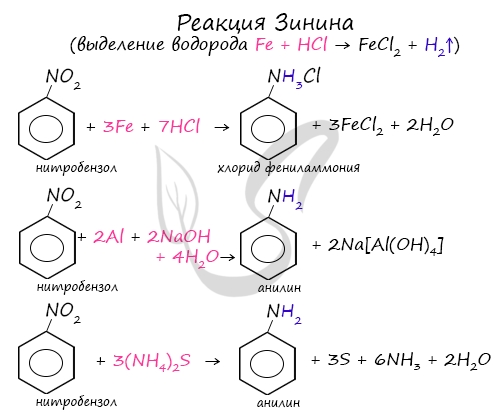
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
