Как определить какие свойства у химического элемента

На этом уроке вы узнаете о Периодическом законе Менделеева, который описывает изменение свойств простых тел, а также формы и свойства соединений элементов в зависимости от величины их атомных масс. Рассмотрите, как по положению в Периодической системе можно описать химический элемент.
Тема: Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Урок: Описание элемента по положению в Периодической системе элементов Д. И. Менделеева
1. Какие характеристики атома меняются в Периодической системе периодически
В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: « Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов». Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Современная формулировка периодического закона: « Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален.
Заряд ядра атома в Периодической таблице – это порядковый номер элемента.
Номер периода показывает число энергетических уровней, на которых вращаются электроны.
Номер группы показывает число валентных электронов. Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
Какие же характеристики атома меняются в Периодической системе периодически?
— Повторяется строение внешнего электронного уровня.
— Периодически меняется радиус атома. В группе радиус увеличивается с увеличением номера периода, так как увеличивается число энергетических уровней. В периоде слева направо будет происходить рост атомного ядра, но притяжение к ядру будет больше и поэтому радиус атома уменьшается.
— Каждый атом стремится завершить последний энергетический уровень У элементов 1 группы на последнем слое 1 электрон. Поэтому им легче его отдать. А элементам 7 группы легче притянуть 1 недостающий до октета электрон. В группе способность отдавать электроны будет увеличиваться сверху вниз, так ка увеличивается радиус атома и притяжение к ядру меньше. В периоде слева направо способность отдавать электроны уменьшается, потому что уменьшается радиус атома.
— Чем легче элемент отдает электроны с внешнего уровня, тем большими металлическими свойствами он обладает, а его оксиды и гидроксиды обладают большими основными свойствами. Значит, металлические свойства в группах увеличиваются сверху вниз, а в периодах справа налево. С неметаллическими свойствами все наоборот.
2. Описание элемента магния, астата, хлора
Рис. 1. Положение магния в таблице
В группе магний соседствует с бериллием и кальцием. Рис.1. Магний стоит ниже, чем бериллий, но выше кальция в группе. У магния больше металлические свойства, чем у бериллия, но меньше чем у кальция. Основные свойства его оксидов и гидроксидов изменяются также. В периоде натрий стоит левее, а алюминий правее магния. Натрий будет проявлять больше металлические свойства, чем магний, а магний больше, чес алюминий. Таким образом, можно сравнить любой элемент с соседями его по группе и периоду.
Кислотные и неметаллические свойства изменяются противоположно основным и металлическим свойствам.
3. Описание элемента хлора
Характеристика хлора по его положению в периодической системе Д.И.Менделеева.
Рис. 4. Положение хлора в таблице
. Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими неметаллическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
|
Рис. 5. Распределение электронов атома хлора по энергетическим уровням
Определяем высшую и низшую степень окисления хлора. Высшая степень окисления равна +7, так как он может отдать с последнего электронного слоя 7 электронов. Низшая степень окисления равна -1, потому что хлору до завершения необходим 1 электрон. Формула высшего оксида Cl2O7 (кислотный оксид), водородного соединения HCl.
4. Степень окисления
В процессе отдачи или присоединения электронов атом приобретает условный заряд. Этот условный заряд называется степенью окисления.
— Простые вещества обладают степенью окисления равной нулю.
— Элементы могут проявлять максимальную степень окисления и минимальную. Максимальную степень окисления элемент проявляет тогда, когда отдает все свои валентные электроны с внешнего электронного уровня. Если число валентных электронов равно номеру группы, то и максимальная степень окисления равна номеру группы.
Рис. 2. Положение мышьяка в таблице
Минимальную степень окисления элемент будет проявлять тогда, когда он примет все возможные электроны для завершения электронного слоя.
Рассмотрим на примере элемента №33 значения степеней окисления.
Это мышьяк As.Он находится в пятой главной подгруппе.Рис.2. На последнем электронном уровне у него пять электронов. Значит, отдавая их, он будет иметь степень окисления +5. До завершения электронного слоя атому As не хватает 3 электрона. Притягивая их, он будет иметь степень окисления -3.
Положение элементов металлов и неметаллов в Периодической системе Д.И. Менделеева.
Рис. 3. Положение металлов и неметаллов в таблице
В побочных подгруппах находятся все металлы. Если мысленно провести диагональ от бора к астату, то выше этой диагонали в главных подгруппах будут все неметаллы, а ниже этой диагонали — все металлы. Рис.3.
Используя Периодическую систему можно очень много сказать об элементе. Можно сравнить его с другими элементами, определить строение его атома, электронной оболочки атома.
5. План характеристики химического элемента
1. Символ элемента
2. Порядковый номер элемента
3. Значение относительной атомной массы элемента.
4. Число протонов, электронов, нейтронов.
5. Номер периода.
6. Номер и тип группы (тип элемента s -, p -,d -,f — элемент)
7. Металл или неметалл
8. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе.
9. Написать распределение электронов по атомным орбиталям – квантовую диаграмму.
10. Написать электронную формулу.
11. Зарисовать распределение электронов по энергетическим уровням
12. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный).
13. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
Подведение итога урока
На этом уроке вы узнали о Периодическом законе Менделеева, который описывает изменение свойств простых тел, а также формы и свойства соединений элементов в зависимости от величины их атомных масс. Рассмотрели, как по положению в Периодической системе можно описать химический элемент.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
Рекомендованное домашнее задание
1. №№ 1-4 (с.125) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Какие характеристики атома изменяются периодичности ?
3. Дайте характеристику химического элемента кислорода по его положению в Периодической системе Д.И.Менделеева.
Ïîõîæèå ïîñòû
Ñóëüôèä æåëåçà(II) (FeS) — âåùåñòâî, êîòîðîå îáðàçóåòñÿ ïðè âçàèìîäåéñòâèè æåëåçà ñ ñåðîé. Ïðèìåíÿåòñÿ êàê ñûðüå â ïðîèçâîäñòâå ÷óãóíà, à òàêæå ÿâëÿåòñÿ òâåðäûì èñòî÷íèêîì ñåðîâîäîðîäà. Íà ôîòîãðàôèÿõ ìîæíî çàìåòèòü ÷àñòèöû ìåòàëëè÷åñêîãî æåëåçà, êîòîðîå íå ïðîðåàãèðîâàëî ñ ñåðîé.
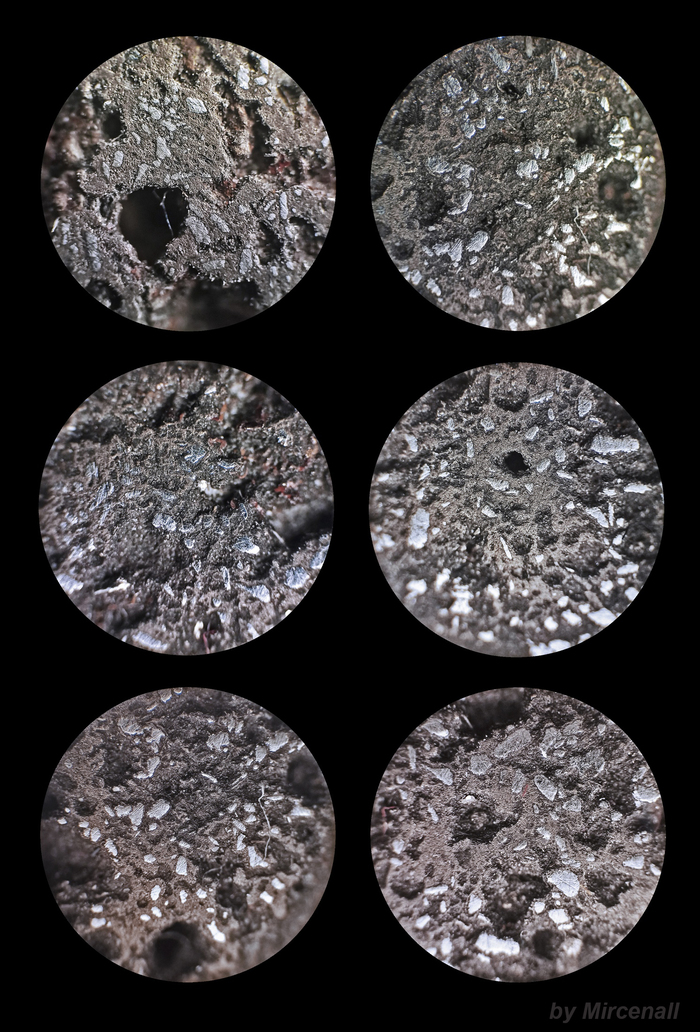
 ïðèðîäå ñóëüôèä æåëåçà(II) âñòðå÷àåòñÿ êðàéíå ðåäêî, îäíàêî ðàñïðîñòðàí¸í äèñóëüôèä æåëåçà(II) (FeS2), èçâåñòíûé êàê ìèíåðàë ïèðèò èëè ñåðíûé êîë÷åäàí.
vk.com/mircenall

Ïîêàçàòü ïîëíîñòüþ
3
Íîâûé ìåäüñîäåðæàùèé êîìïëåêñ, èäåþ ñòðîåíèÿ êîòîðîãî ïîäñêàçàëà ïðèðîäà, ýôôåêòèâíî ðàñùåïëÿåò âîäó â íåéòðàëüíîé ñðåäå. Ýòî îòêðûòèå ìîæåò ñäåëàòü áîëåå äîñòóïíûì ïîëó÷åíèå âîäîðîäà ñ ïîìîùüþ âîññòàíîâëåíèÿ âîäû.
Ìîëåêóëÿðíûé âîäîðîä äàâíî ðàññìàòðèâàþò êàê àëüòåðíàòèâó íåôòè è ãàçó. Åäèíñòâåííûé ïðîäóêò ñãîðàíèÿ âîäîðîäà âîäà, êîòîðàÿ ñàìà ìîæåò áûòü èñòî÷íèêîì âîäîðîäà. Ìíîãèå èññëåäîâàòåëüñêèå ãðóïïû ïî âñåìó ìèðó ñòàðàþòñÿ ðàçðàáîòàòü êàòàëèçàòîðû, ñïîñîáíûå ïîíèçèòü ýíåðãèþ âîññòàíîâëåíèÿ âîäû äî ìîëåêóëÿðíîãî âîäîðîäà è îáëåã÷èòü ïðîòåêàíèå ýòîé ðåàêöèè. Íàèáîëåå ýôôåêòèâíûå êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû â íàñòîÿùåå âðåìÿ êîîðäèíàöèîííûå ñîåäèíåíèÿ ðóòåíèÿ è èðèäèÿ. Ê íåäîñòàòêàì îáîèõ ìåòàëëîâ ìîæíî îòíåñòè èõ íèçêèå êîíöåíòðàöèè â çåìíîé êîðå è âûñîêóþ ñòîèìîñòü.
Íîâîå èññëåäîâàíèå äåìîíñòðèðóåò, ÷òî â ïðèñóòñòâèè ïîðôèðèíîâîãî êîìïëåêñà ìåäè ýëåêòðîêàòàëèòè÷åñêîå ðàñùåïëåíèå âîäû ïðîèñõîäèò ïðè íåéòðàëüíûõ çíà÷åíèÿõ ðÍ è ïðè íèçêîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà. Ïðè 310 ì è ðÍ 7 âîäà îêèñëÿåòñÿ ñ âûäåëåíèåì ìîëåêóëÿðíîãî êèñëîðîäà, à â êèñëîé ñðåäå (ïðè òîì æå ýëåêòðîäíîì ïîòåíöèàëå) äî ïåðåêèñè âîäîðîäà. Õîòÿ ìåäíûé êîìïëåêñ è íå ïðåâîñõîäèò ïî ïðîèçâîäèòåëüíîñòè êîìïëåêñû áëàãîðîäíûõ ìåòàëëîâ, âñå æå ýòî áîëüøîé øàã âïåðåä ìåíüøàÿ ýôôåêòèâíîñòü ïðîèçâîäíûõ ìåäè êîìïåíñèðóåòñÿ åå áîëüøåé ðàñïðîñòðàíåííîñòüþ è äåøåâèçíîé. Êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû íà îñíîâå ìåäè áûëè èçâåñòíû è ðàíåå, íî îíè ðàáîòàëè â ñèëüíîùåëî÷íîé ñðåäå è ïðè áîëüøîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà.
Èññëåäîâàòåëè èñõîäèëè èç òîãî, ÷òî â ïðîöåññå ôîòîñèíòåçà êëþ÷åâóþ ðîëü â îêèñëåíèè âîäû è âûäåëåíèè êèñëîðîäà èãðàåò ìàãíèéïîðôèðèíîâûé êîìïëåêñ. Òåì íå ìåíåå ñïîñîáíîñòü ìåäüïîðôèðèíîâîãî êîìïëåêñà êàòàëèçèðîâàòü îêèñëåíèå âîäû îêàçàëàñü ïðèÿòíîé íåîæèäàííîñòüþ äëÿ ìíîãèõ õèìèêîâ êàê ñïåöèàëèñòîâ ïî õèìèè ïîðôèðèíîâûõ êîìïëåêñîâ, òàê è òåõ, êòî çàíèìàëñÿ ðàñùåïëåíèåì âîäû. Åùå îäíà íåîáû÷íàÿ ÷åðòà ýòîãî êàòàëèçàòîðà îêèñëåíèå âîäû äî ïåðåêèñè âîäîðîäà ïðè íèçêèõ çíà÷åíèÿõ ðÍ. Ýòîò ïðîöåññ íå ñòîèò ðàññìàòðèâàòü êàê íîâûé ñïîñîá ïîëó÷åíèÿ H2O2, è âñå æå îí òðåáóåò âíèìàíèÿ. Óñòàíîâèâ, êàê îáðàçóåòñÿ ïåðåêèñü âîäîðîäà, èññëåäîâàòåëè ñìîãóò îïðåäåëèòü ìåõàíèçì ýòîé êàòàëèòè÷åñêîé ðåàêöèè è âûÿñíèòü, êàê ïîâûñèòü ýôôåêòèâíîñòü ðàñùåïëåíèÿ âîäû.


Ïîêàçàòü ïîëíîñòüþ
3
 îäíîì èç ïîñòîâ îá îëîâå ïèêàáóøíèêîâ çàèíòåðåñîâàëà òàêàÿ äåòàëü — ïðè òåìïåðàòóðå íèæå 13.2°C êîâêîå è ïëàñòè÷íîå îëîâî ïåðåõîäèò â äðóãóþ «ñåðóþ» àëëîòðîïíóþ ìîäèôèêàöèþ.

Ïðè ýòîì ïåðåõîä ñîïðîâîæäàåòñÿ óâåëè÷åíèåì îáúåìà íà 25,6 %, â ñâÿçè ñ ÷åì âîçíèê âîïðîñ
Ñîáñòâåííî ýòî ÿ è ðåøèë ïðîâåðèòü.
Ïåðâûì äåëîì íàøåë â ëàáîðàòîðèè ÷èñòîå îëîâî (ïðîâîëîêà ïðèïîÿ íå ïîäîéäåò, èáî îíà ñîäåðæèò ñâèíåö, êîòîðûé êàê ðàç òàêè ïðåäîòâðàùàåò ðàçðóøåíèå). Îëîâî õðàíèòñÿ â âèäå ìàëåíüêèõ ãðàíóë, íî ÿ ïåðåïëàâèë åãî â êóñîê ïîáîëüøå.

Äåëàòü èäåàëüíóþ äåðåâÿííóþ êîðîáêó áûëî áû ñëèøêîì äîëãî, òàê ÷òî ðåøèë çàëèòü êóñîê ìåòàëëà â ãèïñ è âûñòàâèòü íà ìîðîç íà äîëãîå âðåìÿ â çàêðûòîé êîðîáêå.


Êðîìå òîãî, ÷åì íèæå òåìïåðàòóðà, òåì áûñòðåå îñóùåñòâëÿåòñÿ ïåðåõîä (íàèáîëåå áûñòðîå ïðåâðàùåíèå íàáëþäàåòñÿ ïðè òåìïåðàòóðå íèæå -33°C). Ïîñêîëüêó íà÷àëî çèìû â ñòîëèöå âûäàëîñü òåïëûì, ÿ ðåøèë ïðîâîäèòü ýòîò ýêñïåðèìåíò ñ ñåðåäèíû ÿíâàðÿ. Ãèïñîâûé ñëåïîê ñ îëîâîì ÿ ïîëîæèë â êîðîáêó (äàáû çàùèòèòü åãî îò âîäû) è îñòàâèë íà ïîäîêîííèêå, ðåøèâ îòêðûòü ñïóñòÿ ìåñÿö.

×åðåç ìåñÿö ôîðìà îñòàëàñü ëåæàòü, êàê ëåæàëà. Îäíàêî êàê ðàç ñ ñåðåäèíû ôåâðàëÿ óäàðèëè ñèëüíûå ìîðîçû è ïðîöåññ äîëæåí áûë óñêîðèòüñÿ (òåì âðåìåíåì ïèêàáó íà÷àëî íàïîìèíàòü î ñåáå)
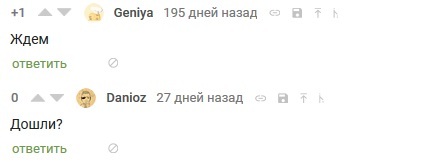

Îòêðûâ êîðîáêó óæå â ìàðòå, ÿ óâèäåë æåëàííîå èçìåíåíèå — òðåùèíó, ðàçäåëèâøóþ ñëåïîê íà äâå ïîëîâèíû!

Àêêóðàòíî äîñòàâ åãî, ÿ ðàçäåëèë ïîëîâèíêè ôîðìû è îòòóäà ïîñûïàëñÿ òåìíûé ïîðîøîê ñ ìåòàëëè÷åñêèì áëåñêîì (è îñòàòîê êóñêà áåëîãî îëîâà, ïîâåðõíîñòü êîòîðîãî áûëà òàêæå âñÿ â ñåðîé ìîäèôèêàöèè ).  êîíöå êîíöîâ îíî-òàêè ðàçîðâàëî ãèïñ.

Ñåðîå îëîâî ñêîðåå ïîõîæå íà ãðàôèò ñ áëåñêîì ñâèíöà, ÷åì íà ìåòàëë. ×òîáû íàãëÿäíî ïðîäåìîíñòðèðîâàòü îòëè÷èå, ÿ âûñûïàë ðÿäîì ïîðîøîê áåëîãî îëîâà è ïîëó÷åííîå ñåðîå. Îäíàêî âåðíóòü åìó èñõîäíîå ñîñòîÿíèå íå ñîñòàâëÿåò òðóäà — òðåáóåòñÿ ëèøü ðàñïëàâèòü α-îëîâî è ñëèòîê ñíîâà áóäåò ÿâëÿòüñÿ áåëûì β-îëîâîì

Òàêèì îáðàçîì ïðåäïîëîæåíèå î ðàçðûâàþùåì êîíòåéíåðå îëîâå ïîäòâåðæäåíî

P.S. îòäåëüíàÿ áëàãîäàðíîñòü ñåäüìîé ïàðòèè ãðàíóëèðîâàííîãî îëîâà Óðàëüñêîãî çàâîäà õèìðåàêòèâîâ îò íîÿáðÿ 1977 ãîäà. Èíà÷å áû ýêñïåðèìåíò íå ñîñòîÿëñÿ.


Ïîêàçàòü ïîëíîñòüþ
12
Êðèñòàëëû ñåðåáðà íà ìåäè.

Ñåðåáðî âûäåëÿåòñÿ íà òðåóãîëüíûõ ìåäíûõ ïëàñòèíêàõ, ïîãðóæåííûõ â ðàñòâîð íèòðàòà ñåðåáðà

Ìåäü
Öèíê

Ñåðåáðî

Îëîâî

Ñâèíåö

Ïîêàçàòü ïîëíîñòüþ
2
Îáðàçîâàíèå êðèñòàëëîâ îëîâà ïðè ýëåêòðîëèçå ðàñòâîðà õëîðèäà îëîâà â ñåðíîé êèñëîòå

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïîä ìèêðîñêîïîì

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïðè íèçêîé êîíöåíòðàöèè õëîðèäà îëîâà è ìàëûõ îáúåìàõ ðàñòâîðà (òàêæå óâåëè÷åíî)

Ðåàêöèÿ îëîâà ñ àçîòíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ ñîëÿíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ öàðñêîé âîäêîé (ñìåñü àçîòíîé è ñîëÿíîé êèñëîòû) ïðîòåêàåò, îäíàêî, áîëåå áóðíî

«Îëîâÿííàÿ ÷óìà» — îñîáîå ñâîéñòâî ýëåìåíòà, êîòîðîå çàêëþ÷àåòñÿ â òîì, ÷òî ïðè òåìïåðàòóðå íèæå 13,2 °C ìåòàëëè÷åñêîå (áåëîå) îëîâî (β-Sn) ïåðåõîäèò â äðóãîå ôàçîâîå ñîñòîÿíèå ñåðîå îëîâî (α-Sn), â êðèñòàëëè÷åñêîé ðåø¸òêå êîòîðîãî àòîìû ðàñïîëàãàþòñÿ ìåíåå ïëîòíî. Ïðîèñõîäèò ýòî ïðî ïðè÷èíå óâåëè÷åíèÿ óäåëüíîãî îáú¸ìà ÷èñòîãî îëîâà íà 25,6 %

Îëîâî èìååò íåáîëüøóþ òåìïåðàòóðó ïëàâëåíèÿ (232 °C) è ëåãêî ïåðåõîäèò â æèäêîå ñîñòîÿíèå ïîä äåéñòâèåì ïëàìåíè ãîðåëêè

Ãîðåíèå ìàëåíüêîãî êóñî÷êà îëîâà (ìîìåíòàëüíîå îêèñëåíèå)

Ïîêàçàòü ïîëíîñòüþ
6

Ðîñò êðèñòàëëîâ ñåðåáðà íà ìåäíîé ïðîâîëîêå (â ðàñòâîðå íèòðàòà ñåðåáðà)

Ðåàêöèÿ ñåðåáðà ñ àçîòíîé êèñëîòîé (ñ âûäåëåíèåì äèîêñèäà àçîòà)

Îáðàçîâàíèå õëîðèäà ñåðåáðà

Ðåàêöèÿ «Ñåðåáðÿíîå çåðêàëî» (â ïðèñóòñòâèè àëüäåãèäîâ èäåò âîññòàíîâëåíèå ìåòàëëà èç àììèà÷íîãî êîìïëåêñà)

Îáðàçîâàíèå ñóëüôèäà ñåðåáðà ïðè äîáàâëåíèè òèîñóëüôàòà

Îáðàçîâàíèå õðîìàòà ñåðåáðà

Âçðûâ îò íàãðåâàíèÿ àöåòèëåíèäà ñåðåáðà

Îáðàçîâàíèå áðîìèäà è èîäèäà ñåðåáðà

Ñåðåáðî ìîæíî ðàñïëàâèòü õîðîøåé ãàçîâîé ãîðåëêîé

Ïîêàçàòü ïîëíîñòüþ
6
Ðåàêöèÿ ñìåñè æåëåçà è ñåðû îò íàãðåòîé ïàëî÷êè (îáðàçîâàíèå ñóëüôèäà)

Îáðàçîâàíèå ñèëèêàòà æåëåçà, ïðè äîáàâëåíèè õëîðèäà ê ðàñòâîðó ñèëèêàòà íàòðèÿ

Îáðàçîâàíèå êðàñèòåëÿ «Áåðëèíñêàÿ ëàçóðü» ( äîáàâëåíèå êðàñíîé êðîâÿíîé ñîëè ê ðàñòâîðó æåëåçà 2+)

Ðåàêöèÿ «Êðîâàâîå æåëåçî» (æåëåçíàÿ ïðîâîëîêà â ðàñòâîðå òèîöèàíàòà êàëèÿ, ïåðåêèñè è õëîðîâîäîðîäà)

Ãîðåíèå ñòàëüíîé âàòû

Ãîðåíèå ñòàëüíîé âàòû ïîä óâåëè÷åíèåì
Ðåàêöèÿ ãîðÿùåé ñòàëüíîé âàòû ñ õëîðîì è îáðàçîâàíèå õëîðèäà æåëåçà III

Ãîðåíèå ïèðîôîðíîãî æåëåçà (ìåëêîäèñïåðñíûé ïîðîøîê æåëåçà, êîòîðûé ñàìîâîçãîðàåòñÿ îò êèñëîðîäà âîçäóõà)

Òåðìèòíàÿ ñìåñü îêñèäà æåëåçà III è àëþìèíèÿ

Îõëàæäåíèå ñòàëè íà ïðîèçâîäñòâå

Ïîêàçàòü ïîëíîñòüþ
7
Íàãðåâàíèå è ãîðåíèå ëèòèÿ

Êîððîäèðîâàíèå è ïëàâëåíèå ëèòèÿ íà âîçäóõå ïðè íàãðåâàíèè

Ðåàêöèÿ ëèòèÿ ñ äðåâåñèíîé (âîäîé, çàêëþ÷åííîé â å¸ ñòðóêòóðå)

Ðåàêöèÿ ëèòèÿ ñ àçîòíîé êèñëîòîé

