Ионы какого металла обладают наибольшими окислительными свойствами

Химия |
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
- Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
Распространённые окислители и их продукты[править | править код]
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2кислород | Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) +0,401 (в щелочной среде) | |
| O3озон | Разные, включая кетоны и альдегиды | +2,07 (в кислой среде) | |
| Пероксиды | Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | ||
| Hal2галогены | Hal−; окисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 | |
| ClO−гипохлориты | Cl− | ||
| ClO3−хлораты | Cl− | ||
| HNO3азотная кислота | с активными металлами, разбавленная с активными металлами, концентрированная с тяжёлыми металлами, разбавленная c тяжёлыми металлами, концентрированная | NH3, NH4+ NO NO NO2 | |
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами с активными металлами | SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы S H2S | |
| Шестивалентный хром | Cr3+ | +1,33 | |
| MnO2оксид марганца(IV) | Mn2+ | +1,23 | |
| MnO4−перманганаты | кислая среда нейтральная среда сильнощелочная среда | Mn2+ MnO2 MnO42− | +1,51 +1,695 +0,564 |
| Катионы металлов и H+ | Me0 H2 | См. Электрохимический ряд активности металлов |
Зависимость степени окисления от концентрации окислителя[править | править код]
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление.
В качестве примера — реакция азотной кислоты с цинком:
- Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
- 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
- 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
- 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
- 4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Сильные окислители[править | править код]
Сильными окислительными свойствами обладает «царская водка» — смесь одного объёма азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
NOCl=NO + Cl
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе.
Царская водка окисляет даже благородные металлы — золото и платину.
Селеновая кислота — одна из немногих неорганических кислот, в концентрированном виде способная окислять золото. Более сильный окислитель даже в умеренно разбавленном растворе, чем серная кислота. Способна к окислению соляной кислоты по уравнению:
При этом продуктами реакции являются селенистая кислота, свободный хлор и вода. В то же время концентрированная серная кислота не способна окислять HCl.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
С6H5-CH2-CH3 + [O] → C6H5COOH + …
C6H6 + [O] → HOOC-(CH2)4-COOH
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
К сильным окислителям относятся также оксид меди(III), озонид цезия, надпероксид цезия, все фториды ксенона.
Очень сильные окислители[править | править код]
Условно к «очень сильным окислителям» относят вещества, превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, фторид серебра(II), катионная форма Ag2+, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
См. также[править | править код]
- Окислительно-восстановительные реакции
1. Отметьте ряды, в которых основные свойства оксидов металлов убывают:
1) ВаО, Cs2О, Rb2О
2) Li2О, К2О, Cs2О
3) Аl2О3, MgO, Na2О
4) СаО, MgO, ВеО
2. Какое утверждение по отношению к металлам являются верными:
1) большая часть химических элементов является металлами
2) гидроксиды металлов проявляют кислотные свойства
3) для металлов характерны окислительные свойства
4) металлы плохо проводят электрический ток
3. Какие утверждения для металлов неверны:
а) металлы составляют большинство элементов Периодической системы;
б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов;
в) в химических реакциях для металлов характерны восстановительные свойства;
г) в каждом периоде атом щелочного металла имеет наименьший радиус.
1) а, б
2) а, в
3) б, в
4) б, г
4. Укажите справедливые утверждения:
а) все элементы d- и f-семейств являются металлами;
б) среди элементов р-семейства нет металлов;
в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами;
г) металлы не могут образовывать гидроксиды с кислотными свойствами.
1) а, б
2) а, в
3) б, в
4) в, г
5. Отметьте ряд, в котором находятся металлы, гидроксиды и оксиды которых проявляют амфотерные свойства:
1) Cs, Fr, Ва
2) Mg, Na, К
3) Al, Ве, Zn
4) Са, Sr, Cs
6. Амфотерным оксидом является:
1) ВаО
2) Li2O
3) Аl2O3
4) MgO
7. В атомах каких металлов в основном состоянии на энергетическом d-подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
1) а, б
2) а, г
3) б, в
4) б, г
8. Окислительные свойства какого иона наиболее ярко выражены:
1) Сu2+
2) Pb2+
3) Sn2+
4)Zn2+
9. Какой из оксидов является кислотным:
1) MnO;
2) Mn2O3;
3) MnO2;
4)Mn2O7.
10. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
1) K2O;
2) MnO;
3) Cr2O3;
4) Mn2O7.
11. Химическая реакция возможна между:
1) Cu и H2O
2) Au и H2
3) Na и Cl2
4) Fe и NaCl
12. Выберите реакцию, соответствующую схеме: Ме° — nе → Меn+
1) 2КОН + H2SO4 = K2SO4 + 2Н2O
2) СаО + СO2 = СаСО3
3) Fe + 2НСl = FeCl2 + Н2
4) FeO + Н2 = Fe + Н2O
13. Активнее других реагирует с кислородом:
1) Al
2) Ag
3) Zn
4) Ва
14. Амфотерным оксидом является:
1) СаО
2) ВаО
3) ZnO
4) CuO
15. Схеме: Men+ + ne → Me0 соответствует реакция:
1) Mg + S = MgS
2) NaOH + HC1 = NaCl + H2O
3) Fe2O3 + 3H2 = 2Fe + 3H2O
4) MgO + CO2 = MgCO3
16. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты:
а) Cu; б) Zn; в) Fe; г) Ag.
1) а, б
2) а, г
3) б, в
4) б, г
17. Схеме: Меn+ + nе → Ме° соответствует реакция:
1) 2Аl + 3S = Al2S3
2) Fe2O3 + 2Аl = Аl2O3 + 2Fe
3) Са + 2Н2O = Са(ОН)2 + Н2
4) MgO + СO2 = MgCO3
18. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO→ и CuSO4 + Zn →; в) AgNO3 →и Cr2O3 + Al →;
б) ZnS + O2 → и Fe2O3 + H2 →; г) KNO3 → и ZnO + C →;
1) а, б
2) а, в
3) б, в
4) б, г
19. Активнее других взаимодействует с кислородом:
1) Li
2) Na
3) К
4) Pt
20. С водой только при нагревании реагируют:
а) натрий; б) цинк; в) медь; г) железо.
1) а, б
2) а, г
3) б, в
4) б, г
Ответы:
- 4
- 1
- 4
- 2
- 3
- 3
- 4
- 1
- 4
- 4
- 3
- 3
- 4
- 3
- 3
- 3
- 2
- 2
- 3
- 4
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ всех лет с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Упражнения для самостоятельной работы
1.Какой металл в следующем ряду является наиболее активным: Fe, Zn, Mn, К, Au? Почему?
2.Ионы какого металла обладают наибольшими окислительными свойствами: Cr3+, Са2+, Mn2+, Ag+?
3.Какие из следующих реакций возможны: а) Zn + HCl ;
б) Hg + H2SO4 ;
разб.
в) Cu + NiSO4 ; г) Sn + CuСl2 ; д) Zn + NaCl ;
е) Ag + Н3РО4 ; ж) Аl + AuСl3 ; з) Cu + HgCl2 ?
Допишите уравнения реакций, возможных в водных растворах.
4.Какие продукты получатся в результате взаимодействия металлического алюминия:
а) с водным раствором CuSO4,
б) с водным раствором серной кислоты? Напишите уравнения реакций.
5.Какие продукты получатся в результате реакции металлического цинка с водным раствором сульфата никеля (II)? Является ли эта реакция окислительно-восстановительной? Почему?
§ 7.2. Электролиз
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы электролита будут двигаться к электродам: катионык катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду) (рис. 24).
290
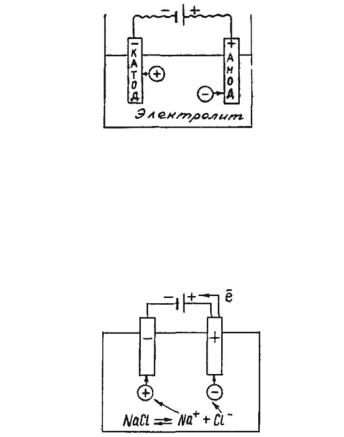
Рис. 24. Схема движения ионов в растворе или расплаве электролита под действием электрического тока
На катоде катионы принимают электроны и восстанавливаются. На аноде анионы отдают электроны и окисляются.
В теоретическом плане простейшим примером электролиза является электролиз расплавов.
Рассмотрим процесс электролиза расплава NaCl (рис. 25).
Рис. 25. Схема электролиза расплава хлорида натрия
В расплаве хлорид натрия диссоциирует на ионы:
t°
NaCl Na+ + Сl–.
Под действием электрического поля катионы Na+ движутся к катоду и принимают от него электроны:
Na+ + e# = Na0 — процесс восстановления. Анионы Сl– движутся к аноду и отдают электроны: 2Сl– – 2e# = Сl20 — процесс окисления.
291

Составим суммарное уравнение процесса электролиза:
2Na+ + e# = Na0
12Сl– – 2e# = Сl20
2Na+ + Сl– = 2Na0 + Сl20
или:
эл. ток
2NaСl ====2Na + Сl2 .
На катоде выделяется металлический натрий, на аноде — газообразный хлор.
Эта реакция является окислительно-восстановительной; на катоде всегда идет процесс восстановления, на аноде всегда идет процесс окисления.
• Электролизом называется окислительно-восстанови- тельный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Сущность электролиза состоит в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Электролиз расплавов и электролиз растворов отличаются друг от друга.
В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды и ионы Н+, ОН– — продукты диссоциации Н2О. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул Н2О в электролизе.
Для определения результатов электролиза водных раство-
ров существуют следующие правила:
Процесс на катоде не зависит от материала катода, а зависит от положения металла в электрохимическом ряду напряжений:
1.Если катион электролита находится в начале ряда напря-
жений (по Аl включительно), то на катоде идет процесс восстановления воды (выделяется Н2 ):
2H2O + e# = H2 + 2OH–.
292
Катионы металла не восстанавливаются, остаются в растворе.
2.Если катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
3.Если катион электролита находится в ряду напряжений после водорода, то на катоде идет только процесс восстановления ионов металла.
4.Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы того металла, который имеет наибольшее алгебраическое значение электродного потенциала.
Рассмотренные правила сведены в табл. 28.
Таблица 28 | |||
Катодные процессы в водных растворах солей | |||
Электрохимический ряд напряжений металлов | |||
Li, K, Ca, | Mn, Zn, Fe, | H2 | Cu, Hg, Ag |
Na, Mg, Al | Ni, Sn, Pb | Pt, Au | |
Меn+ — не восста- | |||
навливаются | Меn++пe = Ме0 | Меn++пe# = Ме0 | |
2Н2О + 2e# = | 2Н2О + 2e# = | ||
= Н + 2OН– | = Н + 2OН– | ||
2 | 2 | ||
Процесс на аноде зависит от материала анода и от природы аниона:
1.Если анод растворимый (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идет окисление металла анода.
2.Если анод нерастворимый, т. е. инертный (уголь, графит, платина, золото), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей оксокислот и фторидов на аноде идет процесс окисления воды (выделяется кислород); анион не окисляется, остается в растворе. При электролизе растворов щелочей идет окисление гидроксид-ионов.
293

Анионы по их способности окисляться располагаются в следующем порядке:
I–; Br–; S2–; Cl–; ОН–; SO42–; NO3–; F–
восстановительная активность уменьшается
Рассмотренные правила сведены в табл. 29.
Таблица 29 | |||
Анодные процессы в водных растворах | |||
Анод | Кислотный остаток Асm– | ||
бескислородный | кислородсодержащий | ||
Нерастворимый | Окисление аниона | В щелочной среде: | |
(кроме фторидов) | 4ОН– – 4e# = | ||
Асm – me# = Ac0 | = О2 + 2Н2О | ||
в кислой, нейтральной | |||
средах: | |||
2Н2О – 4e# = | |||
= O | + 4Н+ | ||
2 | |||
Растворимый | Окисление | металла анода | |
Me0 – ne# = Men+ | |||
Электролиз широко используют в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий подучают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Важной отраслью применения электролиза является защита металлов от коррозии; при этом электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
Типовая задача № 1.
Написать уравнения электролиза раствора КСl, если:
а) анод нерастворимый; б) анод растворимый (медный). Р е ш е н и е .
а) Анод нерастворимый
KCl K+ + Cl– | |
катод (–): | анод (+): |
2Н2О + 2e# = Н2 + 2ОН– | 2Сl– – 2e# = Сl20 |
294

Суммарное ионное уравнение:
2Н2О + 2Сl– = Н2 + Cl2 + 2OН– Суммарное молекулярное уравнение:
эл. ток
2КСl + 2Н2О ===== Н2 + Cl2 + 2KOН
вторичный
продукт
электролиза (в катодном пространстве)
б) Анод растворимый (медный)
KCl K+ + Cl– | |||
анод (+): | катод (–): | ||
Cu0 – 2e# = Cu2+ | Cu2+ + 2e# = Cu0 | ||
перенос ионов меди с анода на катод и выделение чистой меди
на катоде
Концентрация КСl в растворе не меняется.
Суммарное уравнение электролиза с растворимым анодом написать нельзя.
Типовая задача № 2.
Написать схему электролиза ZnCl2 с угольными электродами. Решение:
ZnCl | 2 | Zn2+ | + 2Сl– | |
катод (–): | анод (+): | |||
Zn2+ + 2e# = Zn0 | 2Сl– – 2e# = Сl2 | |||
2Н2О + 2e# = Н2 + 2ОН– | ||||
Суммарное уравнение реакции в данном примере написать нельзя, так как неизвестно, какая часть общего количества электричества идет на восстановление воды, а какая — на восстановление ионов цинка.
Типовая задача № 3.
Написать уравнение реакции электролиза водного раствора, содержащего смесь Cu(NO3)2 и AgNO3, с инертными электродами.
Решение:
Cu(NO3)2 Cu2+ + 2NO3–
AgNO3 Ag+ + NO3–
295

катод (–): возможны процессы Ag+ + e# = Ag0
Cu2+ + 2e# = Cu0
В первую очередь будут восстанавливаться катионы серебра (см. ряд напряжений). После практически полного осаждения их из раствора начнется восстановление Cu2+
анод (+):
2H2O – 4e# = O2 + 4H+
Вторичный продукт электролиза в анодном пространстве — азотная кислота HNO3
Суммарные уравнения процессов, проходящих в растворе: ионные:
4Ag+ + 2Н2О = 4Ag0 + O2 + 4H+
2Cu2+ + 2Н2О = 2Cu0 + O2 + 4H+
молекулярные:
4AgNO3 + 2Н2О = 4Ag + O2 + 4HNO3
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Типовая задача № 3.
Написать уравнение реакции электролиза раствора NaOH. Решение:
NaOH Na+ + ОН– | ||||||||||
катод (–): | анод (+): | |||||||||
2Н2О + 2e# = Н2 + 2ОН– | 4OН– – 4e# = O2 + 2Н2O | |||||||||
Суммарное уравнение: | ||||||||||
4Н | 2 | O + 4OН– = 2H | 2 | + O | + 4OН– + 2Н | 2 | О, | |||
2 | ||||||||||
2Н | 2 | О = 2Н | 2 | + О | ||||||
2 | ||||||||||
Вопросы для контроля
1.Что называется электролизом?
2.Какой электрод называют катодом, какой — анодом?
3.Какие процессы протекают на катоде, на аноде?
4.Чем отличается электролиз расплавов от электролиза водных растворов?
5.Какие металлы можно получить при электролизе расплавов и нельзя получить при электролизе водных растворов их солей?
296
6.Для каких металлов характер катодных процессов при электролизе растворов и расплавов их солей одинаков?
7.Окисляются ли на аноде анионы оксокислот при электролизе водных растворов соответствующих кислот и образуемых ими солей?
8.Может ли растворяться катод при электролизе?
9.Какие типы анодов вы знаете?
10.Будет ли растворяться при электролизе анод: из железа, графита, платины, меди?
Упражнения и задачи для самостоятельной работы
1.Напишите уравнения электролиза водных растворов йодида калия, сульфата кальция с инертными электродами.
2.Напишите уравнения электролиза расплава и водного раствора хлорида бария. Чем отличаются эти процессы?
3.Составьте уравнения электролиза водных растворов следующих солей (электроды графитовые):
а) К3РО4, б) Zn(NO3)2, в) MnI2, г) PtSO4, д) SnBr2.
4.Составьте уравнения электролиза водных растворов следующих веществ (анод нерастворимый):
а) Ва(ОН)2, б) SrCl2, в) НСl, г) ZnF2, д) HF, e) Cr(NО3)3, ж) AuСl3, з) CoSO4, и) H2SO4.
5.Составьте уравнения электролиза водного раствора AgNO3:
а) с медными электродами, б) с графитовыми электродами. Чем отличаются процессы? Почему?
6.В каких случаях при электролизе на катоде выделяется водород? Приведите примеры с уравнениями реакций.
7.В каких случаях при электролизе на аноде выделяется кислород? Приведите примеры с уравнениями реакций.
§ 7.3. Общая характеристика металлов
Как известно, все химические элементы и образуемые ими простые вещества делятся на металлы и неметаллы.
Так как в периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определенно указать положение элементов-ме- таллов и элементов-неметаллов в периодической системе. Если провести диагональ (табл. 30) от элемента бора В (по-
297
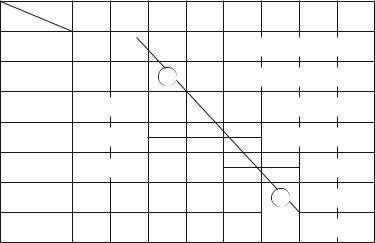
рядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп — неметаллами. Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Те, As, Nb), обладают двойственными свойствами; в некоторых своих соединениях ведут себя как металлы; в некоторых — проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление элементов на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов элементов 3-го периода:
Положение элементов-металлов и неметаллов | Таблица 30 | ||||||||
в периодической системе | |||||||||
Группы | II | III | IV | V | VI | VII | VIII | ||
Периоды | I | ||||||||
1 | Элементы главных | ||||||||
2 | Все | B | Бор | подгрупп являются | |||||
3 | элементы | Al | неметаллами | ||||||
4 | являются | Ti | As Элементы побочных | ||||||
Ga | Ge | ||||||||
5 | металлами | Nb | подгрупп | ||||||
Sb | Te | ||||||||
6 | At | являются | |||||||
7 | Астат | металлами | |||||||
298 | |||||||||

Na | Mg | Al | Si | P | S | Cl |
Радиус | ||||||
атома (нм) 0,19 | 0,16 | 0,143 | 0,134 | 0,130 | 0,104 | 0,099 |
Число е# | |||||||
на внеш- | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
нем слое | |||||||
Электроот- | |||||||
рицатель- | 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 |
ность (ЭО) |
Слева направо:
а) радиус атомов уменьшается; б) заряд ядра увеличивается;
в) электроотрицательность увеличивается; г) число электронов на внешнем слое увеличивается;
д) прочность связи внешних электронов с ядром увеличивается;
е) способность атомов отдавать электроны уменьшается.
Поэтому: | ||
Na Mg | Al | Si P S Cl |
металлы | неметаллы | |
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Рb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi — пять, атомы полония Ро — шесть. Атомы металлов имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-метал- лы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути). Кристаллическая решетка металлов образуется за счет металлической связи
299


 .
.