H2o2 какие свойства проявляет
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ничто не красит женщину так, как перекись водорода (Народная мудрость)
Мальчики и девочки, папы и мамы, бабушки и дедушки, химички и химичи, составители и эксперты ЕГЭ (особенно!) читайте внимательно серию статей об участии пероксида водорода в ОВР. Иначе, на ЕГЭ может случиться конфуз, когда вы не сможете написать реакции в 30-м и 32-м заданиях, не решится 34-я задача, будут непонятны многие реакции в тестовых заданиях типа 8, 9, 10, 14, 17, 21.
Химический портрет пероксида водорода
Пероксид водорода H2O2 — химическое соединение водорода с кислородом. Структурная формула Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Чистый пероксид водорода разлагается (со взрывом) на воду и кислород. В разбавленных водных растворах пероксид водорода более устойчив.
► Впервые пероксид водорода получил в 1818 г. французский химик Л.Ж. Тенар, действуя охлажденной соляной кислотой на пероксид бария
BaO2 + 2HCl → BaCl2 + H2O2
Пероксид бария получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария
BaCl2 + Ag2SO4 → 2AgCl↓ + BaSO4↓
Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту, поскольку при этом сульфат бария остается в осадке, поскольку карбонат бария также нерастворим
BaO2 + H2SO4 → BaSO4↓ + H2O2
Атом кислорода в пероксиде водорода имеет степень окисления (-1), поэтому в окислительно-восстановительных реакциях пероксид может выполнять функцию как окислителя, так и восстановителя
► Пероксид водорода — сильный окислитель, легко отдает атом кислорода. При действии безводной и концентрированной Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются.
Обратите внимание! Если пероксид — окислитель, то продуктом восстановления кислорода будет вода (Н2О). На шкале степеней окисления окислитель «падает вниз»
► H2O2 обладает свойствами слабого восстановителя.
Обратите внимание! Если пероксид — восстановитель, то продуктом его окисления будет свободный кислород (О2). На шкале степеней окисления восстановитель «поднимается вверх»
В следующих статьях вас ожидает много ОВР с пероксидом водорода. Это будут не только классические, но и нестандартные, очень сложные реакции, вызывающие дрожь даже у мудрых экспертов ЕГЭ. Я проведу анализ каждой реакции и обязательно научу вас писать все уравнения ОВР. Со мной не пропадете! Если будете внимательно читать статьи, работать над заданиями и выполнять все рекомендации — высокий балл на ЕГЭ будет вам заслуженной наградой!
Вы не умеете писать ОВР методом полуреакций?! Спокойствие, только спокойствие! Самый лучший в мире репетитор в полном расцвете сил поможет вам! Заходите ко мне на сайт, посетите страницу «Окислительно-восстановительные реакции». И будет вам счастье!
А пока — пока! Успехов и удачи! До встречи на полях Яндекс Дзен! Не забывайте подписаться на канал и поставить лайк!
Вы хотите сдавать ЕГЭ по химии и биологии? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Репетитор по химии и биологии кбн В.Богунова
Пероксид водорода
Пероксид водорода (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2 • 2H2O.
Строение молекулы
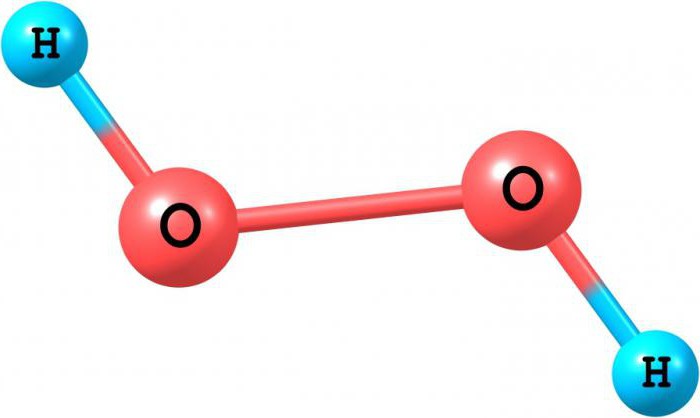
Молекула Н2O2 содержит в своем составе пероксидный анион O2-2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
H+1-O-1-O-1-H+1
Физические свойства
В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства
Разложение Н2O2 (диспропорционирование)
2Н2O2 = 2Н2O + O2↑
2O-1 — 2e- → O20
2O-1 +2e- → 2О-2
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Н2O2 — слабая кислота
Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме:
Н2O2 = Н+ + HO2-
(Кдисс = 1,5 * 10-12 при 20°С)
Кислотные свойства проявляются в реакциях со щелочами с образованием солей — средних (пероксидов) и кислых (гидропероксидов), например:
Н2O2 + Ва(ОН)2 = ВаO2 + 2Н2O
пероксид бария
Гидролиз пероксидов металлов
Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2:
К2O2 + 2Н2O = 2КОН + Н2O2
Получение Н2O2 из пероксидов металлов
Так как Н2O2 — очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например:
ВаO2 + H2SO4 = Н2O2 + BaSO4↓
ВаO2 + СO2 + Н2O = Н2O2 + ВаСO3↓
Н2O2 сильный окислитель
Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде:
Н2O-2 + 2H+ + 2e- → 2Н2O-2
Окисление неорганических веществ
Примеры:
ЗН2O2 + 2NH3 = N2 + 6Н2O
4Н2O2 + H2S = H2SO4 + 4Н2O
Н2O2 + 2HI = I2 + 2Н2O
4Н2O2 + PbS = PbSO4 + 4Н2O
ЗН2O2 + 2СrСl3 + 10КОН = 2К2СrO4 + 6KCl + 8Н2O
Н2O2 + 2FeSO4 + H2SO4 = Fe2(SO4)3 + 2Н2O
Окисление органических веществ
Конц. водные растворы Н2O2 в смеси с органическими веществами способны к воспламенению и взрыву при ударе. Например, органические кислоты окисляются до СO2 и Н2О(как при горении в O2):
4Н2O2 + CH3COOH = 2CO2↑ + 6Н2O
Н2O2 + Н2С2O4 = 2СO2↑ + 2Н2O
Пероксиды щел. Me — очень сильные окислители
Окисляют многие неорганические и органические вещества, например:
4Na2O2 + СН3СООН = 2Na2CO3 + 4NaOH
Na2O2 + SO2 = Na2SO4
Важной реакцией является диспропорционирование пероксида Na при взаимодействии с углекислым газом:
2Na2O2 + 2СO2 = 2Na2CO3 + O2↑
На этой реакции основано использование Na2O2 в автономных дыхательных аппаратах и в замкнутых помещениях для поглощения СO2 и образования O2.
Н2O2 — слабый восстановитель (в реакциях с очень сильными окислителями)
Окисление пероксида водорода обычно протекает по схеме:
2Н2O-2 — 2e- → O02↑ + 2H+
Примеры реакций:
5Н2O2 + 2КМnO4 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8Н2O
ЗН2O2 + К2Сr2O7 + 4H2SO4 = 3O2↑ + Cr2(SO4)3 + K2SO4 + 7Н2O
3Н2O2 + KClO3 = 3O2↑ + KCl + 3Н2O
3Н2O2 + 2AuCl3 = 3O2↑ + 2Au + 6HCl
Перекись водорода (Н2О2) — химическое соединение из группы, включающей пероксиды. Впервые вещество было получено Луи Тенаром в 1818 году путем подкисления раствора перекиси бария азотной кислотой. Это сильный окислитель во многих химических реакциях, таких как окисление ракетного топлива (80%), мощное дезинфицирующее и отбеливающее средство.
Перекись водорода классифицируется как одна из активных форм кислорода. Химическая формула агента состоит из двух атомов водорода и двух атомов кислорода. Благодаря этой структуре молекула под действием органических и неорганических веществ, тепла, света быстро разлагается с выделением атомарного кислорода. Дезинфицирующее действие самой перекиси водорода довольно слабое, но при распаде, оно проявляется быстро и эффективно благодаря свободным атомам кислорода.
Химическая формула перекиси водорода, строение молекулы
Н-О-O-H-связи вокруг атомов кислорода в молекуле H2O2 расположены под углом (аналогично H-O-H-связям в воде), причем атомы H-O-O-H образуют двугранный угол (в твердой фазе около 90°).

Физические свойства пероксида
Чистый пероксид водорода сильно отличается от знакомого всем 3%раствора, который присутствует в каждой в домашней аптечке.
При комнатной температуре он является сиропообразной, бесцветной (концентрированная принимает бледно-голубой цвет), жидкостью с температурой замерзания -0,41 ° С и температурой кипения около 150 ° С. Вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды.
Хорошо растворяется в полярных (органических) растворителях и до любой концентрации — в воде. Имеет металлический привкус. Молярная масса 34,01 г/моль.
Химические свойства
Пероксид обладает сильными окислительными свойствами, возникающими в результате образования атомарного кислорода:
H2O2 → H2O + O
Чистая перекись водорода без стабилизаторов — очень нестабильна и подвергается экзотермическому разложению, часто взрывчатому. Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом.
2H2O2 → 2H2O + O2
Подобное разложение катализируется многими веществами, например, серебром и платиной, оксидом марганца, соединениями йода:
H2O2 + I → H2O + IO
H2O2 + IO → H2O + I+ O2
Эффективным ферментом, который расщепляет перекись водорода, является каталаза.
Благодаря тому, что пергидроль легко реагирует со многими металлами и разлагается при контакте со светом, его следует хранить в герметично закрытой таре, изготовленной из толстостенного полиэтилена или алюминия, не подвергаться воздействию дневного света и источников тепла. Его смесь с карбонатом гидрата натрия (Na2CO3 · 1,5H2O2) является относительно стабильной и безопасной в использовании.

Перекись водорода имеет слабые кислотные свойства. Слабее угольной кислоты. В водных растворах диссоциирует в соответствии с уравнением:
Н2О2 = Н+ +ООН-
В присутствии восстановителей пероксид водорода ведет себя как окислитель (O-I → O-II), например :
2 NH2OH + 6H2O2 → 2 HNO3 + 8H2O
В присутствии окислителей пероксид показывает восстановительные свойства (O-I → O0), например, в реакции с перманганатом калия в кислых условиях :
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
или с солями серебра (I) в щелочной среде:
2AgNO3 + H2O2 + 2KOH → 2Ag + O2 + 2H2O + 2KNO3
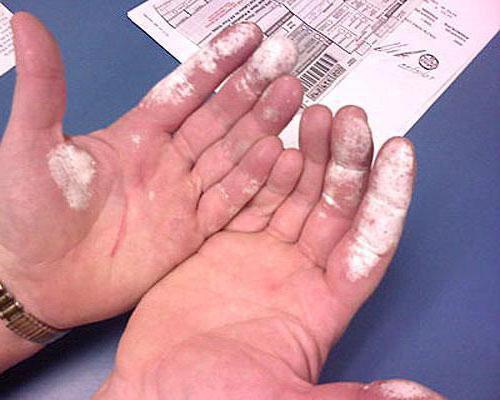
Это агрессивное вещество для живых тканей. При контакте с кожей появляется белый цвет.
Получение — синтез пероксида водорода с использованием метода антрахинона.
В настоящее время hydrogen получают в промышленности методом антрахинона. путем окисления 2-этил-9,10-антрацендиола кислородным газом, прошедшим через раствор этого соединения в смеси подходящих растворителей. Перекись отделяют экстракцией воды и оставляют в растворе.
Этиллантрахинон регенерируют восстановлением газообразным водородом до 2-этил-9,10-антрацендиола, катализируемого палладием на подходящем носителе или соединениях никеля. В методах промышленного производства цикл обеих реакций (окисление и восстановление) осуществляется поочередно.
Разведенный водный раствор перекиси, полученный в этом процессе, концентрируют осторожным выпариванием воды при пониженном давлении, получая таким образом раствор с максимальной концентрацией 70%. Большая концентрация приводит к взрыву. Более концентрированные растворы и полностью чистый пероксид, может быть получен путем быстрого замораживания его из водного концентрированного раствора.
Интересные химические опыты с перекисью водорода — видео:
Водные растворы перекиси водорода и их применение
Перекись водорода в чистом виде не является коммерчески доступным веществом, поскольку законы большинства европейских стран и США запрещают его продажу по соображениям безопасности. В торговле (максимум 70% растворов) это соединение доступно после соблюдения особых условий (правила RID и ADR), а наиболее распространенной коммерческой формой является пергидроль 30% водный раствор и 3-5% растворы для домашнего использования, называемые перекисью водорода.

Перекись в растворе 3-3,5% используется для дезинфекции ран, и такие растворы для непосредственного использования доступны в аптеках. H2O2 оказывает особенно сильное разрушающее действие на анаэробные бактерии (анаэробы).
Дезинфекция раны с использованием перекиси водорода значительно снижает риск попадания бактерий в организм через поврежденный эпидермис. Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению.
7-15% растворы обычно используются в качестве так называемых «Активных кислородных отбеливателей» в бытовой химии, 5% водный раствор используется для обесцвечивания волос. Очень разбавленные растворы (прибл. 1%) применяются в народной медицине для перорального применения. До сих пор считаются спорным способом лечения некоторых видов рака.
Общеизвестна формула основы жизни – воды. Её молекула состоит из двух атомов водорода и одного кислорода, что записывается как H2O. Если же кислорода будет в два раза больше, то получится совсем другое вещество – H2O2. Что это и чем полученное вещество будет отличаться от своей «родственницы» воды?

H2O2 – что это за вещество?
Остановимся на нем подробнее. H2O2 – формула перекиси водорода, Да, той самой, которой обрабатывают царапины, белой. Пероксид водорода H2O2 — название вещества научное.
Для дезинфекции используют трехпроцентный раствор перекиси. В чистом или концентрированном виде она вызывает химические ожоги кожи. Тридцатипроцентный раствор перекиси иначе называют пергидроль; раньше его применяли в парикмахерских для обесцвечивания волос. Обожженная им кожа также становится белой.
Химические свойства Н2О2
Перекись водорода представляет собой жидкость без цвета и с «металлическим» привкусом. Является хорошим растворителем и сама легко растворяется в воде, эфире, спиртах.
Трёх- и шестипроцентные растворы перекиси обычно готовят, разбавляя тридцатипроцентный раствор. При хранении концентрированного Н2О2 происходит разложение вещества с выделением кислорода, поэтому в плотно закупоренных емкостях его хранить не следует во избежание взрыва. С уменьшением концентрации пероксида, повышается его устойчивость. Также для замедления разложения Н2О2 можно добавлять в него различные вещества, например, фосфорную или салициловую кислоту. Для хранения растворов сильной концентрации (более 90 процентов) в перекись добавляют пирофосфат натрия, который стабилизирует состояние вещества, а также используют сосуды из алюминия.
Н2О2 в химических реакциях может быть как окислителем, так и восстановителем. Однако чаще пероксид проявляет окислительные свойства. Перекись принято считать кислотой, но очень слабой; соли перекиси водорода называют пероксидами.
Реакция разложения как метод получения кислорода
Реакция разложения Н2О2 происходит при воздействии на вещество высокой температуры (более 150 градусов Цельсия). В результате образуются вода и кислород.
Формула реакции – 2 Н2О2 + t -> 2 Н2О + О2
Можно посчитать электронный баланс H2O2 в уравнении:
Степень окисления Н в Н2О2 и Н2О = +1.
Степень окисления О: в Н2О2 = -1, в Н2О = -2, в О2 = 0
2 О-1 — 2е -> О20
О-1 + е -> О-2
2 Н2О2 = 2 Н2О + О2
Разложение перекиси водорода может произойти и при комнатной температуре, если использовать катализатор (химическое вещество, ускоряющее реакцию).
В лабораториях одним из методов получения кислорода, наряду с разложением бертолетовой соли или марганцовки, является реакция разложения перекиси. В таком случае в качестве катализатора используют оксид марганца (IV). Другие вещества, ускоряющие разложение H2O2, – медь, платина, гидроксид натрия.
История открытия перекиси
Первые шаги к открытию перекиси были сделаны в 1790 году немцем Александром Гумбольдтом, когда он обнаружил превращения оксида бария в пероксид при нагревании. Тот процесс сопровождался поглощением кислорода из воздуха. Через двенадцать лет учеными Тенаром и Гей-Люссаком был проведен опыт по сжиганию щелочных металлов с избытком кислорода, в результате чего был получен пероксид натрия. Но пероксид водорода был получен позже, лишь в 1818 году, когда Луи Тенар изучал воздействие кислот на металлы; для их устойчивого взаимодействия было необходимо низкое количество кислорода. Проводя подтверждающий опыт с перекисью бария и серной кислотой, ученый добавил к ним воду, хлористый водород и лёд. Через непродолжительное время, Тенар обнаружил на стенках емкости с пероксидом бария небольшие застывшие капли. Стало ясно, что это H2O2. Тогда дали полученному H2O2 название «окисленная вода». Это и была перекись водорода — бесцветная, ничем не пахнущая, трудноиспаримая жидкость, хорошо растворяющая другие вещества. Результат взаимодействия H2O2 и H2O2 — реакция диссоциации, перекись растворима в воде.

Интересный факт – быстро обнаружились свойства нового вещества, позволяющие использовать его в реставрационных работах. Сам Тенар при помощи пероксида отреставрировал картину Рафаэля, потемневшую от времени.
Перекись водорода в XX веке
После тщательного изучения полученного вещества его стали производить в промышленных масштабах. В начале двадцатого века ввели электрохимическую технологию производства перекиси, основанную на процессе электролиза. Но срок годности полученного таким методом вещества был невелик, около пары недель. Чистая перекись нестабильна, и по большей части её выпускали в тридцатипроцентной концентрации для отбеливания ткани и в трёх- или шестипроцентной – для бытовых нужд.
Учёные фашистской Германии использовали пероксид для создания ракетного двигателя на жидком топливе, который использовался для оборонных нужд во Второй Мировой войне. В результате взаимодействия Н2О2 и метанола/гидразина, получалось мощное топливо, на котором самолет достигал скорости более 950 км/ч.
Где применяется Н2О2 сейчас?
- в медицине — для обработки ран;
- в целлюлозно-бумажной промышленности используются отбеливающие свойства вещества;
- в текстильной промышленности перекисью отбеливают натуральные и синтетические ткани, меха, шерсть;
- как ракетное топливо или его окислитель;
- в химии — для получения кислорода, как пенообразователь для производства пористых материалов, как катализатор или гидрирующий агент;
- для производства дезинфицирующих или чистящих средств, отбеливателей;
- для обесцвечивания волос (это устаревший метод, так как волосы сильно повреждаются пероксидом);

- некоторые используют перекись для отбеливания зубов, но при этом разрушается их эмаль;
- в аквариумистике и рыбных хозяйствах используют трёхпроцентный раствор Н2О2 для оживления задохнувшихся рыб, для уничтожения водорослей и паразитов в аквариуме, а также для борьбы с некоторыми заболеваниями рыбы;
- во всех отраслях пероксид может применяться как средство дезинфекции поверхностей, оборудования, упаковки;
- для чистки бассейнов;
- для добычи металлов и нефти в горно- и нефтедобывающей промышленности;
- для обработки металлов и сплавов в металлообработке.
Применение Н2О2 в быту
Перекись водорода можно успешно применять для решения разных бытовых задач. Но использовать в этих целях можно лишь трёхпроцентную перекись водорода. Вот некоторые способы:
- Для очистки поверхностей нужно залить перекись в сосуд пульверизатором и разбрызгивать на загрязненные места.
- Для дезинфекции предметов их нужно протереть неразбавленным раствором Н2О2. Это поможет очистить их от вредных микроорганизмов. Губки для мытья можно замочить в воде с перекисью (пропорция 1:1).
- Для отбеливания тканей при стирке белых вещей добавляют стакан пероксида. Можно также выполоскать белые ткани в воде, смешанной со стаканом Н2О2. Этот способ возвращает белизну, предохраняет ткани от пожелтения и помогает удалить трудновыводимые пятна.
- Для борьбы с плесенью и грибком следует смешать в емкости с пульверизатором перекись и воду в пропорции 1:2. Полученную смесь распылять на зараженные поверхности и через 10 минут очищать их при помощи щётки или губки.
- Обновить потемневшую затирку в кафельной плитке можно, распылив пероксид на нужные участки. Через 30 минут нужно тщательно потереть их жесткой щёткой.
- Для мытья посуды полстакана Н2О2 добавить в полный таз с водой (или раковину с закрытым сливом). Промытые в таком растворе чашки и тарелки будут сиять чистотой.
- Чтобы очистить зубную щётку, нужно опустить её в неразведенный трёхпроцентный раствор перекиси. Затем промыть под сильной струей воды. Этот способ хорошо дезинфицирует предмет гигиены.
- Чтобы продезинфицировать купленные овощи и фрукты, следует распылить на них раствор 1 части перекиси и 1 части воды, после чего тщательно промыть их водой (можно холодной).
- На дачном участке при помощи Н2О2 можно бороться с болезнями растений. Нужно опрыскивать их раствором перекиси или замочить семена незадолго до посадки в 4,5 литрах воды, смешанной с 30 мл сорокапроцентной перекиси водорода.
- Для оживления аквариумных рыбок, если они отравились аммиаком, задохнулись при отключении аэрации или по другой причине, можно попробовать поместить их в воду с перекисью водорода. Нужно смешать трёхпроцентную перекись с водой из расчёта 30 мл на 100 литров и поместить в полученную смесь бездыханных рыб на 15-20 минут. Если они не оживут за это время, значит, средство не помогло.

Перекись водорода в природе
Не стоит считать пероксид водорода искусственным соединением, получаемым только в лабораториях. В Н2О2 содержится в дожде и снеге, в горном воздухе. В горах можно встретить источники и реки с белой от мельчайших кислородных пузырьков водой, которая справедливо считается полезной. Мало кто знает, что цвет и пузырьки обусловлены наличием в воде Н2О2, образующейся из-за хорошей её аэрации. Между тем, не стоит бояться пить такую воду некипяченой, если, разумеется, поблизости нет заводов и фабрик. Перекись водорода, естественным путем образующаяся в воде, служит обеззараживающим средством против микроорганизмов и паразитов.
Даже в результате активного встряхивания бутылки с водой в ней образуется некоторое количество пероксида, так как вода при этом действии насыщается кислородом.
В свежих фруктах и овощах Н2О2 также содержится, пока они не подвергнутся термической обработке. При нагреве, варке, обжарке и других процессах с сопутствующей высокой температурой уничтожается большое количество кислорода. Именно поэтому прошедшие кулинарную обработку продукты считаются не такими полезными, хотя какое-то количество витаминов в них остается. Свежевыжатые соки или кислородные коктейли, подаваемые в санаториях, полезны по той же причине – из-за насыщения кислородом, который дает организму новые силы и очищает его.
Опасность перекиси при употреблении внутрь
После вышесказанного может показаться, что перекись можно специально принимать внутрь, и от этого будет польза организму. Но это совсем не так. В воде или соках соединение содержится в минимальных количествах и тесно связано с другими веществами. Прием же «ненатуральной» перекиси водорода внутрь (а вся перекись, купленная в магазине или произведенная в результате химических опытов самостоятельно, никак не может считаться натуральной, к тому же обладает слишком высокой концентрацией по сравнению с природной) может привести к опасным для жизни и здоровья последствиям. Чтобы понять — почему, нужно вновь обратиться к химии.
Как уже упомянуто, при некоторых условиях пероксид водорода разрушается и выделяет кислород, являющийся активным окислителем. Например, реакция разложения может произойти при столкновении Н2О2 с пероксидазой – внутриклеточным ферментом. В основе использования перекиси для дезинфекции положены именно её окислительные свойства. Так, когда рану обрабатывают Н2О2 – выделяющийся кислород уничтожает живые патогенные микроорганизмы, попавшие в нее. Такое же действие она оказывает и на другие живые клетки. Если обработать неповрежденную кожу пероксидом, а потом протереть место обработки спиртом, почувствуется жжение, что подтверждает наличие микроскопических повреждений после перекиси. Но при внешнем применении перекиси низкой концентрации какого-то заметного вреда организму не будет.

Другое дело, если её пытаться принимать внутрь. То вещество, которое способно повреждать даже сравнительно толстую кожу снаружи, попадает на слизистые оболочки пищеварительного тракта. То есть происходят химические мини-ожоги. Разумеется, выделяющийся окислитель – кислород – может заодно убить и вредные микробы. Но этот же процесс произойдет и с клетками пищевого тракта. Если ожоги в результате действия окислителя будут повторяться, то возможна атрофия слизистых оболочек, а это – первый шаг на пути к раку. Гибель клеток кишечника приводит к невозможности организма усваивать питательные вещества, этим объясняется, например, снижение веса и исчезновение запоров у некоторых людей, практикующих «лечение» перекисью.
Отдельно нужно сказать о таком методе употребления перекиси, как внутривенные инъекции. Даже если по какой-то причине их назначил врач (оправдано это может быть лишь при заражении крови, когда других подходящих лекарств в наличии нет), то под медицинским наблюдением и со строгим расчетом дозировок риски все-таки есть. Но в такой экстремальной ситуации это будет шансом на выздоровление. Самому же назначать себе уколы перекиси водорода ни в коем случае нельзя. Н2О2 представляет большую опасность для клеток крови – эритроцитов и тромбоцитов, так как при попадании в кровеносное русло разрушает их. К тому же, может произойти смертельно опасная закупорка сосудов высвободившимся кислородом – газовая эмболия.
Меры безопасности в обращении с Н2О2
- Хранить в недоступном для детей и недееспособных лиц месте. Отсутствие запаха и выраженного вкуса делает перекись особенно опасной для них, так как могут быть приняты большие дозы. При попадании внутрь раствора, последствия употребления могут быть непредсказуемыми. Необходимо незамедлительно обратиться к врачу.
- Растворы перекиси концентрацией более трёх процентов вызывают ожоги при попадании на кожу. Место ожога нужно промыть большим количеством воды.

- Не допускать попадания раствора пероксида в глаза, так как образуется их отек, покраснение, раздражение, иногда болевые ощущения. Первая помощь до обращения к врачу – обильное промывание глаз водой.
- Хранить вещество так, чтобы было понятно, что это — H2O2, то есть в емкости с наклейкой во избежание случайного применения не по назначению.
- Условия хранения, продлевающие его срок, – темное, сухое, прохладное место.
- Нельзя смешивать пероксид водорода с любыми жидкостями, кроме чистой воды, в том числе и с хлорированной водой из-под крана.
- Все вышесказанное применимо не только к Н2О2, но и ко всем содержащим его препаратам.
