Где применяется углекислый газ на каких свойствах основано его применение


Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
 Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
 Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Похожие статьи
- Сфера применения и особенности водородных баллонов
- Особенности газового пожаротушения
- Как доставить баллон с газом к месту проведения работ?
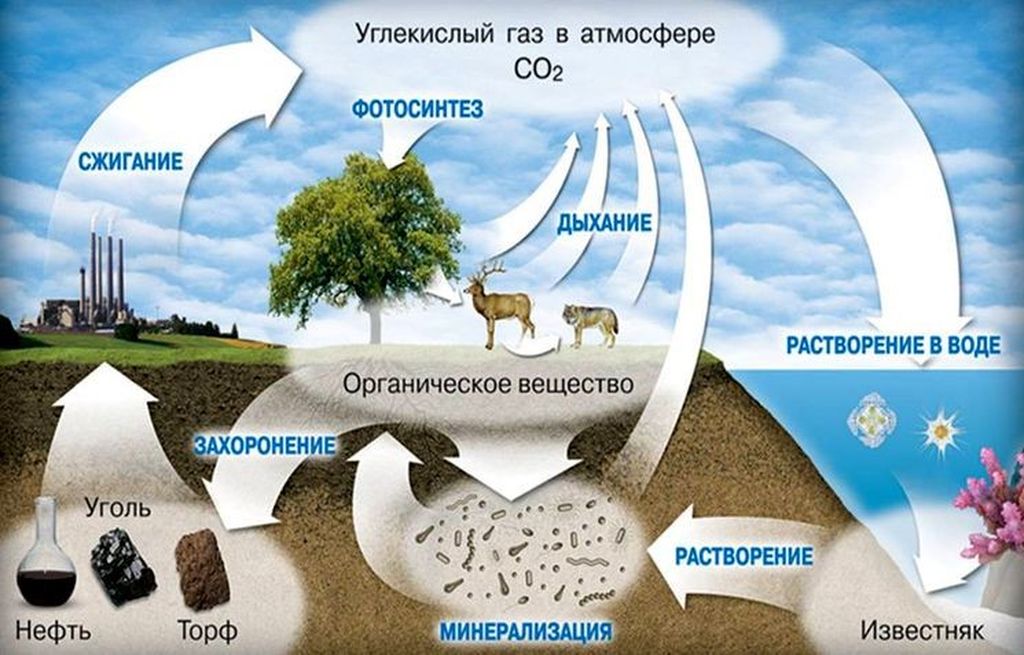
Углекислый газ, имея универсальные свойства, используется в промышленности, медицине, сельском хозяйстве. Сегодня CO2 – это удобрение в сельском хозяйстве, медицинский инструмент, регулятор температуры и источник новой энергии.
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.

Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).

Установка добычи углекислоты
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.

Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.

Сухой лед
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Применение в промышленности
Применение углекислого газа в различных областях промышленности связано с химическими и физическими свойствами вещества. Он не горит, не опасен в минимальных концентрациях для человека и животных и является основным компонентом для жизнедеятельности растений.

Химическая промышленность:
- Участвует в синтезе искусственных химикатов;
- Регулирует температуру в реакциях;
- Нейтрализует щелочи;
- Очищает ткани животных и растений;
- Может восстанавливаться до метана.
Металлургия:
- Осаждение отходящего дыма;
- Регулирует направления течения воды при отводе шахт;
- Некоторые лазеры используют CO2 в качестве источника энергии (неон).
Производство бумаги:
- Регулирует водородный показатель в древесной массе или целлюлозе;
- Усиливает в мощности производственные машины.
Особую роль в промышленной и смежных индустриях играет сухой лед. Он применяется как:
- Источник охлаждения в морозильных камерах при перевозках;
- Охлаждение при затвердевании сплавов;
- Очистка сухим льдом оборудования (криобластинг).
Применение в других сферах деятельности
Человек также использует углекислоту в других областях деятельности и в быту. Доступность диоксида обуславливает его широкую распространенность, а свойства – востребованность даже среди обывателей.

Схема применения углекислоты
Где еще применяется углекислота:
- При сварке. Защищает металл от нагрева и окисления, обтекая электрическую дугу.
- В сельском хозяйстве. Углекислый газ в купе с солнечным светом – идеальный способ удобрить любые культуры. Распыление газа в парнике или теплице увеличивает урожайность в 2-3 раза;
- В медицине служит для создания атмосферы, близкой к реальной, при проведении искусственных операций на органах. Он применяется как стимулятор для восстановления дыхания пациента и при введении его в наркоз;
- Фармацевтика. Создает идеальную среду для синтеза химии и низкотемпературной транспортировки вод;
- Приборы и оборудование. Охлаждает оборудование и агрегаты без разбора на модули, выступает как абразивный элемент прочистки;
- Защита окружающей среды. Регулирует показатель водорода в стоках;
- Пищевая промышленность. Используется как консервант и разрыхлитель теста. Добавляется в напитки, делая их газированными;
- Для создания давления в пневматическом оружии.
Применение углекислого газа особенно востребовано в системах пожаротушения. Он заполняется в углекислотные газовые огнетушители и при возгорании позволяет изолировать очаг пожара от источника кислорода. Горение не может долго продолжаться без подпитки воздухом, а газификация углекислотой не даст ему проникнуть к огню.

Получаемый в малом количестве от спиртового брожения используется как способ газировки напитков. Он также уберегает муку, сухофрукты, арахис от насекомых, не влияя на качество и скорость их порчи.
Углекислый газ – первоклассная среда для разведения цветов, подкормки овощей и подводных растений. Он ускоряет фотосинтез и улучшает обменные процессы в растительных клетках. Главное – имеет доступную цену даже для обывателей.

Диоксид углерода может применяться и в криодеструкции, в качестве заморозки. Он сжигает холодом поверхность бородавок и родинок, заставляя их отваливаться, но не оставлять шрамов от скальпеля и швов.
Заключение
Углекислый газ – простое и распространенное по всей планете вещество, играющее практическую функцию в ключевых отраслях деятельности. Без него не обходится промышленность, медицина, пищевая отрасль и даже простой человеческий быт.

С недавних пор CO2 применяется как основа для производства источника топлива (метанола). Популярность набирает способ использования в качестве возобновляемого геотермального источника энергии, способного увеличить производство электроэнергии и сократить выбросы газа в атмосферу.
Газы |
Углекислый газ формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые в свою очередь производят кислород. Углекислый газ бесцветен и тяжелее воздуха. Он не пригоден для поддержания жизни. Углекислый газ замерзает при температуре −78,5 °C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Основное применение
Химическая отрасльУглекислый газ используется при производстве синтетических химических веществ и регулировании реакторных температур. CO2 также служит для нейтрализации щелочных сточных вод. В закритических условиях диоксид углерода используется в процессах очистки или осушки полимеров, волокон животного или растительного происхождения. ФармацевтикаУглекислый газ используется для создания инертной среды, синтеза химических веществ, сверхкритической флюидной экстракции (SFE), подкисления (pH) сточных вод или продукта при их низкотемпературной транспортировке (−78 °C или −108 °F). Пищевая отрасльВ пищевой отрасли выделяются следующие основные направления применения CO2
МедицинаПри проведении операций на искусственных органах углекислый газ служит для создания атмосферных условий, близких к физиологическим. В качестве одного из компонентов кислородной или воздушной смеси углекислый газ служит стимулятором глубокого дыхания. Другим его применением является хирургическая дилатация при интраабдоминальных инсуффляциях. Металлургическая отрасльНаиболее популярным применением углекислого газа в металлургии является защита окружающей среды
Лабораторные исследования и анализДиоксид углерода в сверхкритическом состоянии представляет собой подвижную фазу, используемую как в процессе хроматографического анализа, так и в процессах экстрагирования. Целлюлозно-бумажная отрасльПосле щелочной отбелки древесной массы или целлюлозы диоксид углерода позволяет с высокой точностью регулировать уровень pH в переработанном сырье. CO2 может использоваться в процессах нейтрализации талового масла и в целях повышения производительности бумагоделательных машин. ЭлектроникаДиоксид углерода стандартно применяется для обработки сточных вод, а в качестве охладителя он используется при испытании электронных приборов на воздействие окружающей среды. Помимо этого диоксид углерода позволяет повышать проводимость сверхчистой воды, а в виде снега используется для абразивной очистки деталей или удаления осадков на кристаллических пластинах. Дополнительно диоксид углерода может использоваться в качестве экологически чистой сверхкритической жидкости для удаления фототвердеющих материалов из кристаллических пластин без применения органических растворителей. Охрана окружающей средыДобавление диоксида углерода позволяет поддерживать необходимый уровень pH в жидких стоках. В качестве регулятора рН он является прекрасной альтернативой серной кислоте. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||