Гафний какие свойства проявляет
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 сентября 2019;
проверки требуют 9 правок.
Запрос «Hf» перенаправляется сюда; см. также другие значения.
| Гафний | ||||
|---|---|---|---|---|
| ← Лютеций | Тантал → | ||||
| ||||
| Серебристый ковкий металл | ||||
| Название, символ, номер | Га́фний / Hafnium (Hf), 72 | |||
| Атомная масса (молярная масса) | 178,49(2)[1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Xe]4f14 5d2 6s2 | |||
| Радиус атома | 167 пм | |||
| Ковалентный радиус | 144 пм | |||
| Радиус иона | (+4e) 78 пм | |||
| Электроотрицательность | 1,3 (шкала Полинга) | |||
| Электродный потенциал | ||||
| Степени окисления | 0, 2, 3, 4 | |||
| Энергия ионизации (первый электрон) | 575,2 (5,96) кДж/моль (эВ) | |||
| Плотность (при н. у.) | 13,31[2] г/см³ | |||
| Температура плавления | 2506 K (2233 °C, 4051 °F)[2] | |||
| Температура кипения | 4876 K (4603 °C, 8317 °F)[2] | |||
| Уд. теплота плавления | 25,1 кДж/моль | |||
| Уд. теплота испарения | 575 кДж/моль | |||
| Молярная теплоёмкость | 25,7[3] Дж/(K·моль) | |||
| Молярный объём | 13,6 см³/моль | |||
| Структура решётки | гексагональная | |||
| Параметры решётки | a=3,196 нм; c=5,051 нм[4] | |||
| Отношение c/a | 1,580 | |||
| Теплопроводность | (300 K) 23,0 Вт/(м·К) | |||
| Номер CAS | 7440-58-6 | |||
Га́фний — химический элемент 4-й группы длиннопериодной формы периодической системы Д. И. Менделеева (по короткой форме периодической системы — побочной подгруппы IV группы), шестого периода, с атомным номером 72. Обозначается символом Hf (лат. Hafnium). Простое вещество — тяжёлый тугоплавкий серебристо-белый металл.
Гафний имеет две модификации. При комнатной температуре гафний обладает гексагональной плотноупакованной кристаллической решёткой. При температуре, равной 2016 К, гафний претерпевает аллотропическое превращение — гексагональная решётка переходит в объёмноцентрированную кубическую решётку.
История открытия и происхождение названия[править | править код]
Элемент был открыт в 1923 году.
Гафний искали среди редкоземельных элементов, так как не было выяснено строение 6-го периода системы Д. И. Менделеева. В 1911 году французский химик Ж. Урбен объявил об открытии нового элемента, названного им кельтием. В действительности он получил смесь, состоящую из иттербия, лютеция и небольшого количества гафния. И только после того, как Н. Бор на основании квантовомеханических расчётов показал, что последним редкоземельным элементом является элемент с номером 71, стало ясно, что гафний — аналог циркония.
Базируясь на выводах Бора, который предсказал его свойства и валентность, в 1923 году Дирк Костер и Дьёрдь де Хевеши систематически проанализировали рентгеноспектральным методом норвежские и гренландские цирконы. Совпадение линий рентгенограмм остатков после выщелачивания циркона кипящими растворами кислот с вычисленными по закону Мозли для 72-го элемента позволило исследователям объявить об открытии элемента, который они назвали гафнием в честь города, где было сделано открытие (лат. Hafnia — латинское название Копенгагена). Начавшийся после этого спор о приоритете между Ж. Урбеном, Н. Костером и Д. Хевеши продолжался длительное время. В 1949 году название элемента «гафний» было утверждено Международной комиссией и принято всюду.
Получение[править | править код]
Среднее содержание гафния в земной коре — около 4 г/т. Ввиду отсутствия у гафния собственных минералов и постоянного сопутствия его цирконию, его получают путём переработки циркониевых руд, где он содержится в количестве 2,5 % от веса циркония (циркон содержит 4 % HfO2, бадделеит — 4—6 % HfO2). В мире в год в среднем добывается около 70 тонн гафния, и объёмы его добычи пропорциональны объёмам добычи циркония. Интересна особенность скандиевого минерала — тортвейтита: в нём содержится гафния в процентном отношении гораздо больше, чем циркония, и это обстоятельство очень важно при переработке тортвейтита на скандий и концентрировании гафния из него.
Мировые ресурсы гафния[править | править код]
Цены на гафний 99 % в 2007 году в среднем составляли $780 за килограмм (по материалам infogeo.ru)
Мировые ресурсы гафния в пересчёте на двуокись гафния несколько превышают 1 миллион тонн. Структура распределения этих ресурсов выглядит приблизительно следующим образом:
- Австралия — более 630 тысяч тонн,
- ЮАР — почти 287 тысяч тонн,
- США — чуть более 105 тысяч тонн,
- Индия — около 70 тысяч тонн,
- Бразилия — 9,88 тысяч тонн.
Подавляющая часть сырьевой базы гафния в зарубежных странах представлена цирконом прибрежных морских россыпей.
Запасы гафния в России и СНГ, по оценкам независимых специалистов[Каких?], весьма велики[Насколько?] и в этом отношении при развитии гафниевой промышленности Россия способна стать безусловным лидером на мировом рынке гафния. Стоит также в связи с этим упомянуть весьма значительные ресурсы гафния на Украине. Основные гафнийсодержащие минералы в России и СНГ представлены лопаритом, цирконом, бадделеитом, редкометалльными щелочными гранитами.
Физические свойства[править | править код]
Аномальный пик на экспериментальной кривой теплоёмкости гафния (1) и её разложение на дебаевскую составляющую (2) и аномальный остаток (3) — разность (1)-(2), слагающийся из больцмановских (4, 5) компонент
Гафний — блестящий серебристо-белый металл, твёрдый и тугоплавкий. В мелкодисперсном состоянии имеет тёмно-серый, почти чёрный цвет; матовый[3]. Плотность при нормальных условиях — 13,31 г/см3[2]. Температура плавления составляет 2506 K (2233 °C), кипит при 4876 K (4603 °C)[2].
Гафний обладает высоким сечением захвата тепловых нейтронов — (115 барн у естественной смеси изотопов[5]), тогда как у его химического аналога, циркония, сечение захвата на 3 порядка меньше, около 0,2 барн. В связи с этим цирконий, используемый для создания реакторных ТВЭЛов, должен быть тщательно очищен от гафния.
Температурная зависимость теплоёмкости гафния (аналогично теплоёмкости германия — Ge) имеет аномальный вид — на кривой теплоёмкости в диапазоне температур 60—80 К наблюдается пик[6], который не может быть объяснён никакой теорией, предполагающей гуковский закон сил, так как никакая суперпозиция эйнштейновских функций не даёт кривой с максимумом[7]. В данном случае аномальный вид кривой теплоёмкости определяется суперпозицией колебательной (дебаевской) и диффузионной (больцмановской) компонент поглощения тепла кристаллической решеткой[8].
Изотопы гафния[править | править код]
Известно более 30 изотопов гафния с массовыми числами от 153 до 188 (количество протонов 72, нейтронов от 81 до 116), и 26 ядерных изомеров. 5 изотопов стабильны и встречаются в природе (176Hf, 177Hf, 178Hf, 179Hf, 180Hf). Благодаря огромному периоду полураспада (период полураспада 2×1015 лет) в природе встречается один нестабильный изотоп, 174Hf.
Известен изомер гафния 178m2Hf. Он привлек внимание общественности в связи с исследованиями агентства оборонных исследований DARPA по принудительному распаду изомера с выделением значительных энергий.[9][10] Начали высказываться гипотезы о возможности построения гафниевой бомбы (англ.)русск.. Тем не менее в научной среде ставится под сомнение как возможность управляемого взрывного распада 178m2Hf так и возможность получения изомера в количествах, необходимых для создания оружия.
Химические свойства[править | править код]
Гафний, как и тантал, — достаточно инертный материал из-за образования тонкой пассивной плёнки оксидов на поверхности. В целом химическая стойкость гафния гораздо больше, чем у его аналога — циркония.
Лучшим растворителем гафния является фтороводородная кислота (HF) или смесь фтороводородной и азотной кислот, а также царская водка.
При высоких температурах (свыше 1000 К) гафний окисляется на воздухе, а в кислороде сгорает. Реагирует с галогенами. По стойкости к кислотам подобен стеклу. Так же, как и цирконий, обладает гидрофобными свойствами (не смачивается водой).
Важнейшие химические соединения[править | править код]
Соединения двухвалентного гафния[править | править код]
- HfBr2, дибромид гафния — твёрдое вещество чёрного цвета, самовоспламеняющееся на воздухе. Разлагается при температуре 400 °C на гафний и тетрабромид гафния. Получают диспропорционированием трибромида гафния в вакууме при нагревании.
Соединения трёхвалентного гафния[править | править код]
- HfBr3, трибромид гафния — чёрно-синее твёрдое вещество. Диспропорционирует при 400 °C на дибромид и тетрабромид гафния. Получают восстановлением тетрабромида гафния при нагревании в атмосфере водорода или с металлическим алюминием.
Соединения четырёхвалентного гафния[править | править код]
- HfO2, диоксид гафния — бесцветные моноклинные кристаллы (плотность — 9,98 г/см³) или бесцветные тетрагональные кристаллы (плотность — 10,47 г/см³). Последние имеют Tпл 2900 °C, малорастворимы в воде, диамагнитны, обладают более осно́вным характером, чем ZrO2 и обнаруживают каталитические свойства. Получают нагреванием металлического гафния в кислороде или прокаливанием гидроксида, диоксалата, дисульфата гафния.
- Hf(OH)4, гидроксид гафния — белый осадок, растворяющийся при добавлении щёлочей и пероксида водорода с образованием пероксогафниатов. Получают глубоким гидролизом солей четырёхвалентного гафния при нагревании или обработкой растворов солей гафния(IV) щёлочами.
- HfF4, тетрафторид гафния — бесцветные кристаллы. Tпл 1025 °C, плотность — 7,13 г/см³. Растворим в воде. Получают термическим разложением соединения (NH4)2[HfF6] в токе азота при 300 °C.
- HfCl4, тетрахлорид гафния — белый порошок, сублимирующийся при 317 °C. Tпл 432 °C. Получают действием хлора на металлический гафний, карбид гафния или смесь оксида гафния(II) с углём.
- HfBr4, тетрабромид гафния — бесцветные кристаллы. Сублимируются при 322 °C. Tпл 420 °C. Получают действием паров брома на нагретую до 500 °C смесь оксида гафния(II) с углём.
- HfI4, тетраиодид гафния — жёлтые кристаллы. Сублимирует при 427 °C и термически диссоциирует при 1400 °C. Получается взаимодействием гафния с иодом при 300 °C.
- Hf(HPO4)2, гидрофосфат гафния — белый осадок, растворимый в серной и фтороводородной кислотах. Получают обработкой растворов солей гафния(IV) ортофосфорной кислотой.
Применение[править | править код]
Основные области применения металлического гафния — производство сплавов для аэрокосмической техники, атомная промышленность, специальная оптика.
- В атомной технике используется способность гафния к захвату нейтронов, и его применение в атомной промышленности — это производство регулирующих стержней, специальной керамики и стекла (оксид, карбид, борид, оксокарбид, гафнат диспрозия, гафнат лития). Особенностью и преимуществом диборида гафния является очень малое газовыделение (гелий, водород) при «выгорании» бора.
- В оптике применяется оксид гафния в связи с его температурной стойкостью (т. пл. 2780 °C) и очень высоким показателем преломления. Значительную сферу потребления гафния составляет производство специальных марок стекла для волоконно-оптических изделий, а также для получения особо высококачественных оптических изделий, покрытия зеркал, в том числе и для приборов ночного видения, тепловизоров. Схожую область применения имеет и фторид гафния.
- Карбид и борид гафния (т. пл. 3250 °C) находят применение в качестве чрезвычайно износоустойчивых покрытий и производства сверхтвёрдых сплавов. Кроме того, карбид гафния является одним из самых тугоплавких соединений (т. пл. 3960 °C) и используется для производства сопел космических ракет и некоторых конструкционных элементов газофазных ядерных реактивных двигателей.
- Гафний отличает сравнительно низкая работа выхода электрона (3,53 эВ), и поэтому он применяется для изготовления катодов мощных радиоламп и электронных пушек. В то же время это его качество наряду с высокой температурой плавления позволяет использовать гафний для производства электродов для сварки металлов в аргоне и особенно электродов (катодов) для сварки низкоуглеродистой стали в углекислом газе. Стойкость таких электродов в углекислом газе более чем в 3,7 раза выше, чем вольфрамовых. В качестве эффективных катодов с малой работой выхода применяется также гафнат бария.
- Карбид гафния в виде мелкопористого керамического изделия может служить чрезвычайно эффективным коллектором электронов при условии испарения с его поверхности в вакууме паров цезия-133, в этом случае работа выхода электронов снижается менее чем 0,1—0,12 эВ, и этот эффект может быть использован для создания высокоэффективных термоэмиссионных электрогенераторов и частей мощных ионных двигателей.
- На основе диборида гафния и никеля разработано и уже давно используется высокоизносоустойчивое и твёрдое композиционное покрытие.
- Сплавы тантал-вольфрам-гафний являются лучшими сплавами для подачи топлива в газофазных ядерных ракетных двигателях.
- Сплавы титана, легированные гафнием, применяются в судостроении (производство деталей судовых двигателей), а легирование гафнием никеля не только увеличивает его прочность и коррозионную стойкость, но и резко улучшает свариваемость и прочность сварных швов.
- Карбид тантала-гафния. Добавление гафния к танталу резко увеличивает его стойкость к окислению на воздухе (жаростойкость) за счёт образования плотной и непроницаемой плёнки сложных оксидов на поверхности, и, кроме всего, эта плёнка оксидов очень стойка к теплосменам (тепловой удар). Эти свойства позволили создать очень важные сплавы для ракетной техники (сопла, газовые рули). Один из лучших сплавов гафния и тантала для сопел ракет содержит до 20 % гафния. Также следует отметить большой экономический эффект при применении сплава гафний-тантал для производства электродов для воздушно-плазменной и кислородно-пламенной резки металлов. Опыт применения такого сплава (гафний — 77 %, тантал — 20 %, вольфрам — 2 %, серебро — 0,5 %, цезий — 0,1 %, хром — 0,4 %) показал в 9 раз больший ресурс работы по сравнению с чистым гафнием.
- Легирование гафнием резко упрочняет многие сплавы кобальта, очень важных в турбостроении, нефтяной, химической и пищевой промышленности.
- Гафний используется в некоторых сплавах для сверхмощных постоянных магнитов на основе редких земель (в частности, на основе тербия и самария).
- Сплав карбида гафния (HfC, 20 %) и карбида тантала (TaC, 80 %) является самым тугоплавким сплавом (т. пл. 4216 °C). Кроме того, есть отдельные указания на то, что при легировании этого сплава небольшим количеством карбида титана температура плавления может быть увеличена ещё на 180 градусов.
- Добавлением 1 % гафния в алюминий получают сверхпрочные сплавы алюминия с размером зёрен металла 40—50 нм. При этом не только упрочняется сплав, но и достигается значительное относительное удлинение и повышается предел прочности при сдвиге и кручении, а также улучшается вибростойкость.
- Диэлектрики с высокой диэлектрической проницаемостью на основе оксида гафния в течение следующего десятилетия заменят в микроэлектронике традиционный оксид кремния, что позволит достичь гораздо более высокой плотности элементов в чипах[11]. С 2007 года диоксид гафния используется в 45-нм процессорах Intel Penryn[12][13]. Также в качестве диэлектрика с высокой диэлектрической проницаемостью в электронике применяется силицид гафния. Сплавы гафния и скандия применяются в микроэлектронике для получения резистивных плёнок с особыми свойствами.
- Гафний используется для производства высококачественных многослойных рентгеновских зеркал.
Биологическая роль[править | править код]
Гафний не играет никакой биологической роли в организме.
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 Hafnium: physical properties (англ.). WebElements. Дата обращения 17 августа 2013.
- ↑ 1 2 Гафний // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 504. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Hafnium: crystal structure (англ.). WebElements. Дата обращения 17 августа 2013.
- ↑ С. С. Бердоносов. Гафний // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1988. — Т. 1: Ааронова — Бома эффект — Длинные линии. — 707 с. — 100 000 экз.
- ↑ Cristescu S., Simon F. // Z.Phys. Chem. 25 B, 273 (1934)
- ↑ Зейтц Ф. Современная теория твёрдого тела. // М.-Л., Госиздат технической литературы, 1949, 736 с.
- ↑ Аномальные пики на кривых теплоёмкости Ge и Hf. //c. 224—228 в кн. Андреев В. Д. Избранные проблемы теоретической физики. — Киев: Аванпост-Прим, 2012.
- ↑ Ошибка Пентагона (недоступная ссылка). Популярная механика (октябрь 2007). Дата обращения 11 декабря 2008. Архивировано 10 мая 2011 года.
- ↑ Индуцированный распад ядерного изомера 178m2Hf и «изомерная бомба». УФН (май 2005). Архивировано 22 августа 2011 года.
- ↑ SRC говорит о «революции» в полупроводниковой отрасли (недоступная ссылка). iXBT.com (2 февраля 2007). Дата обращения 17 августа 2013. Архивировано 4 марта 2016 года.
- ↑ Исследования в области диэлектриков High-k и металлических затворов (недоступная ссылка). Intel Corporation. Дата обращения 17 августа 2013. Архивировано 26 декабря 2012 года.
- ↑ Инновационное решение, которое устраняет ограничения производительности (недоступная ссылка). Intel Corporation. Дата обращения 17 августа 2013. Архивировано 6 декабря 2012 года.
Литература[править | править код]
- Химия и технология редких и рассеянных элементов. Ч. 2. Под ред К. Большакова. Изд. 2. М.: Высшая школа, 1976.
Ссылки[править | править код]
- Гафний в Популярной библиотеке химических элементов
- Кельтий // Большая советская энциклопедия : в 66 т. (65 т. и 1 доп.) / гл. ред. О. Ю. Шмидт. — М. : Советская энциклопедия, 1926—1947.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Ознакомление с данной статьей позволит читателю узнать, что представляет собой гафний (химический элемент), применение которого широко используется человеком во множестве областей его деятельности. А также будут рассмотрены свойства химической и физической природы вещества, способы добычи и нахождение на планете, будет рассмотрена краткая история открытия этого элемента.
Что такое гафний
Гафний – химический элемент таблицы Менделеева. Находится в четвертой группе, шестом периоде, атомный номер равен семидесяти двум. Относится к простому типу веществ, имеет высокую плотность и тугоплавкость, цвет метала серебристо-белый. Гафний может существовать в двух модификациях. Под воздействием температуры около 2016 Кельвинов решетка гексагонального типа, претерпев аллотропические изменения, переходит в состояние объемноцентрированной решетки кубической формы, при комнатных температурах имеет кристаллическую решетку гексагональной сингонии.

Из истории открытия элемента
Открытие элемента произошло в 1923, совершили его Дьердь де Хешеви и Костер Дирк. Они смогли предсказать валентность и различные качественные характеристики гафния, основываясь на умозаключениях Н. Бора, который, в свою очередь, анализировал работу француза Ж. Урбена, считавшего, что он открыл кельтий – новый элемент. Однако позднее оказалось, что кельтием была смесь малого количества гафния с лютецием и иттербием.
Нильс Бор, изучая эту работу и используя в своей деятельности квантовомеханические расчеты, доказал, что гафний является аналогом элемента под номером 71 в ПТХЭ, а именно циркония. Дьердь де Хешеви и Костер Дирк заявили о нахождении нового элемента гафния, названного в честь города, в котором было совершено открытие, после того как, используя рентгеноспектральный метод, многократно проанализировали цирконы Норвегии и Гренландии. Обнаружение сходства линий рентгенограммы позволило ученым объявить об обнаружении нового х-ского элемента.
Способы получения и мировые запасы
Гафний находится в коре земли, но не имеет собственного минерала, а потому он является «спутником» циркония. Количество Hf в рудах около 2.5%, и годовая добыча составляет около семидесяти тонн. Гафний — довольно дорогое вещество, его основные места нахождения сосредоточены в Австралии, ЮАР, США, Индии и Бразилии. Расположение стран в поочередности перечисления соответствует местам по количеству наличия Hf в стране. Стоит также упомянуть, что Россия и Украина имеют довольно большие запасы этого металла, основное количество которого сосредоточено в циркономе, лопарите и бадделеите.

Физическая характеристика
Часть физических свойств гафния была упомянута выше. К ним можно добавить, что этот металл, который, принимая мелкодисперсное состояние, становится практически черным. Плавится при 2233 градусов по Цельсию, кипение начинается при 4603 оС. Сечение для захвата нейтронов теплового типа очень высокое. Цирконий, в отличие от гафния, имеет уровень сечения на три порядка слабее. В то время как захват Hf равен 115 барам, у циркония он всего около 0.2 бар. Гафний имеет аналогичный уровень теплоемкости германия (Ge) и является аномальным. Пик теплоемкости находится на уровне 60-80 Кельвинов. Это невозможно объяснить ни одной теорией, связанной с гуковскими силами, что обусловлено неспособностью функции эйнштейновской суперпозиции предоставить кривую с максимумом.
Химические свойства
Гафний имеет х-скую стойкость гораздо сильнее, чем у аналогичного циркония. Сам металл имеет довольно большую инертность, что связано с пленкой оксидов пассивного типа, которая образуется на гафние. Лучше всего Hf растворяется в фтороводородной кислоте, смеси фтороводородной кислоты с азотной кислотой и в царской водке. При высоких температурах сгорает в кислороде, а на открытом воздухе начинает окисляться. Может вступать в х-ские реакции с галогенами. Обладает свойствами гидрофобного характера.
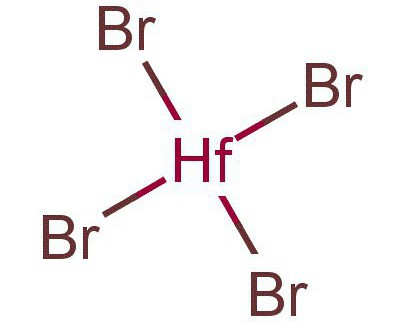
Соединения двух- трех- и четырехвалентного Hf
У данного элемента значение валентности является переменным и, в соответствии с различными величинами количества возможных х-ских связей, существуют несколько важнейших соединений гафния с другими веществами.
Двухвалентный дибромид гафния имеет темно-зеленый цвет. При температуре 400 градусов по Цельсию начинает процесс разложения с образованием Hf и HfBr4. В промышленности добывают диспропорционированием в вакууме HfBr3 под термическим воздействием.
Трехвалентный Hf представлен трибромидом (HfBr3) – это вещество черно-синего цвета, довольно твердое. Под воздействием температуры, равной 400 градусам по Цельсию, начинает диспропорционировать на два компонента тетрабромбиты гафния и дибромбиды. Способ получения заключается в восстановлении HfBr4 путем нагревания в водороде, возможно с добавлением алюминия.
К соединениям четырехвалентного гафния относится довольно большое количество соединений, а именно HfO2 – его диоксид, а также гидроксид с х-ской формулой Hf(OH)4. Тут же находятся третрахлорид (HfCl4), тетрафторид (HfF4), тетраиодид (HfI4) и вышеупомянутый тетрабомид гафния (HfBr), еще есть гидрофосфаты гафния (Hf(HPO4)2).

Применение в быту и связь с медициной
Гафний применение свое находит во множестве сфер деятельности людского рода. Это связано с множеством качественных характеристик, свойств, которые делают его незаменимым материалом, веществом во множестве отраслей промысла человека, военном деле и даже в ядерной промышленности.
Так как же используется гафний? Применение в медицине – это один из множества вариантов, где можно задействовать свойства этого металла. Так как карбиды Hf сверхпрочные, практически не подвергающиеся коррозии, они могут использоваться для изготовления режущих предметов, используемых врачами, также их используют при изготовлении рентгеновского зеркала.

Элемент с исключительными свойствами как химической, так и физической природы – это гафний. Применение в быту он находит в качестве материала при изготовлении радиотехники, радиоламп и телевизионных трубок. Его широко используют в металлургической промышленности с целью придания другим металлам более качественных физико-технических и механических свойств. Гафний применение также находит в х-ском машиностроении, но используется редко в силу своего дефицита и более важных способов применения.
Использование гафния в военном ремесле
Каким образом еще можно использовать гафний? Применение в вооружении – это очередная сфера деятельности человека, в которой не обходится без этого элемента. Окиси, силициды, бориды и карбиды гафния являются чрезвычайно тугоплавкими соединениями, по этой причине в военном ремесле их можно использовать в качестве защитного покрытия. Он также является чрезвычайно сверхжаропрочным, что позволяет использовать Hf и его соединения для производства деталей, предназначенных сверхскоростным самолетам и ракетам, включая космические.

Начиная с 1998 года совершались попытки создать «гафниевую бомбу», базирующуюся на изомере 187m2Hf. Но в результате исследований и испытаний идея оказалась несостоятельной, это связано с отсутствием возможности при нынешних технологиях добиться высвобождения избыточного вида энергии из ядра данного изомера.
Другие области применения простого вещества Hf
В атомной энергетике, наряду с вышеупомянутыми сферами, но даже в еще большем количестве, также используют гафний. Где применяется этот металл? Из-за его способности к нейтронному захвату из Hf изготавливают стержни для регуляции, специализированное стекло и керамику.
У гафния относительно низкий показатель работы электронного выхода (3,53эВ) и по этой причине его могут использовать при производстве катодов и электронных пушек. В ядерных реактивных газофазных двигателях можно найти бориды и карбиды гафния, а точнее в некоторых структурных элементах.

Гафний применение находит даже при изготовлении электрогенераторов термоэмиссионного типа и часто встречается в ионных двигателях. На основе HfO2 создаются диэлектрики, имеющие высокий уровень диэлектрической проницаемости. В будущем планируется замена привычного всем оксид кремния в микроэлектронике на оксид HfO2. Эта замена позволит повысить показатель плотности элементов в чипе.
В заключение можно сказать, что гафний, применение которого имеет место во множестве отраслей человеческой деятельности, начиная повседневной и заканчивая военной и атомной, является чрезвычайно важным элементом. Это очень востребованный металл и в природе всегда сопутствует цирконию. Редкость и его особенности качественных характеристик обусловливают довольно высокую стоимость.
