Что называют царской водкой какими свойствами она обладает
Скорее всего, опросив всех своих знакомых и друзей «что же такое ЦАРСКАЯ ВОДКА?», вы получите уверенный ответ, что это ничто иное как алкогольный напиток. Но, зная точный состав такого коктейля, его сложно назвать ни то что опьяняюще приятным, но и в принципе безопасным.
Разберемся же, что на самом деле представляет собой ЦАРСКАЯ ВОДКА.
ИСТОРИЯ
Еще с давних времен алхимики были озадачены поиском философского камня, превращающего всякий металл в самого «царя металлов», а точнее в золото. Обнаружив, что определенный раствор из кислот может растворять этот благородный металл, не оставалось ничего другого, как назвать его «царем вод» (от латинского aqua regia).
Лингвистически правильнее было бы перевести название данного коктейля, как «царская вода», но в русский язык, в отличие от многих других языков, вошла именно «царская водка».
ЧТО ЭТО ТАКОЕ?
Царская водка – это довольно опасное и ядовитое для здоровья вещество, состоящее из концентрированных кислот. Классическая смесь кислот:
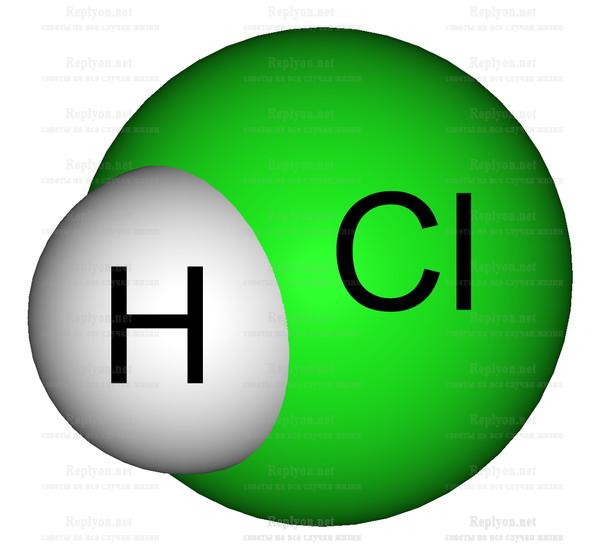
1. Соляная кислота HCl (один объем);
2. Азотная HNO3 (три объема);
3. Иногда добавляется серная кислота H2SO4.
В обычном состоянии это жидкость желтого цвета, с ярко выраженным запахом хлора и окислами азота.
Благодаря своим сильным окислительным способностям, царская водка отлично растворяет благородные металлы, например, золото, палладий и платину.
КАК ПРОИСХОДИТ ПРОЦЕСС ОКИСЛЕНИЯ?
1. Азотная кислота окисляет на соляную:
HNO3 + 3HCl = NOCl + Cl2 + 2H2O
2. Полученные вещества в результате реакции, описанной ранее, хлор и нитрозилхлорид способны растворить золото:
Au + NOCl2 + Cl2 = AuCl3 + NO
3. Образовавшийся хлорид золота присоединяет ещё молекулу HCl. Образуется тетрахлорозолотая кислота, известная в обиходе как «хлорное золото»:
AuCl3 + HC3 = H(AuCl4)
Эта комплексная кислота кристаллизуется с четырьмя молекулами воды в виде H(AuCl4).4Н2О. Ее кристаллы светло-желтые. Водный раствор также окрашен в желтоватый цвет. Далее, если осторожно нагреть золотохлористоводородную кислоту, то она разлагается с выделением HCl и красновато-коричневых кристаллов хлорида золота (III) AuCl3. При нагревании все соединения золота легко разлагаются с выделением металлического золота.
Реакция протекает аналогично и с платиной. Так, при растворении платины в царской водке получается платинохлористоводородная кислота H2(PtCl6). При выпаривании раствора она выделяется в виде красно-бурых кристаллов состава H2(PtCl6).6H2O.
ПРИМЕНЕНИЕ
1. Используется как реактив в химических лабораториях, при аффинаже золота и платины, а также для получении хлоридов металлов и в других целях. Интересно, что царская водка не способна растворить родий (Rh), тантал (Ta), иридий (Ir), фторопласт и некоторые пластики.
2. Воры и мошенники не редко используют царскую водку для открывания навесных замков. Достаточно всего лишь залить механизм замка, немного подождать и затем легко сбить замок молотком.
3. Любители используют также царскую водку для добычи золота из радиодеталей.
Конечно, царскую водку категорически не советую употреблять, как обычную – внутрь организма. Алкоголя она не содержит в принципе, а последствий, после ее употребления, и врагу не пожелаешь!
ЕСЛИ ВАМ ПОНРАВИЛАСЬ ДАННАЯ СТАТЬЯ СТАВЬТЕ ЛАЙК И ПОДПИСЫВАЙТЕСЬ НА НАШ КАНАЛ!
Царская водка представляет собой состав концентрированных соляной и азотной кислот в соотношении по объему 1:3. Данный синтез имеет сильнейшую окислительную способность, растворяя даже золото. Но почему она так называется? Все просто, царская водка, способна растворить «царя металлов», то есть золото, а водка от ласкательного водица. В трудах Альберта Великого эта субстанция упоминалась как «aqua secunda» вторичная водка, позже другие алхимики в своих сочинениях называли её «aqua regia (regis)».

История царской водки
Поворотным ключом в развитии химии стал XIII век, когда алхимики открыли сильные минеральные кислоты, способные растворять многие нерастворимые в воде вещества. До этого мир знал лишь о уксусной кислоте, известной еще с античных времен. Вновь открытые кислоты оказались в миллион раз сильнее, что вынесло алхимию на новый рубеж, ведь стало возможным производить множество химических процессов и реакций. Так вскоре была открыта и азотная кислота, названная «aqua fortis» — крепкая вода, разъедающая всё, что вступало с ней в контакт, за исключением золота, все известные на то время металлы. Спустя три века открыли хлористый водород (соляную кислоту).
В 1597 году алхимик Андреас Либавия впервые описал приготовление царской водки, путём смешивания концентрата азотной и соляной кислоты. До этого были попытки получения алкагеста, перегоняя в стеклянном сосуде сухим путем смеси селитры, нашатыря, медного купороса и квасцов и накрывая крышкой или колпаком. Этот способ был описан в XIV веке алхимиком Псевдо-Гебером, но был очень кропотливым и сложным, к тому же такая смесь могла справиться с серебром, но золото было ему неподвластным. И вот в XVI веке универсальный растворитель всё же был найден и изобретение «царская водка» способствовало становлению технической химии и усовершенствованию пробирного анализа.
Из каких кислот состоит царская водка
Что касается состава царской водки, оказалось, что химическая смесь соляной и азотной кислоты при взаимодействии своих компонентов усиливает свои способности в несколько раз. Смесь получилась настолько сильной, что в ней растворяется золото, и даже платина при соотношении 1:4 (соляная кислота при реакции с азотной кислотой высвобождает хлор, при этом раствор зеленеет, а частицы свободного хлора атакуют золото).
Формула взаимодействия выглядит так:
• Кислота азотная окисляет кислоту соляную
HNO3 + 3HCl = NOCl + Cl2 + 2H2O.
• Во время этого процесса появляется два активных вещества: нитрозилхлорид и хлор, которые в состоянии растворить золото:
• Au + NOCl2 + Cl2 = AuCl3 + NO.
Хлорид золота моментально присоединяет к себе молекулу HCl, при этом образуется тетрахлорозолотая кислота, еще известна в народе как «хлорное золото»: AuCl3 + HCl = H (AuCl4).
Приготовление царской водки в домашних условиях должно проходить с соблюдением всех мер безопасности и хорошо проветриваемом помещении.
Чтобы приготовить царскую водку, Вам понадобиться обзавестись двумя основными ингредиентами: концентрированная соляная и азотная кислота.
Так же настоятельно рекомендуем использовать только стеклянные пробирки (с отметками) и стеклянную палочку для равномерного размешивания «гремучей смеси». Оригинальный состав представляет собой смесь двух кислот в количественном соотношении 1: 3. Смешивайте, используя только одну пробирку, не отмеряйте кислоты в других емкостях, таким образом Вы минимизируете шанс проливания кислоты.
Теперь нужно обговорить по отдельности те компоненты, с которыми Вам придётся столкнуться при изготовлении царской водки.
Азотная кислота
Одноосновная кислота, чувствительна к свету, имеет очень резкий удушливый запах. Азотная кислота при сильном освещении будет распадаться на оксид азота и воду. В связи с этим, одну из сильнейших кислот, хранят в темной или непрозрачной емкости. Концентрированный раствор азотной кислоты, не растворяет алюминий и железо, поэтому можно смело хранить в металлической посуде.
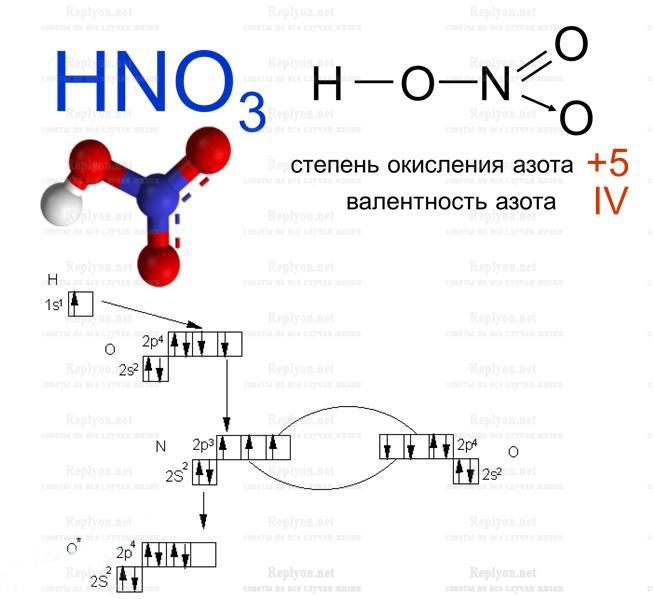
Хочется отметить, что азотная кислота есть очень сильным электролитом (как и большинство кислот) и окислителем. Очень интересным фактом, есть то, что азотная кислота (как и озон) может образоваться в атмосфере при сильных вспышках молнии. Состав атмосферного воздуха состоит на 78% из Азота, который реагирует с атмосферным кислородом. В результате такой реакции получается оксид азота (NO). В последствии при дальнейшем окислении на открытом воздухе оксид азота преобразовывается в диоксид азота (NO2 или как его еще называют бурый газ). Когда атмосферная влага вступает в реакцию с диоксидом Азота, получается азотная кислота. Концентрация в таких случаях минимальна, и она совсем не опасна для людей, животных и природы.
Соляная кислота
Вторым компонентом царской водки есть соляная кислота. Эта кислота бесцветная, на открытом воздухе выделяет пар в виде «дыма», очень сильно едкая жидкость (соляная кислота технического значения может иметь желтоватый оттенок из-за наличия в ней примесей железа и хлора).

Когда речь идет о физических свойствах соляной кислоты, здесь нужно отметить ее сильную сторону при растворении всех металлов (которые стоят в ряду напряжения до водорода) при этом выделяется Н2 и образуются соли хлоридов). Нужно быть очень осторожным при использовании данной кислоты, проводить работу или эксперименты на открытом воздухе или в хорошо проветриваемом помещении, так как кислота имеет очень резкий запах и сильно раздражает слизистые оболочки верхних дыхательных путей человеческого организма.
Производство соляной кислоты происходит путем растворения газообразного хлороводорода в обычной воде (Н2О). В свою очередь хлороводород можно получить путем взаимодействия на хлорид натрия высококонцентрированной серной кислотой.
Применение царской водки
Многие советские и постсоветские семьи наизусть знали состав царской водки. В народе ее применяют для растворения золота в домашних условиях, с целью извлечения чистого золота из микросхем, транзисторов, наручных часов и других ненужных приборов, которые в своем составе имеют небольшое количество золота.
Основным аспектом успешного завершения, задуманного Вами химического эксперимента с царской водкой есть безопасность. Используйте средства индивидуальной защиты, соблюдайте правила безопасности, будьте предельно бдительны и внимательны, на кону будет стоять Ваша жизнь и здоровье.
Видео о царской водке
Уважаемый посетитель, Вы зашли на сайт как незарегистрированный пользователь. Мы рекомендуем Вам зарегистрироваться либо зайти на сайт под своим именем.
При растворении золота в царской водке получается комплексная тетрахлорозолотая, или золотохлористоводородная, кислота [c.580]
Хлор в момент выделения состоит пз атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям [c.414]
Пробу катализатора для анализа готовят, как при исследовании алюмокобальтмолибденового катализатора. После растворения навески в царской водке раствор фильтруют и доводят объем жидкости в мерной колбе емкостью 250 мл до метки дистиллированной водой. Из этого раствора сразу же определяют колориметрически молибден и никель. [c.122]
Химическая стойкость……растворяется в царской водке, [c.205]
Иридии отличается от платины очень высокой температурой плавления и ен е большей стойкостью к различным химическим воздействиям. На иридий не действуют ин отдельные кислоты, ин царская водка. Кроме того, иридий значительно превосходит платину своей твердостью. [c.700]
Смесь НЫз и НС1 ведет себя подобно царской водке. [c.359]
Ход определения. Навеску растертого катализатора 0,5 г высушивают до постоянной массы при 105—110°С, переносят в фарфоровую чашку и растворяют в 15 мл царской водки под часовым стеклом на водяной бане. Раствор выпаривают до объема 2—3 мл и трижды обрабатывают соляной кислотой порциями по 12—15 мл, каждый раз упаривая на водяной бане. После охлаждения к жидкому остатку прибавляют 50—60 мл горячей дистиллированной воды, фильтруют через фильтр (синяя лента) в мерную колбу емкостью 250 мл и доводят объем фильтрата до метки дистиллированной водой. [c.111]
Стандартный раствор платинохлористоводородной кислоты. Растворяют 0,1 г чистого металла (99,99%) при нагревании на водяной бане в 5 мл царской водки. Раствор выпаривают почти досуха и затем трижды обрабатывают 1 мл соляной кислоты (1 1) ДО полного удаления окислов азота. Приливают 30—40 мл соляной кислоты (1 24), переводят раствор в мерную колбу емкостью 500 Л1л и доводят этой же кислотой до метки. Концентрация платины в полученном стандартном растворе составляет 0,0002 г/мл. [c.123]
Что называют царской водкой Какими свойствами она обладает Написать уравненпе реакции взаимодействия царской водки с золотом. [c.231]
Смесь одного объема HNOg и трех объемов НС называют царской водкой. Она растворяет платину, золото и другие неактивные металлы, переводя их в комплексные хлориды (см. с. 616). Нитрат-ион NO3 в нейтральной среде окислительные свойства практически не проявляет [c.357]
Что получается в результате взаимодействия Р1 с царской водкой Написать уравнение реакции. [c.252]
Либавий первым описал приготовление соляной кислоты, тет рахлорида олова, сульфата аммония и царской водки (aqua regia) — смеси азотной и соляной кислот, получившей свое название из-з [c.27]
Ванадий отличается высокой химической устойчивостью в воде, В морской воде, в растворах щелочей. Он растворяется в плавиковой кислоте, В концентрированных азотной и серной кислотах, В царской водке. [c.652]
На воздухе вольфрам окисляется только при температуре красного каления. Он очень стоек по отношению к кислотам, даже к царской водке, но растворяется в смеси азотной кислоты и фтороводорода. [c.661]
Производится ли периодическая проверка сопротивления изоляции про- водки, троллейных проводов и электроаппаратуры грузоподъемных машин (не реже одного раза в год) ( ЭШ—6—22 ПТЭ и ПТБ). [c.342]
Платина. Вследствие очень малой химической активности и высокой температуры плавления (1770°С) платина является ценнейшим материалом для изготовления различных химических приборов и сосудов (тиглей, чашек, электродов для электрогра-виметрических определений и т. д.). Однако, несмотря на большую устойчивость платины, хлор, бром, царская водка (смесь концентрированных HNO3 и НС1), едкие щелочи ее разрушают. Платина об )азует сплавы со свинцом, сурьмой, мышьяком, оловом, серебром, висмутом, золотом и др. Соединения указанных элементов в платиновой посуде нагревать нельзя. [c.45]
Хлорноватая кислота по свойствам напоминает HNO3, в частности, ее смесь с соляной кислотой — сильный окислитель (такого типа, как царская водка). [c.293]
На бор действуют лишь горячие концентрированные азотная и серная кислоты, а-также царская водка, переводя его в Н3ВО3. Щелочи при отсутствии окислителей на бор не действуют. [c.436]
В обычных условиях V и особенно Nb и Та отличаются высокой химической стойкостью. Ванадий на холоду растворяется лишь в царской водке и концентрированной HF, а при нагревании — в HNO3 и концентрированной H2SO4. Ниобий и тантал растворяются лишь в плавиковой кислоте и смеси плавиковой и азотной кислот с образованием отвечающих их высшей степени окисления анионных фторокомплексов [c.540]
На анодный шлам (после обогащения) действуют царской водкой при нагревании. Р1, Рс1, РЬ, 1г и Ru переходит в раствор в виде Н2[Р1С1б1, Н РаС ,], Нз[РНС1б], НЛ1гС1б] и Н.ЛРиС ], а Оз остается с нерастворимыми минеральными остатками шлама. [c.619]
Смесь, состоящая из 1 объема азотной и 3—4 обт>емов концен трнрованной соляной кислоты, называется царской водкой. Цар ская водка растворяет некоторые металлы, пе взаимодействующие с азотной кпслотой, в то.ч числе и царя металлов — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием. клороксида азо-rai ni), пл[1 хлорида нитрозила, NO I [c.414]
Об уменьшении химической активности в ряду Си—Ag—Au свидетельствуют также значения стандартных электродных потенциалов. Поскольку Си, Ag и Аи расположены в ряду напряжений после водорода, кислоты могут окислять их лишь за счет аниона Си и Ag растворяются в HNO3 и концентрированной H2SO4, Аи — в горячей концентрированной H SeO . Лучшим растворителем для золота являются насыщенный хлором раствор НС1 и царская водка. Как в том, так и в другом случае взаимодействие происходит за счет окисления Аи атомарным хлором и образования анионного комплекса [c.622]
Ход определения. Навеску растертого катализатора 0,2—0,5 г помещают в предварнтельио взвешенный етек-ляиный бюкс и сушат в сушильном шкафу при 110— 120 °С до постоянной массы. Высушенную навеску переносят в фарфоровую чашку емкостью 100 мл и растворяют в 15 мл царской водки под часовым стеклом иа водяной бане. Раствор выпаривают до объема 2—3 мл и еще три раза обрабатывают концентрированной соляной кислотой порциями по 12—15 мл до полного удаления окислов азота. После этого чашку охлаждают, к остатку прибавляют 3—5 мл концентрированной соляной кислоты и 50—60 мл горячей дистиллированной воды и ставят на несколько минут на водяную баню для растворения остатка. Полученный раствор фильтруют через фильтр (синяя лента) в мерную колбу емкостью 500 мл и доводят до метки дистиллированной водой (раствор А). [c.116]
Ход определения. Навеску растертого катализатора 0,5 г помещают в стеклянный предварительно взвешенный бюкс и сушат при 110—120°С в сушильном шкафу до постоянной массы. Высушенную навеску переносят в фарфоровую чашку емкостью 100 мл и растворяют в 15 лл царской водки под часовым стеклом на водяной бане. Раствор упаривают до объема 2—3 мл и три раза обрабатывают концентрированной соляной кислотой порциями по 12—15 мл до полного удаления окислов азота. Если проба полностью не растворяется, что может быть при растворении регенерированного катализатора после гпдрогенизационной переработки тяжелого вида сырья, то добавляют 3—4 мл серной кислоты (1 1) и выпаривают на электрической плитке, покрытой слоем асбеста, до появления белых паров. [c.120]
Ход определения. Исследуемые пробы растирают в агатовой ступке и сушат в шкафу до постоянной массы при ПО—120°С. Из сухой пробы отбирают кавеску около 0,5 г, помещают ее в фарфоровую чашку емкостью 100 мл и растворяют в 15 мл царской водки под часовым стеклом на водяной бане. Раствор в чашке выпаривают до объема 2—3 мл и три раза обрабатывают концентрированной кислотой порциями по 12—15 мл для удаления окислов азота. Для полного растворения катализатора в раствор добавляют еще 3—4 мл серной кислоты (1 1) и выпаривают на электрической плитке, покрытой асбестом, до появления белых паров. После охлаждения к жидкому остатку прибавляют 50—60 мл горячей дистиллированной воды. Раствор фильтруют через фильтр (синяя лента) в мерную колбу емкостью 200—250 мл и доводят его объем до метки дистиллированной водой. [c.128]
В химическом отношет-щ золото—малоактивный металл. На воздухе оно не изменяется, даже прн сильном нагревании. Кислоты в отдельности не действуют на золото, но в смеси соляной и азотной кислот (царской водке) золото легко растворяется. Так же легко растворяется золото в хлорной воде и в аэрируемых (продуваемых воздухом) растворах цианидов щелочных металлон. ] туть тоже растворяет золото, образуя амал1згаму, которая при содержании более 15% золота становится твердой. [c.580]
Металлический титан плавится при 1665 °С плотность его равна 4,505 г/смЗ. Титан — довольно активный металл стандартный электродный потенциал системы Ti/Ti + равен —1,63 В, Однако благв-даря образованию па поверхности металла плотной защитной пленки титан обладает исключительно высокой стойкостью против коррозии, превышающей стойкость нержавеющей стали. Он не окисляется на воздухе, в морской воде и не изменяется в ряде агрессивных химических сред, в частности в разбавленной и концентрированной азотной кислоте и даже в царской водке. [c.649]
Оба металла, в особенности тантал, устойчивы во многих агрес сивных средах. На инх не действуют соляная, серная, азотная,, клорная кислоты и царская водка, так как на поверхности этих металлов образуется тонкая, но очень прочная и химически стойкая оксидная пленка. У тантала, например, эта пленка представляет собой оксид тантала (V) ТагОа. Поэтому на тантал действуют только такие реагенты, которые способны взаимодействовать с этим оксидом или проникать сквозь него. К подобным реагентам относятся фтор, фтороводород и плавиковая кислота, расплавы н1елочей. [c.653]
Платина — белый блестящий ковкий металл, не изменяющийся иа чоздухе даже при сильном накаливании. Отдельные кислоты на нее не действуют. Платина растворяется в царской водке, но значительно трудное, чем золото. [c.698]
В химическом отношении палладий огличается от других платиновых металлов значительно большей активностью. При нагревании докрасна он соединяется с кислородом, образуя оксид Рс10, растворяется в азотной кислоте, горячей концентрированной серной кпслоте н в царской водке. [c.700]
Диоксид урана UOj растворяется в концентрированной H2SO4 с образованием сульфата урана (IV), а концентрированной HNO3 и царской водкой окисляется, образуя соли диоксоурана (VI), т.е. соответственно нитрат и хлорид. Написать уравнения реакций. [c.195]
Все три металла подгруппы титана растворяются в плавиковой кислоте, царской водке и особенно в смеси HNOз и НР. Написать уравнения реакций и указать, какую функцию выполняет в них НР. [c.199]
Сколько молей этанола С2Н5ОН можно получить из 25 г лерода Если алмаз массой 5 карат полностью превратить в этаит, сколько литров водки получится из него Один карат равен 0,2053 г, водка представляет собой 40 об.%-ный раствор этанола в воде, плотность этанола 0,790 г мл . [c.106]
