Актин и миозин в каких продуктах
Добрый день, друзья!
Когда дело доходит до увеличения размера мышц, обычно указывается, что поднятие тяжестей разрушает мышцу, которая затем становится сильнее или больше в результате процесса восстановления. Но действительно ли это правда или просто еще один из распространенных спортивных мифов, который передается от более опытных ветеранов новичкам?
Что ж, в отличие от многих распространенных мифов о спортзале, это утверждение фактически основано на том, что тренировка с отягощениями до усталости действительно вызывает повреждение мышц. В частности, это повреждение происходит с белками, которые включают мышечные волокна. Мышцы представляют собой пучки отдельных волокон, обернутые в фасции и соединительную ткань. Наименьшими компонентами мышечных волокон являются микрофиламенты из актина и миозина. Теория скользящей нити предполагает, что актин и миозин перекрываются и что, когда они получают сигнал от центральной нервной системы, чтобы сжиматься, они скользят друг через друга, создавая усиливающее, сокращающее мышцы действие.
Существует два типа перегрузки, которые могут стимулировать рост мышц: метаболический и механический. Метаболическая перегрузка относится к количеству работы, которую выполняет мышца, которая истощает ее доступный запас энергии. Поскольку мышцы постоянно тренируются до утомления, мышечные клетки приспосабливаются, чтобы удерживать больше гликогена в качестве топлива. Поскольку 1 грамм гликогена может удерживать до 3 грамм воды, когда мышца накапливает больше гликогена, она может увеличиваться в размерах из-за дополнительного гликогена и присоединенной воды.
Механическая перегрузка относится к структурному повреждению, которое происходит с нитями актин-миозинового белка в результате напряженных упражнений, таких как тяжелая атлетика или взрывная плиометрика. Повреждение мышц инициирует процесс восстановления, при котором определенные гормоны вместе с белком макронутриентов синтезируют новые сателлитные клетки, которые используются для восстановления поврежденных мышечных волокон. Другими словами, роль белка состоит в том, чтобы помочь восстановить ткани, поврежденные физическими упражнениями.
Теперь кратко и научно о девяти ключевых факторах влияния белка в поддержании организма во время и после тренировки.
1. В организме человека белки являются основными структурными компонентами клеток и выполняют несколько различных функций. Основная функция белка, потребляемого в рационе питания, заключается в создании и восстановлении клеток, в том числе мышечных клеток, поврежденных при физических нагрузках, вплоть до мгновенной усталости (или отказа в упражнении). Дополнительные роли, которые белки с пищей играют в организме, включают транспортировку клеток, служащих ферментами для поддержки различных физиологических функций и действующих в качестве гормонов.
2. Хотя основная роль белка заключается в восстановлении поврежденных тканей, его также можно использовать для выработки энергии для сокращения мышц, когда другие источники аденозинтрифосфата (АТФ, клеточная форма энергии), а именно жиры и углеводы, недоступны. Глюконеогенез — это термин, который описывает, как белок превращается в гликоген для АТФ. Тем не менее, это происходит только в результате средней или высокой интенсивности в течение длительного периода времени. Спортивные напитки содержат сахар и натрий, которые помогают поддерживать уровень гликогена во избежание глюконеогенеза, экономя белки, поэтому их можно использовать для восстановления тканей после тренировки. Другим вариантом является ограничение высокоинтенсивной активности не более 45-50 минут, чтобы обеспечить достаточный запас гликогена во время тренировки.
3. Аминокислоты являются строительными блоками белка. Есть 20 аминокислот. Четыре считаются несущественными, потому что организм сам может производить их, и девять незаменимых, потому что они не могут быть произведены в организме и должны потребляться в рационе. Прием аминокислот до и во время тренировки в сочетании с восстановительной пищей после тренировки или протеином может увеличить синтез мышечного белка. Применение различных стратегий восстановления после тренировки может позволить тренироваться с большим объемом, чтобы достичь определенной силы или выносливости.
4. Белок обеспечивает около 4 калорий энергии на грамм, и когда белок потребляется как часть хорошо сбалансированной диеты, он может помочь обеспечить чувство сытости или сытости. Это, в свою очередь, может уменьшить чувство голода, которое может привести к потреблению слишком большого количества калорий. Кроме того, белок требует больше энергии в процессе пищеварения по сравнению с углеводами и жирами. Что важно с точки зрения похудения.
5. Организм постоянно строит новые клетки для замены старых, и аминокислоты, потребляемые в рационе, поддерживают этот процесс. Рекомендации по питанию для потребления белка для среднего, здорового взрослого человека составляют 0,8–1,0 г белка на килограмм веса тела. Рекомендуемая суточная доза для человека, который много тренируется для аэробной выносливости, составляет 1,0-1,6 г / кг массы тела. Для занимающихся силовыми тренировками, потребление 1,4-1,7 г / кг массы тела будет поддерживать синтез мышечного белка. Например, активный 70-килограммовый мужчина, который занимается силовыми тренировками, должен потреблять приблизительно 100-120 граммов белка в день.
6. Белок должен составлять 15-30% от ежедневного потребления калорий в зависимости от уровня активности. Больше белка должно потребляться в дни, которые включают более высокую активность.
7. Для людей, заинтересованных в росте мышц, необходимо употреблять продукты с высоким содержанием белка, такие как постное мясо, рыба, яйца, курица или молоко. Соя является единственной формой растительного белка, которая содержит все восемь незаменимых аминокислот. Хотя потребление белка важно для роста мышц, потребление слишком большого количества белка, хотя и не обязательно опасного, просто приведет к тому, что организм будет выводить его с мочой.
8. Белок следует употреблять в течение дня, а не за один прием пищи. Например, вышеупомянутый активный мужчина весом 70 кг целесообразно потреблять 20-40 граммов белка за раз, распределенных между трехразовым питанием и двумя закусками.
9. Из белка, хранящегося в организме, почти половина хранится в скелетных мышцах, до 15% используется для структурных тканей, таких как кожа и кости, а остальные белки находятся в тканях и органах, включая почки и печень.
Отличных результатов и богатырского здоровья.
Подписывайтесь на канал!
Часть структуры миозина II. Атомы тяжелой цепи окрашены в красный (слева), атомы легкой цепи окрашены в желтый и оранжевый.
Миозин — фибриллярный белок, один из главных компонентов сократительных волокон мышц — миофибрилл. Составляет 40—60 % общего количества мышечных белков. При соединении миозина с другим белком миофибрилл (актином) образуется актомиозин — основной структурный элемент сократительной системы мышц. Другое важное свойство миозина — способность расщеплять аденозинтрифосфорную кислоту (АТФ)[1]. Благодаря АТФ-азной активности миозина, химическая энергия макроэргических связей АТФ превращается в механическую энергию мышечного сокращения. Молекулярная масса миозина около 500 000. При действии протеолитических ферментов миозин распадается на фрагменты — тяжёлый меромиозин и лёгкий меромиозин (молекулярная масса около 350 000 и около 150 000). С помощью меченного тяжёлого меромиозиона при цитологических исследованиях выявляется местоположение актиновых микрофиламентов в клетке.
Структура[править | править код]
Миозины — семейство белков, являющихся моторами цитоскелета системы микрофиламентов. Миозины состоят из тяжёлых цепей (H) и лёгких (L) в разном количестве в зависимости от типа миозина. H-цепь имеет 2 участка — «головку» и «хвостик». Головка тяжёлой цепи миозина имеет сайт связывания с актином и сайт связывания АТФ. По количеству «головок» миозины делятся на «традиционные» (англ. conventional myosin) — 2 головки и нетрадиционные (англ. unconventional myosin) — 1 головка. Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные — не могут.
На электронных микрофотографиях молекулы миозина имеют вид палочек (1600´25) с двумя глобулярными образованиями на одном из концов. Полагают, что 2 полипептидные цепи, образующие миозин, скручены в спираль. Белки, аналогичные миозину, обнаружены в жгутиках, ресничках и других двигательных структурах у многих простейших и бактерий, сперматозоидов животных и некоторых растений.
Виды миозина[править | править код]
Мышечный миозин[править | править код]
Мышечный миозин (т. н. миозин II) — традиционного типа. Обнаруживается в поперечно-полосатой мускулатуре позвоночных и беспозвоночных животных, в гладкомышечных клетках беспозвоночных. Мышечный миозин всегда состоит из двух H-цепей по 200 кДа каждая, образующих две «головки» молекулы и скрученный из двух хвостиков тяжёлой цепи хвост. Две лёгкие L-цепи по 18 кДа ассоциированы с тяжёлыми цепями в районе перехода от головки к хвосту. Связываясь с микрофиламентами головками попеременно, миозины как бы «шагают» по нему за счёт гидролиза макроэргической связи молекулы АТФ. При этом к хвосту молекулы может быть присоединена соседняя микрофибрилла, и тогда происходит мышечное сокращение.
Немышечный миозин[править | править код]
Немышечные миозины встречаются в разных клетках, в том числе в гладко-мышечных клетках позвоночных. Немышечные миозины могут быть 2-головые и 1-головые, то есть традиционные и нетрадиционные. Нетрадиционные миозины найдены во всех клетках. Они не могут образовывать протофиламенты. Одноголовый миозин тащит груз от (−) конца микрофиламента к (+)-концу. Миозин I — в фоторецепторах, миозин VII — в органах слуха.
Примечания[править | править код]
- ↑ В. А. Энгельгардт и М. Н. Любимова, 1939
См. также[править | править код]
- Моторные белки
Ссылки[править | править код]
- Section 18.3Myosin: The Actin Motor Protein / Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. — New York: Garland Science; 2002 (англ.)
Белковый состав мышечной ткани весьма сложен. Уже с давних пор он изучается многими учеными. Основоположник отечественной биохимии А. Я. Данилевский, исследуя белки мышечной ткани, дал правильное представление о физиологической роли ряда белков и о значении сократительного белка миозина, содержащегося в миофибриллах.
В дальнейшем миозин исследовали В. А. Энгельгардт, И. И. Иванов и другие советские ученые. Большой вклад в изучение мышечного сокращения внес венгерский ученый Сцент-Джордьи. Другой венгерский ученый Штрауб открыл белок мышц актин.
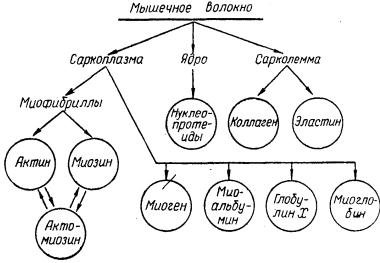
Изучение мышечной ткани следует начинать с белков, так как на их долю приходится около 80% сухого остатка мышечной ткани. В соответствии с морфологической структурой мышечного волокна белки распределяются следующим образом:
Из приведенной схемы видно, что белковый состав мышечной ткани очень разнообразен. В саркоплазме содержится четыре белка: миоген, миоальбумин, глобулин X и миоглобин. В миофибриллах содержится комплекс, состоящий из актина и миозина, называемый актомиозином. Все белки саркоплазмы называются внутриклеточными, а белки сарколеммы — внеклеточными, В ядрах содержатся нуклеопротеиды, в сарколемме — коллаген и эластин. Если учесть, что в мышечной ткани, кроме того, содержится еще значительное количество различных ферментов и каждый из них является особым белком, то белковый состав мышечной ткани оказывается еще более сложным.
Миозин
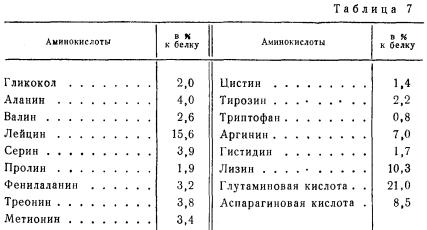
Основным белком мышечной ткани является миозин. Он составляет почти половину всех белков мышечной ткани, причем он встречается в мышцах всех млекопитающих, птиц и рыб. По пищевой ценности он является полноценным белком. В табл. 7 приведен аминокислотный состав миозина быка.
Миозин был детально изучен советскими биохимиками, обнаружившими, что он является не только структурным белком мышечной ткани, т. е. белком, участвующим в построении клетки, но и ферментом — аденозинтрифосфатазой, катализирующей реакцию гидролиза АТФ. При этом образуются АДФ (аденозинди-фосфорная кислота) и фосфорная кислота и выделяется большое количество энергии, используемой при мышечной работе.
Миозин получен в чистом кристаллическом виде. Молекулярный вес его очень большой, примерно 1,5 млн. Кристаллический миозин при полном отсутствии солей прекрасно растворим в воде. Ho достаточно добавить к воде ничтожное количество какой-либо соли, например хлористого натрия, как он полностью теряет способность растворяться и растворение наступает уже при концентрации хлористого натрия около 1%. Однако по отношению к солям, например к сернокислому аммонию, миозин ведет себя как типичный глобулин.
При извлечении белков мяса водой миозин не переходит в раствор. При обработке мяса солевыми растворами он обнаруживается в солевой вытяжке. При разведении водой солевого раствора миозина уменьшается концентрация соли и миозин начинает выпадать в осадок. Миозин высаливается при полном насыщении хлористым натрием и сернокислым магнием (высаливание производят кристаллической солью, иначе добиться полного насыщения невозможно).
Изоэлектрическая точка миозина находится при pH 5,4—5,5.
Миозин обладает свойством вступать в особые связи с различными веществами, в первую очередь с белками, с образованием комплексов. Особую роль в деятельности мышц играет комплекс миозина с актином — актомиозин.
Актин и актомиозин
Белок актин может существовать в двух формах: фибриллярной и глобулярной. В покоящейся мышце актин находится в фибриллярной форме; при мышечном сокращении он переходит в глобулярную. Большое значение в этом превращении имеют аденозинтрифосфорная кислота и соли.
В мышечной ткани содержится 12—15% актина. В раствор он переходит при длительном извлечении солевыми растворами; при кратковременном извлечении он остается в строме. Молекулярный вес актина около 75 000.
При смешивании растворов актина и миозина образуется комплекс, называемый актомиозином, из которого в основном построены миофибриллы. Этот комплекс отличается высокой вязкостью, способен резко сжиматься при определенных концентрациях ионов калия и магния (0,05 м KCl >и 0,001 м MgCl2) в присутствии аденозинтрифосфата. При более высоких концентрациях солей (0,6 м KCl) актомиозин при добавлении АТФ распадается на актин и миозин. Вязкость раствора при этом заметно снижается.
По представлениям Сцент-Джордьи сжатие актомиозина под действием АТФ лежит в основе сокращения живой мышцы.
Актомиозин, как подлинный глобулин, не растворим в воде. При обработке мяса солевыми растворами в раствор переходит актомиозин с неопределенным содержанием актина в зависимости от длительности извлечения.
Глобулин X
В мышечной ткани содержится около 20% глобулина X от всего количества белка. Он является типичным глобулином, т. е. не растворяется в воде, но растворяется в солевых растворах средней концентрации; осаждается из растворов при половине насыщения сернокислым аммонием (1 объем раствора белка и 1 объем насыщенного раствора сернокислого аммония), хлористым натрием при полном насыщении.
Mиоген
В мышечной ткани содержится около 20% миогена от всего количества белка. Его нельзя отнести к типичным альбуминам или глобулинам, так как он растворяется в воде, недостаточно высаливается хлористым натрием и сернокислым магнием при насыщении (кристаллической солью), в то же время осаждается сернокислым аммонием при 2/3 насыщения (1 объем белкового раствора и 2 объема насыщенного раствора сернокислого аммония). Этот белок был получен в кристаллическом виде. Молекулярный вес миогена 150 000.
В. А. Энгельгардт обнаружил у миогена способность катализировать одну из важнейших реакций, протекающих в процессе гликолиза мышечной ткани. Этим открытием впервые было показано, что ферментативной активностью могут обладать структурные белки, т. е. белки, участвующие в построении тканей.
Mиоальбумин
В мышечной ткани содержится около 1—2% миоальбумина от всего количества белка. Он является типичным альбумином, т. е. растворяется в воде, не осаждается хлористым натрием при насыщении, но осаждается сернокислым аммонием.
Mиоглобин
Миоглобин — сложный белок хромопротеид с молекулярным весом 16 900. При гидролизе он распадается на белок глобин и небелковую группу гем. Миоглобин окрашивает мышцы в красный цвет; от гемоглобина он отличается белковой частью; простетическая группа у них одинакова.
При окислении гем переходит в гематин, а в присутствии соляной кислоты — в гемин. По содержанию гемина можно судить о количестве миоглобина в мышечной ткани.
Содержание гемина в мышцах крупного рогатого скота колеблется от 42 до 60 мг на 100 г ткани; в мышцах свиней его значительно меньше — от 22 до 42 мг на 100 г ткани, поэтому они слабее окрашены.
Миоглобин, как и пигменты крови, имеют характерный спектр поглощения.
Принцип получения спектров поглощения окрашенных веществ, в частности пигментов мяса и крови, состоит в том, что световая энергия, проходя через раствор пигмента, поглощается этим раствором. При этом происходит так называемая абсорбция (поглощение) света, которую можно обнаружить спектроскопом.
Характерные полосы поглощения для пигментов мышечной ткани и крови находятся в пределах от 400 до 700 ммк. В этом интервале волны воспринимаются нашим глазом, и мы можем увидеть посредством спектроскопа в спектре темные полосы, получающиеся благодаря абсорбции света с определенной длиной волны.

Поглощение света окрашенными веществами можно определить количественно спектрофотометром. Полученные результаты принято выражать графически. В этом случае по оси абсцисс откладывают длину волны света, а по оси ординат — количество света в процентах, прошедшее через раствор. Чем меньше прошло света, тем больше поглотилось его окрашенным веществом. Полное пропускание света раствором принимается за 100%.
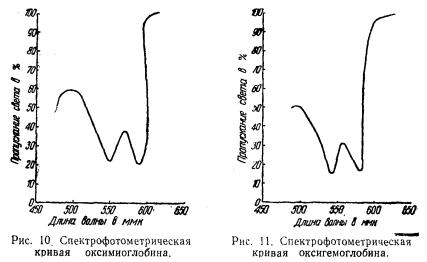
На рис. 10 показано поглощение (абсорбция) света раствором оксимиоглобина; из него видно, что оксимиоглобин имеет две ярко выраженные характерные полосы поглощения в видимой области спектра, т. е. два участка, в которых он меньше всего пропускает света и, следовательно, больше всего поглощает света. Максимумы этих участков находятся при двух длинах волн; λ 585 ммк и λ 545 ммк,
На рис. 11 показана для сравнения спектрофотометрическая кривая оксигемоглобина.
Миоглобин обладает большей способностью связываться с кислородом, чем гемоглобин крови. Посредством миоглобина мышечная ткань снабжается кислородом. В работающих мышцах миоглобина содержится больше, так как в них окисление протекает интенсивнее. Известно, что мышцы ног сильнее окрашены, чем спинная мышца; мышцы работающих волов окрашены также сильнее, чем неработающих животных. Особенно это заметно у птиц, грудные мышцы которых, являясь нерабочими, почти не окрашены.
Коллаген и эластин
Коллаген и эластин — соединительнотканные белки не растворимые в воде и солевых растворах. Они образуют сарколемму — тончайшую оболочку мышечного волокна.
Нуклеопротеиды
Нуклеопротеиды — белки, составляющие клеточное ядро. Характерной особенностью их является способность растворяться в растворах слабых щелочей. Это объясняется тем, что в их молекуле содержится простетическая группа, имеющая кислотные свойства.
Разделение белков мышечной ткани
При обработке мышечной ткани солевыми растворами средней концентрации ее белки можно разделить на белки стромы и белки плазмы. Под стромой понимают не растворимую в солевом растворе структурную основу мышечной ткани, которая состоит главным образом из белков сарколеммы (см. схему).

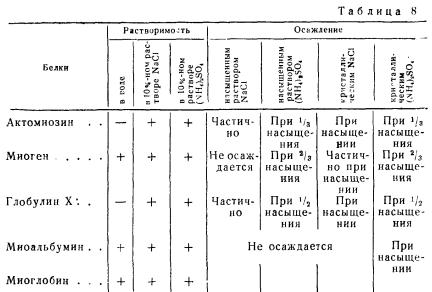
Растворимость внутриклеточных белков мышечной ткани различна. Например, актомиозин и глобулин X не растворяются в воде и легче осаждаются из солевых растворов сернокислым аммонием и хлористым натрием, чем миоген. Миоген растворяется в воде подобно миоальбумину, но отличается от него по высаливаемости.
Растворимость белков мышечной ткани в растворах солей при нейтральной реакции и их осаждаемость приведены в табл. 8.
При посоле, варке и других видах технологической обработки мяса происходит потеря белковых веществ. Величины потерь белков обусловлены различными растворимостью и осаждаемастью их.
Зная свойства белков, можно подобрать такие условия, при которых потери будут наименьшими. Поэтому на изучение указанных свойств белков должно быть обращено особое внимание.
- Химия мышечной ткани
- Денатурация белков крови
- Использование крови для технических целей
- Использование крови для лечебных целей
- Использование крови для пищевых целей
- Порча крови
- Химический состав плазмы крови
- Гемолиз крови
- Химия эритроцитов
- Химический состав крови
- Постоянство состава и физико-химические свойства крови
- Дефибринирование крови
- Стабилизация крови
- Свертывание крови
- Химия крови
- Автолиз
- Гниение белков в кишечнике
- Обмен сложных белков
- Образование специфических веществ
- Декарбоксилирование белков
- Переаминирование белков
- Дезаминирование белков
- Синтез белков
- Обмен белков
- Обмен жиров и липоидов
- Связь между дыханием и брожением
- Обмен углеводов
- Всасывание
- Пищеварение
- Пищевые вещества