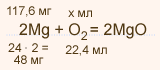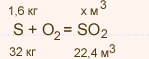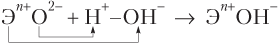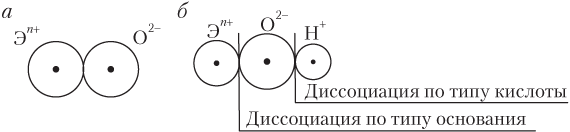Высшего оксида какого химического элемента наиболее выражены кислотные свойства

ГДЗ по классам
2 класс
- Математика
3 класс
- Математика
4 класс
- Математика
5 класс
- Математика
- Русский язык
- Английский язык
6 класс
- Математика
- Русский язык
- Английский язык
7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
10 класс
- Геометрия
- Химия
11 класс
- Геометрия
ГДЗ и решебники
вип уровня
- 2 класс
- Математика
- 3 класс
- Математика
- 4 класс
- Математика
- 5 класс
- Математика
- Русский язык
- Английский язык
- 6 класс
- Математика
- Русский язык
- Английский язык
- 7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- 8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 10 класс
- Геометрия
- Химия
- 11 класс
- Геометрия
- ГДЗ
- 9 класс
- Химия
- О. С. Габриелян, 2014г.
- Вопрос 6, Параграф 1

Назад к содержанию
Условие
У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора; б) фосфора или серы?
Решение 1

Другие задачи из этого учебника
- 3
- 4
- 5
- 6
- 7
- 8
- 9
Поиск в решебнике
Популярные решебники
 ГДЗ по Химии за 9 класс Габриелян О.С.
ГДЗ по Химии за 9 класс Габриелян О.С.
Издатель: О. С. Габриелян, 2014г.
Задания для входного контроля по химии.
1. Строение внешнего энергетического уровня 3s23p6 соответствует атому элемента:
1.аргона 2. никеля 3.кислорода 4. хлора
2. Элемент с наиболее ярко выраженными металлическими свойствами:
1.алюминий 2. кремний 3.магний 4. натрий
3. Характер свойств высшего оксида химического элемента с порядковым номером 13 в Периодической системе:
1. амфотерный 2. кислотный 3. основной
4. Кислотные свойства наиболее ярко выражены у высшего гидроксида:
1. азота 2. бора 3.бериллия 4. углерода
5. Схема превращения N-3→ N+2 соответствует химическому уравнению:
1. NH3 + HCl = NH4Cl 2. N2 + 3H2 = 2NH3
3. 4NH3 + 3O2 = 2N2 + 6H2O 4. 4NH3 + 5O2 = 4NO + 6H2O
6.Сокращенное ионное уравнение реакции Fe3+ + 3OH— = Fe(OH)3 ↓ соответствует взаимодействию:
1.оксида железа (III) и воды; 2.соляной кислоты и гидроксида железа (III);
3.фосфата железа (III) и раствора гидроксида натрия;
4. хлорида железа (III) и раствора гидроксида калия.
7. Формула вещества, реагирующего с разбавленной серной кислотой:
1. О2 2. CaO 3. Cu 4. CO2
8. Элементом Э в схеме превращений Э → Э2О → ЭОН является:
1. барий 2. серебро 3. литий 4. углерод
9. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху, необходимо наклониться над сосудом и глубоко вдохнуть.
1) Верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны.
10. Напишите определение понятия. Химия это наука………..
Задания для входного контроля по химии.
1. Строение внешнего энергетического уровня 3s23p6 соответствует атому элемента:
1.аргона 2. никеля 3.кислорода 4. хлора
2. Элемент с наиболее ярко выраженными металлическими свойствами:
1.алюминий 2. кремний 3.магний 4. натрий
3. Характер свойств высшего оксида химического элемента с порядковым номером 13 в Периодической системе:
1. амфотерный 2. кислотный 3. основной
4. Кислотные свойства наиболее ярко выражены у высшего гидроксида:
1. зота 2. бора 3.бериллия 4. углерода
5. Схема превращения N-3→ N+2 соответствует химическому уравнению:
1. NH3 + HCl = NH4Cl 2. N2 + 3H2 = 2NH3
3. 4NH3 + 3O2 = 2N2 + 6H2O 4. 4NH3 + 5O2 = 4NO + 6H2O
6.Сокращенное ионное уравнение реакции Fe3+ + 3OH— = Fe(OH)3 ↓ соответствует взаимодействию:
1.оксида железа (III) и воды; 2.соляной кислоты и гидроксида железа (III);
3.фосфата железа (III) и раствора гидроксида натрия;
4. хлорида железа (III) и раствора гидроксида калия.
7. Формула вещества, реагирующего с разбавленной серной кислотой:
1. О2 2. CaO 3. Cu 4. CO2
8. Элементом Э в схеме превращений Э → Э2О → ЭОН является:
1. барий 2. серебро 3. литий 4. углерод
9. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху, необходимо наклониться над сосудом и глубоко вдохнуть.
1) Верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны.
10. Напишите определение понятия. Химия это наука………..
| ||||||||||||||||||||||||||||||||||||||||
https://Reshebnikxim.narod.ru/ | ||||||||||||||||||||||||||||||||||||||||
3. Периодический закон и периодическая система химических элементов
3.4. Периодическое изменение свойств веществ
Периодически изменяются следующие свойства простых и сложных веществ:
- строение простых веществ (вначале немолекулярное, например от Li к C, а затем молекулярное: N2 — Ne);
- температуры плавления и кипения простых веществ: при движении слева направо по периоду t
пл и t
кип вначале, в целом, возрастают (алмаз — самое тугоплавкое вещество), а затем уменьшаются, что связано с изменением строения простых веществ (см. выше); - металлические и неметаллические свойства простых веществ. По периоду с ростом Z способность атомов отдавать электрон уменьшается (Е
и растет), соответственно металлические свойства простых веществ ослабевают (неметаллические — усиливаются, поскольку увеличивается Е
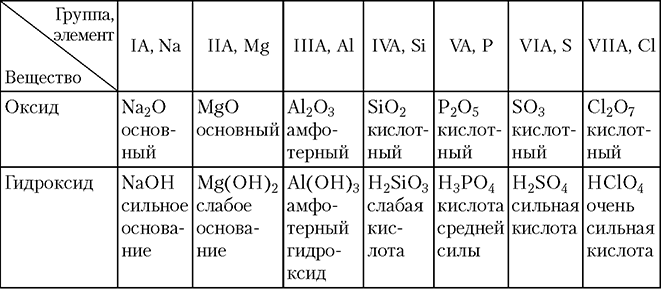
ср атомов). Сверху вниз по группам А, напротив, металлические свойства простых веществ усиливаются, а неметаллические — ослабевают; - состав и кислотно-основные свойства оксидов и гидроксидов (табл. 3.1–3.2).
Таблица 3.1
Состав высших оксидов и простейших водородных соединений элементов А-групп
| Группа | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
|---|---|---|---|---|---|---|---|
| Формула высшего оксида | Э2O | ЭO | Э2O3 | ЭO2 | Э2O5 | ЭO3 | Э2O7 |
| Формула простейшего водородного соединения | ЭH | ЭH2 | ЭH3 | ЭH4 | ЭH3 | ЭH2 (Н2Э) | ЭH (НЭ) |
Как видно из табл. 3.1, состав высших оксидов изменяется плавно в соответствии с постепенным возрастанием ковалентности (степени окисления) атома.
С ростом заряда ядра атома в периоде основные свойства оксидов и гидроксидов ослабевают, а кислотные — усиливаются. Переход от основных оксидов и гидроксидов к кислотным в каждом периоде происходит постепенно, через амфотерные оксиды и гидроксиды. В качестве примера в табл. 3.2 показано изменение свойств оксидов и гидроксидов элементов 3-го периода.
Таблица 3.2
Оксиды и гидроксиды, образованные элементами 3-го периода, и их классификация
В группах А с ростом заряда ядра атома происходит усиление основных свойств оксидов и гидроксидов. Например, для IIA-группы имеем:
1. BeO, Be(OH)2 — амфотерные (слабые основные и кислотные свойства).
2. MgO, Mg(OH)2 — слабые, основные свойства.
3. CaO, Ca(OH)2 — выраженные основные свойства (щелочи).
4. SrO, Sr(OH)2 — выраженные основные свойства (щелочи).
5. BaO, Ba(OH)2 — выраженные основные свойства (щелочи).
6. RaO, Ra(OH)2 — выраженные основные свойства (щелочи).
Такие же тенденции прослеживаются и для элементов других групп (состав и кислотно-основные свойства бинарных водородных соединений см. в табл. 3.1). В целом с ростом атомного номера по периоду основные свойства водородных соединений ослабевают, а кислотные свойства их растворов усиливаются: гидрид натрия растворяется в воде с образованием щелочи:
NaH + H2O = NaOH + H2,
а водные растворы H2S и HCl — кислоты, причем более сильной является хлороводородная кислота.
1. В группах А с ростом заряда ядра атома сила бескислородных кислот также возрастает.
2. В водородных соединениях число атомов водорода в молекуле (или формульной единице) сначала возрастает от 1 до 4 (группы IA–IVA), а затем уменьшается от 4 до 1 (группы IVA–VIIA).
3. Летучими (газообразными) при н.у. являются только водородные соединения элементов IVA–VIIA групп (кроме H2O и HF)
Описанные тенденции в изменении свойств атомов химических элементов и их соединений суммированы в табл. 3.3
Таблица 3.3
Изменение свойств атомов элементов и их соединений с ростом заряда ядра атома
| Свойства | Тенденция изменения | |
|---|---|---|
| в периодах | в группах А | |
| Радиус атома | Уменьшается | Растет |
| Энергия ионизации | Возрастает | Уменьшается |
| Сродство к электрону | Возрастает | Уменьшается |
| Восстановительные (металлические) свойства атомов | Ослабевают | Усиливаются |
| Окислительные (неметаллические) свойства атомов | Усиливаются | Ослабевают |
| Электроотрицательность | Возрастает | Уменьшается |
| Максимальная степень окисления | Возрастает | Постоянная |
| Кислотные свойства оксидов | Усиливаются | Ослабевают |
| Кислотные свойства гидроксидов | Усиливаются | Ослабевают |
| Кислотные свойства водородных соединений | Усиливаются | Усиливаются |
| Металлические свойства простых веществ | Ослабевают | Усиливаются |
| Неметаллические свойства простых веществ | Усиливаются | Ослабевают |
Пример 3.3.
Укажите формулу оксида с наиболее выраженными кислотными свойствами:
1) Br2O7;
2) SiO2;
3) Al2O3;
4) Cl2O7.
Решение. Кислотные свойства оксидов усиливаются слева направо по периоду, а сверху вниз по группе А ослабевают. С учетом этого приходим к выводу, что кислотные свойства наиболее выражены у оксида Cl2O7.
Ответ: 4).
Пример 3.4. Анион элемента Э2− имеет электронную конфигурацию атома аргона. Укажите формулу высшего оксида атома элемента:
1) ЭО3;
2) Э2О7;
3) Э2О5;
4) ЭО2.
Решение. Электронная конфигурация атома аргона 1s
22s
22p
63s
23p
6, следовательно электронная конфигурация атома Э (атом Э содержит на 2 электрона меньше, чем ион Э2−) – 1s
22s
22p
63s
23p
4, что отвечает атому серы. Элемент сера находится в VIA-группе, формула высшего оксида элементов этой группы ЭО3.
Ответ: 1).
Пример 3.5. Укажите символ элемента, атом которого имеет три электронных слоя и образует летучее (н.у.) соединение состава ЭН2(H2Э):
1) P;
2) Mg;
3) S;
4) Cl.
Решение. Водородные соединения состава ЭН2(H2Э) образуют атомы элементов IIA- и VIA-групп, однако летучими при н.у. являются соединения элементов VIA-группы, к числу которых относится сера.
Ответ: 3).
Охарактеризованные тенденции в изменении кислотно-основных свойств оксидов и гидроксидов можно понять на основании анализа следующих упрощенных схем строения оксидов и гидроксидов (рис. 3.1).
Из упрощенной схемы реакции
следует, что эффективность взаимодействия оксида с водой с образованием основания возрастает (согласно закону Кулона) с увеличением заряда на ионе Эn
+. Величина же этого заряда увеличивается по мере усиления металлических свойств элементов, т.е. справа налево по периоду и сверху вниз по группе. Именно в таком порядке увеличиваются и основные свойства элементов.
Рис. 3.1. Схема строения оксидов (а) и гидроксидов (б)
Рассмотрим причины, лежащие в основе описанных изменений кислотно-основных свойств гидроксидов.
При возрастании степени окисления элемента +n и уменьшении радиуса иона Эn
+ (это как раз и наблюдается с ростом заряда ядра атома элемента слева направо по периоду) связь Э–О упрочняется, а связь О–Н ослабевает; более вероятным становится процесс диссоциации гидроксида по кислотному типу.
Сверху вниз по группе радиус Эn
+ возрастает, а значение n+ не изменяется, в результате прочность связи Э–О уменьшается, облегчается ее разрыв и более вероятным становится процесс диссоциации гидроксида по основному типу.