Водный раствор какого соединения проявляет кислотные свойства
Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами. [c.139]
Для метафосфорной кислоты и ее солей — метафосфатов — наиболее характерным свойством является способность образовывать полимерные молекулы типа (НРОз) , в виде которых она обычно и существует в водном растворе. Кислотные свойства полимеров метафосфорной кислоты выражены довольно сильно. Например, последние константы диссоциации Н3Р3О9 и H4P4O12 равны соответственно /Сз = 9-10 и Л 4 = 2-10 . Благодаря тому, что метафосфорная кислота имеет в водном растворе полимерное строение, она обладает способностью свертывать белок, что служит одним из аналитических приемов ее открытия. [c.183]
Такие вещества могут проявлять в водных растворах кислотные свойства в зависимости от легкости отщепления протона от атома кислорода. Как правило, чем сильнее атом V притягивает электронную пару, которую он обобществляет с атомом кислорода, тем более полярна связь О—Н и более кислотными свойствами обладает вещество. В трех приведенных выше примерах центральный атом не сильно притягивает электронную пару, которую он обобществляет с атомом кислорода. Константа КИСЛОТНОСТИ ДЛЯ ортоборной кислоты имеет значение 6,5 -10 , для иодноватистой кислоты 2,3 10 а метиловый спирт в воде не обнаруживает ни кислотных, ни основных свойств. [c.97]
Зависимость дифференцирующих свойств растворителей от их кислотно-основных свойств, в протогенных растворителях происходит дифференцирование кислот вследствие того, что большое количество веществ, проявляющих в водных растворах кислотные свойства, в прото генных растворителях их не проявляют. [c.407]
Изучая влияние растворителей на силу кислот. А, Ганч установил, что в растворах кислотные свойства проявляю» не самой кислотой, а сольватированными катионами водорода. [c.401]
Гантч первый показал, что в водных растворах кислотные свойства проявляются не самой кислотой, а теми ионами, которые образовались в результате присоединения протона к молекулам воды. Вода является хорошим акцептором протонов, поэтому в водных растворах большинство минеральных кислот становится сильными кислотами, так как равновесие при этом сдвигается в сторону образования ониевых солей. Равновесие между уксусной кислотой и водой уже не сдвинуто в сторону образования [c.298]
В среде жидкого аммиака значительно усиливаются (по сравнению с водными растворами) кислотные свойства солей аммония. Поэтому в жидком аммиаке нитрат аммония легко реагирует, например, с магнием или с пероксидом натрия [c.23]
Зависимость дифференцирующего действия растворителей от их кислотно-основных свойств, в протогенных растворителях происходит дифференцирование силы кислот вследствие того, что большое число веществ, проявляющих в водных растворах кислотные свойства, в протогенных растворителях их не проявляют. В протофильных растворителях то же происходит с основаниями. [c.173]
Ответ. Сущность реакции нейтрализации с точки зрения теории электролитической диссоциации состоит в том, что одновалентные положительно заряженные ионы водорода, которые придают растворам кислотные свойства, и одновалентные отрицательно заряженные гидроксильные ионы, придающие растворам щелочные свойства, взаимно нейтрализуют друг друга и образуют нейтральную мало диссоциирующую молекулу воды. [c.42]
Для оксидов и гидроксидов с ростом степени окисления закономерно растут в водных растворах кислотные свойства от практически [c.460]
Все оксалатные соединения уранила обладают в водном растворе кислотными свойствами, которые уменьшаются в ряду [c.362]
Гидропероксидный анион в водном растворе кислотных свойств не обнаруживает. Соли Н2О2 называют пероксидами, а кислые — гидропероксидами. Пероксиды состава М2О2 образуют все щелочные элементы, а состава МО2 — щелочно-земельные, цинк и кадмий (М — соответствующий элемент). Кристаллические пероксиды содержат о5 -ионы с длиной О-связи О—О, равной 149 пм. [c.301]
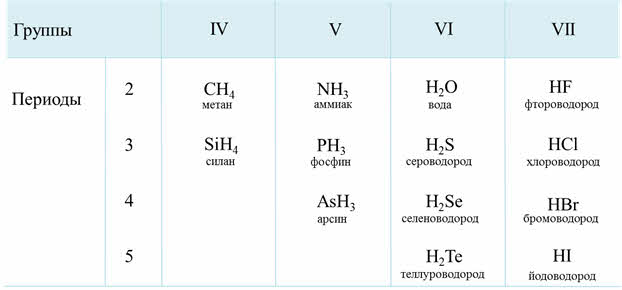
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
Так, углероду соответствует водородное соединение – метан, кремнию – силан, азоту – аммиак, фосфору – фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород, тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород, йоду – йодоводород.
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: выполните в тетрадь один из предложенных вариантов.
Вариант № 1.
Метан и силен.
Цель: Рассмотрите строение метана и силана, особенности их свойств.
Порядок действий:
1. Строение молекулы метана.
а) определите тип химической связи, изобразите механизм образования химической связи в молекуле метана;
б) составьте электронную и структурную формулы метана;
в) охарактеризуйте пространственное строение метана;
г) исчерпаны ли валентные возможности атома углерода в молекуле метана;
д) метан (н.у.) устойчив на воздухе, а силан воспламеняется. Почему?
2. Химические свойства метана.
а) отношение к воде;
б) взаимодействие с галогенами, азотной и серной кислотами. Составьте УХР этих взаимодействий.
в) отношение к нагреванию без доступа кислорода воздуха. Составьте УХР разложения метана.
г) взаимодействие СН4 и SiH4 с кислородом. Составьте УХР горения метана и силана. Чем отличаются реакции взаимодействия с кислородом метана и силена?
Вариант № 2.
Аммиак и фосфин.
Цель: Изучить строение и свойства водородных соединений азота и фосфора.
Порядок действий:
1. Строение молекул аммиака и фосфина.
а) определите тип химической связи в молекулах NH3 и PH3. Какой тип кристаллической решетки имеют вещества?
б) опишите физические свойства этих соединений.
в) составьте электронную формулу аммиака, охарактеризуйте пространственное строение аммиака.
2. Химические свойства аммиака.
а) отношение аммиака к воде и кислотам. Составьте УХР этих взаимодействий.
б) окислительно – восстановительные свойства аммиака. Составьте УХР следующих взаимодействий:
— взаимодействие с кислородом при различных условиях;
— взаимодействие с оксидом меди (II);
— хлор и бром энергично окисляют аммиак до азота.
Чем в этих ОВР выступает аммиак?
Вывод обоснуйте.
Демонстрация: Получение аммиака и растворение его в воде.
Вариант№ 3.
Вода.
Цель: Изучить строение молекулы воды и ее свойства.
Порядок действий:
1. Строение воды
а) Составьте электронную и структурную формулы молекулы воды;
б) Каково пространственное строение молекулы воды?
в) Исчерпаны ли валентные возможности воды?
г) Физические свойства воды.
2. Химические свойства воды.
а) отношение воды к неорганическим веществам:
— металлам;
— неметаллам;
— кислотным и основным оксидам;
— солям.
Составить возможные УХР.
б) отношение к органическим веществам:
— непредельным углеводородам;
— сложным эфирам (жирам);
— углеводам;
— белкам.
Составьте возможные УХР.
в) окислительно-восстановительные свойства воды:
— взаимодействие воды с натрием, углем.
Вариант № 4.
Сероводород.
Цель: Изучить строение и свойства сероводорода.
Порядок действий:
1. Строение молекулы сероводорода:
а) Составьте электронную и структурную формулы молекулы H2S
б) Особенности пространственного строения молекулы сероводорода.
2. Физические и химические свойства сероводорода:
а) особенности физических свойств;
б) химические свойства:
— кислотно-основные (приведите примеры УХР, где сероводород проявляет кислотные свойства);
— окислительно-восстановительные свойства.
Составить УХР горения H2S в кислороде. Закончите УХР взаимодействия сероводорода с раствором перманганата калия в кислой среде (уравнять методом полуреакций).
Вариант № 5.
Галогеноводороды.
Цель: Рассмотреть строение и свойства галогеноводородов.
Порядок действий:
1. На примере хлороводорода рассмотрите электронное строение молекулы. Изобразите электронную и структурную формулы молекулы хлороводорода.
2. Как изменяется сила кислот в ряду HF-HCl-HBr-HI? Почему?
3. Химические свойства галогеноводородов на примере HCl.
— Какими свойствами обладают водные растворы галогеноводородов? Приведите примеры кислотно-основных свойств . Составьте возможные УХР.
— охарактеризуйте отношение водородных соединений галогенов к органическим веществам:
а) алкенам;
б) алкинам;
в) аминам;
г) аминокислотам.
Составьте возможные УХР взаимодействия HCl с органическими веществами.
Домашнюю работу высылать не нужно, просмотрю в школе
Немного теории
Кислоты
Кислоты ― это сложные
вещества, образованные атомами водорода, способными замещаться на атомы металла и кислотными остатками.
Кислоты — это электролиты, при диссоциации
которых образуются только катионы водорода и анионы кислотных остатков.
Классификация кислот
Классификация кислот по составу
Кислородсодержащие кислоты | Бескислородные кислоты |
H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода
К И С Л О Т Ы | ||
Одноосновные | Двухосновные | Трехосновные |
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Классификация кислот на сильные и слабые кислоты.
Сильные кислоты | Слабые кислоты |
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная | HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
Химические свойства кислот
- Взаимодействие с основными оксидами с образованием соли и воды:
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
- Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
- Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
- Кислоты диссоциируют с образованием катиона водорода, что приводит к изменению окраски индикаторов:
— лакмус становится красным
— метилоранж становится красным.
1. водород+неметалл
H2+ S → H2S
2. кислотный оксид+вода
P2O5
+ 3H2O→2H3PO4
Исключение:
2NO2
+ H2O→HNO2 + HNO3
SiO2 + H2O —не реагирует
3. кислота+соль
В продукте реакции должен
образовываться осадок, газ или вода. Обычно более сильные кислоты вытесняют
менее сильные кислоты из солей. Если соль нерастворима в воде, то она реагирует
с кислотой, если образуется газ.
Na2CO3
+ 2HCl→2NaCl + H2O + CO2↑
K2SiO3
+ H2SO4→K2SO4 + H2SiO3↓
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
1. По растворимости в воде.
Растворимые основания
(щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания
: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
2. По количеству гидроксильных групп в молекуле.
— Однокислотные (гидроксид натрия NaOH)
— Двукислотные (гидроксид меди(II) Cu(OH)2)
— Трехкислотные (гидроксид железа(III) In(OH)3)
3. По летучести.
— Летучие: NH3
— Нелетучие: щёлочи, нерастворимые основания.
4. По стабильности.
— Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
— Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака).
5. По степени электролитической диссоциации.
— Сильные (α > 30 %): щёлочи.
— Слабые (α < 3 %): нерастворимые основания.
- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
- Также основание можно получить при взаимодействия щелочного или щелочноземельного металла с водой.
- Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
- Некоторые основания можно получить обменными реакциями:
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
это изменение проявляется в цветах некоторых
кислотно-основных индикаторов:
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии.
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
Примечание:
реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Растворимые основания могут реагировать с амфотерными гидроксидами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Растворимые снования вступают в обменные реакции с растворимыми солями:
Нерастворимые основания при нагреве разлагаются:
Обновлено: 23 августа 2017, 20:12
Мумие не миф…и реально помогает !
О ПРИМЕНЕНИИ
Лечение мумие давно признано действенной методикой по укреплению иммунитета. Хорошо зарекомендовал и в борьбе с аллергией, гайморитом, ангиной и болями в горле. А не так давно официально был доказан факт, что мумие в качестве медицинского препарата может служить общеукрепляющим средством, успешно заменяя собой поливитамины.
Это комплекс биологически активных веществ, созданный природой. Сочетание органических и минеральных соединений, входящих в состав, придает ему разнообразные целебные свойства. Все вещества в его составе находятся в легкоусваиваемой форме и безвредны для человека любого…
Читать далее →
Экология и бытовая химия
Как выбрать стиральный порошок – практические советы
Как выбрать стиральный порошок – практические советы
Это вопрос еще можно задать по-другому: на что необходимо обратить внимание при выборе стирального порошка. Мы предлагаем наше видение.
Качество стирального порошка. Или другими словами, какая его реальная моющая способность. Согласно государственным стандартам Украины моющая способность стирального порошка (это обязательный показатель при проведении анализов в лабораторных условиях) не должна быть ниже 85 % от эталона. Кстати за эталон берется 100%, но порошок может стирать лучше эталона…
Читать далее →
Корейская косметика: уход за лицом и телом!
Добрый день! Меня зовут Юлия, предлагаю Вашему вниманию косметику из Кореи: средства для ухода за лицом и телом, декоративная косметика и аксессуары!
Вся косметика приходит напрямую из Кореи и является оригинальной. Косметика доставляется из Кореи почтовой службой ЕМС, ориентировочно 2-3 недели.
Срок годности товара составляет в среднем 3 года с даты производства. После вскрытия упаковки и начала использования срок годности 1 год.
Вопросы по косметике задавайте пожалуйста в комментариях к посту.
ПОДАРКИ к каждому заказу!!!
Собираю заказы!!!
Весь ассортимент и…
Читать далее →
О лекарствах и витаминах
Хорошая статья, может кому-то будет интересно. Я безумно рада за своего сына, потому что он пока не знает, что такое «лежать в больнице», антибиотики, прививки и пр. лекарства и пилюли. Мы даже температуру не сбиваем, лечимся лечились раньше гомеопатией (когда в сад ходили 2 мес), теперь в сад не ходим и, слава богу, не болеем, чего и вам желаем)
Дальше очень много текста…..
Читать далее →
Все , что мы должны знать о своих анализах.
Анализы крови
Это самая большая группа исследований, которые проводятся в лабораториях. И самые часто назначаемые анализы. Конечно, нет смысла описывать их все, но знать нормы самых распространенных показателей крови полезно.
Совет: иногда бывает так, что какой-либо показатель в анализе совершенно неожиданно для вас оказывается не в норме. Конечно, это вызывает волнение, иногда очень сильно выбивает из колеи. Так вот: первым делом надо успокоиться, а вторым — сдать анализ еще раз и желательно в другой лаборатории. Всякое бывает: и в…
Читать далее →
