В каком соединении марганец проявляет только окислительные свойства

Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 —
амфотерные, +6, +7 — кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца II
Для соединений марганца II характерны основные свойства. Оксид марганца II может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца IV до оксида марганца II.
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца II.
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца II на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца IV.
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца II проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца II получается при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца IV проявляют амфотерный характер. Оксид марганца IV можно получить разложением нитрата марганца II.
Mn(NO3)2 = (t) MnO2 + NO2 + O2

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца VI — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца VII — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют
кислотные свойства. Соли марганцовой кислоты — перманганаты.
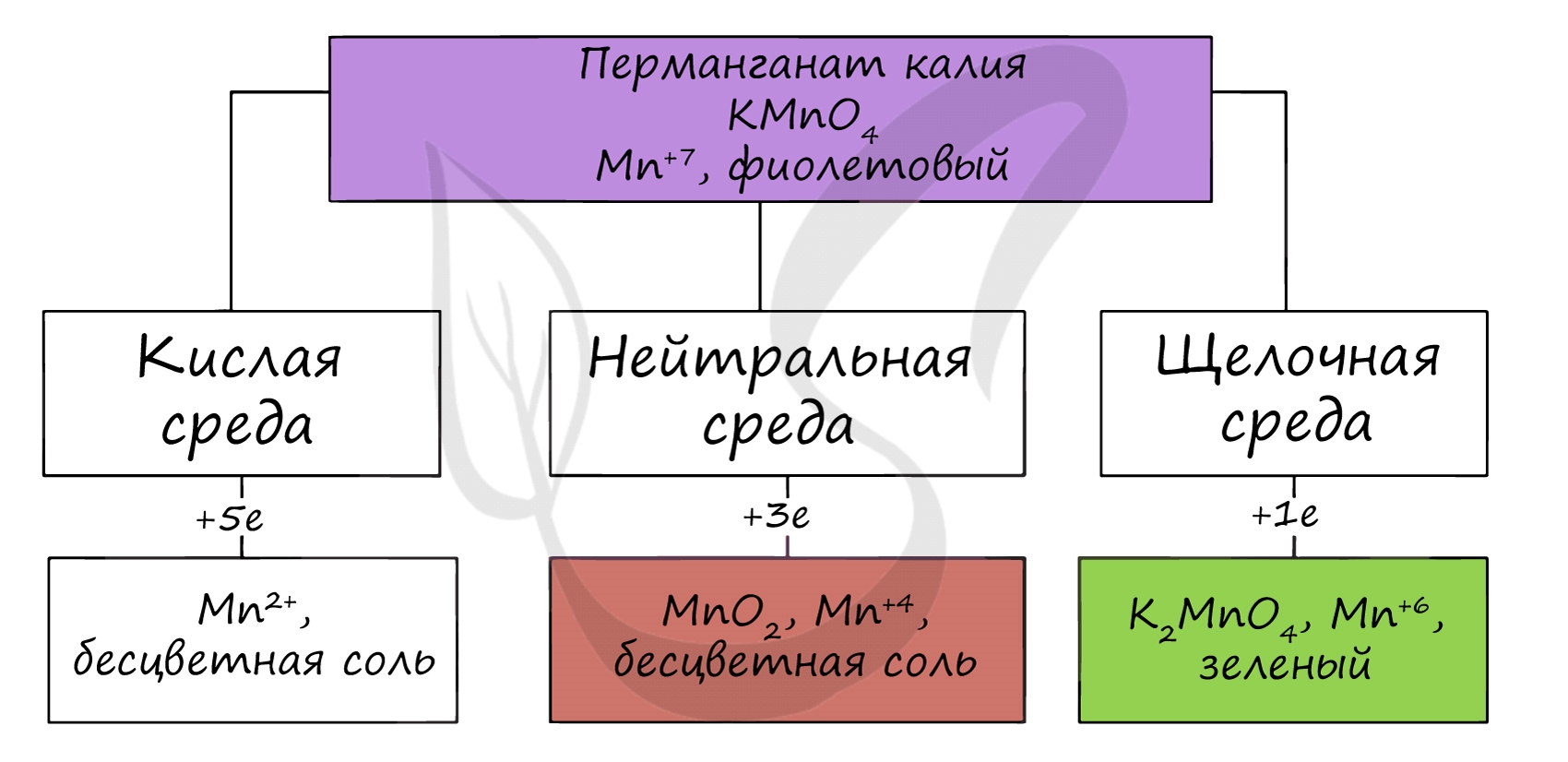
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца VII получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4
При растворении оксида марганца VII (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца II.
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав
меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком 🙂
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка II
Эти соединения обладают амфотерными свойствами. Оксид цинка II можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка II проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка II может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка II получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка II обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Марганец в своих соединениях имеет разную степень окисления (от +II до +VII), поэтому соединения марганца обладают окислительно-восстановительными свойствами. Те соединения или ионы, в которых марганец имеет низшую степень окисления, будут обладать свойствами восстановителя, а сами будут окисляться. Те соединения в которых марганец имеет высшую степень окисления, будут окислителями, т.е. сами будут восстанавливаться до соединений или ионов с низшей степенью окисления. Соединения или ионы, в которых марганец имеет промежуточные степени окисления (MnO2, H2MnO3, H2MnO4) будут либо восстановителями, либо окислителями – всё зависит от условий протекания реакций и веществ, с которыми они реагируют. Например:
А. MnO2 как восстановитель:
2MnO2 + 3PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2H2O;
Б. MnO2 как окислитель:
2FeSO4 + MnO2 + 2H2SO4 = Fe2SO4)3 + MnSO4 + 2H2O;
В. K2MnO4 как восстановитель:
6 K2MnO4 + KClO3 + 6HCl = 6KMnO4 + 7KCl + 3H2O;
Г. K2MnO4 как окислитель:
K2MnO4 + 2Na2SO3 + 2H2SO4 = MnSO4 + 2Na2SO4 + K2SO4 + 2H2O.
Реакции окисления-восстановления могут протекать в разных средах и в зависимости от этого может меняться характер их протекания (пример дан выше).
Комплексные соединения
Комплексные соединения Mn, Tc, Re очень разнообразны по составу и свойствам. Все три элемента обладают склонностью к образованию ацидокомплексов и карбонилов.
Все аква- и большинство ацидокомплексов Mn (II) неустойчивы и парамагнитны. Цианидный комплекс [Mn(CN)6]4- обладает относительно большой устойчивостью: за счёт сильного электростатического поля цианидных лигандов. Аммиакат MN(II) очень неустойчив. Карбонил [(CO)5 – Mn – (CO)5] представляет собой двухядерный комплекс, атомы металлов соединены σ-связью, а связи Ме – СО донорноакцепторные.
Применение и биологическая роль
Наибольшее применение находит марганец, прежде всего в металлургии при производстве стали. Соединения марганца широко используются как окислители и катализаторы в химических процессах.
Марганец является важнейшим биогенным элементом, принадлежит к числу микроэлементов. Присутствует в разных количествах в растительных и животных организмах (кровь, ткани, металлоферменты). С наличием марганца связаны многие биохимические функции: фотосинтез, процессы окисления-восстановления, синтез хлорофилла, витаминов.
ХИМИЯ ЭЛЕМЕНТОВ VI Б РУППЫ
Элементы данной группы хром Cr, молибден Мо, вольфрам W и искусственно полученный 106 элемент – сиборгий Sg.
Электронная конфигурация атомов хрома и молибдена (n – 1)d5ns1, вольфрама – 5d46s2. В атомах хрома и молибдена наблюдается «провал» электрона: один электрон с внешнего энергетического уровня переходит на d-подуровень предпоследнего уровня, но общее число валентных электронов у атомов элементов этой подгруппы равно шести.
В соответствии с электронными конфигурациями элементы VIБ подгруппы могут проявлять в своих соединениях степени окисления от +1 до +6. Для хрома наиболее устойчивы соединения, в которых он проявляет степени окисления +2, +3, +6, а для молибдена и вольфрама наиболее устойчивы соединения в которых степень окисления этих металлов +6.
Радиусы атомов увеличиваются от хрома к вольфраму, но радиусы атомов молибдена и вольфрама примерно одинаковы (лантаноидное сжатие). Поэтому хром несколько отличается по химическому поведению от молибдена и вольфрама.
Для комплексных соединений элементов VIБ подгруппы характерны координационные числа 4 и 6, у молибдена и вольфрама встречается число 8. Элементы данной группы в низших степенях окисления образуют катионные комплексы, а в высших – анионные.
Хром, молибден и вольфрам – серовато-белые блестящие металлы. На свойства этих металлов большое влияние оказывают примеси. Чистый хром недостаточно твёрд, технический загрезнённый хром самый твёрдый из всех металлов. Mo, W значительно мягче хрома, но следы примесей увеличивают их твёрдость. Все эти металлы тугоплавки, Тпл и Ткип возрастают от хрома к вольфраму. Вольфрам самый тугоплавкий из металлов (Тпл = 34100С).
С химической точки зрения Cr, Мо и W малоактивны при обычных условиях, несмотря на то, что в ряду напряжений находятся пере водородом. Они практически не подвергаются коррозии из-за образования прочной оксидной плёнки на поверхности металлов.
С повышением температуры и при удалении защитной оксидной плёнки они способны взаимодействовать со многими элементами.
С водой эти металлы при обычных условиях не реагируют, но взаимодействуют при сильном нагревании. Например:
2Cr + 3H2O = Cr2О3 + 3H2↑
В отличие от железа, которое пассивируется только концентрированной HNO3, пассивирование хрома вызывается как концентрированной, так и разбавленной HNO3, царской водкой, а также всеми другими сильными окислителями.
Со щелочами хром не реагирует.
С разбавленными серной и соляной кислотой хром взаимодействует:
Cr + H2SO4 = CrSO4 + H2↑,
Cr + 2HCl(разб.) + 4H2O = [Cr(H2O)4]Cl2 + H2↑.
При обычных условиях металлы VIBреагируют только с фтором. В порошкообразном состоянии хром реагирует с хлором с образованием CrCl3.
При нагревании хром образует с кислородом оксид Cr2O3. Косвенным путём получены оксиды хрома: CrO, CrO2, CrO3.
Оксид хрома ( III )
Cr2O3 тёмно-зеленое тугоплавкое, термически устойчивое вещество. Оксид химически пассивен, не реагирует с кислотами, щелочами в растворах. Проявляет амфотерные свойства:
при высокой температуре, при сплавлении со щелочами образует хромиты (соли хромистой кислоты НCrO2):
Cr2O3 + 2NaOН = 2NaCrO2 + H2O;
В высокодисперсном состоянии образует соли с кислотами:
Cr2O3 + 6HCl = 2CrCl3 + 3H2O.
Cr2O3 восстанавливается типичными металлами в жестких условиях, реагирует с сильными окислителями:
Cr2O3 + 3Са = 2Cr + 3CaO,
Cr2O3 + KClO3 + 2K2CO3 = 2K2CrO4 + KCl + 2CO2,
Под действием окислителей соединения хрома (III) переходят в соединения хрома (VI)
Гидроксид хрома ( III )
Оксиду хрома Cr2O3 соответствует гидроксид хрома Cr(OH)3. Это вещество серо-зелёного цвета, малорастворимое в воде. Его получают действием щелочей на соли хрома (III):
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3 + 3Na2SO4.
Гидроксид хрома Cr(OH)3 обладает амфотерными свойствами. Он взаимодействует с кислотами:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O,
А со щелочами даёт хромиты (соли хромистой кислоты):
Cr(OH)3 + NaOH = NaCrO2 + 2H2O (при сплавлении);
Cr(OH)3 + 3NaOH(р-р) = Na[Cr(OH)6] (гидроксохромит натрия) (в растворе).
Для растворённой части Cr(OH)3 имеют место следующие равновесия:
Cr3+ + 3OH ↔ Cr(OH)3 ≡ H3CrO3 ↔ HCrO2 + H2O ↔ H+ + CrO21- + H2O
Хромиты гидролизуются нацело:
KCrO2 + 2H2O = Cr(OH)3↓ + KOH.
Соединения хрома ( VI )
Оксид хрома CrO3 (хромовый ангидрид) – кристаллическое вещество тёмно-красного цвета, легко растворяется в воде с образованием хромовых кислот.
Хромовый ангидрид – сильный окислитель. Если, например, сухой CrO3 смочить этиловым спиртом, то спирт окисляется настолько энергично, что происходит самовоспламенение, CrO3 восстанавливается доCr2O3.
Хромовому ангидриду соответствуют хромовая H2CrO4 и двухромовая H2Cr2O7 кислоты. Они известны только в водных растворах и образуют хроматы (K2CrO4, CaCrO4) и дихроматы (K2Cr2O7, CaCr2O7). Хромовая кислота (К1 = 2 10-1 и К2 = 3 10-7) значительно слабее двухромовой кислоты (К2 = 2 10-2). Дихромовая кислота – представитель изополикислот общей формулы хН2О уЭО3. Растворы этих кислот очень токсичны.
Хроматы щелочных металлов подвергаются заметному гидролизу, и растворы их имеют щелочную среду. Хромат-ионы CrO42- устойчивы в нейтральной и в щелочной средах. В кислой среде (при подкислении водных растворов хроматов) происходит превращение хромат-ионов в дихромат-ионы:
2CrO42- + 2H+ ↔ Cr2O72- + H2O
В результате чего желтый раствор окрашивается в оранжевый цвет.
Под действием щелочи дихромат-ионы Cr2O72- превращаются в хромат-ионы CrO42-:
Cr2O72- + 2ОН- = 2CrO42- + H2O
(оранжевый цвет раствора переходит в желтый).
Следовательно, в кислой среде существуют только дихроматы, а в щелочной – только хроматы.
Окислительные свойства проявляют только производные хрома (VI). Хроматы и дихроматы – сильные окислители. Их широко используют для окисления различных веществ. Особенно хорошо окислительные свойства проявляются в кислой среде. Так, например, при комнатной температуре они окисляют H2S, HI, H2SO3 и их соли, а при нагревании – HBr и даже HCl. Например:
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O,
K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Последняя реакция интересна тем, что она идёт только при нагревании и поэтому удобна для получения хлора в небольших количествах в лаборатории.
В аналитической химии реакции окисления хроматом или дихроматом калия различных ионов используется для их определения (хроматометрия).
Смесь K2Cr2O7 и H2SO4 (в соотношении 1 : 1) широко используется как сильное окислительное моющее средство в лабораторной практике. Её называют «хромпик» или хромовой смесью. Смесь легко удаляет жир с поверхности стекла, окисляя его образующимся хромовым ангидридом CrO3 и смывая концентрированной серной кислотой.
