В каком объеме насыщенного раствора содержится
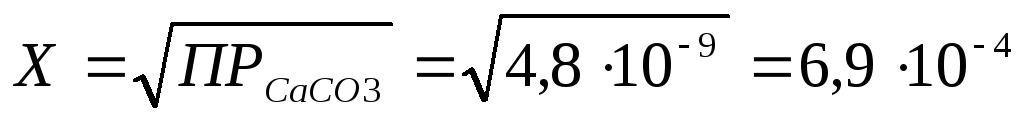
Êîíöåíòðàöèÿ ðàñòâîðà ìîæåò âûðàæàòüñÿ êàê â áåçðàçìåðíûõ åäèíèöàõ (äîëÿõ, ïðîöåíòàõ), òàê è â ðàçìåðíûõ âåëè÷èíàõ (ìàññîâûõ äîëÿõ, ìîëÿðíîñòè, òèòðàõ, ìîëüíûõ äîëÿõ).
Êîíöåíòðàöèÿ – ýòî êîëè÷åñòâåííûé ñîñòàâ ðàñòâîðåííîãî âåùåñòâà (â êîíêðåòíûõ åäèíèöàõ) â åäèíèöå îáúåìà èëè ìàññû. Îáîçíà÷èëè ðàñòâîðåííîå âåùåñòâî — Õ, à ðàñòâîðèòåëü — S. ×àùå âñåãî èñïîëüçóþ ïîíÿòèå ìîëÿðíîñòè (ìîëÿðíàÿ êîíöåíòðàöèÿ) è ìîëüíîé äîëè.
Ñïîñîáû âûðàæåíèÿ êîíöåíòðàöèè ðàñòâîðîâ.
1. Ìàññîâàÿ äîëÿ (èëè ïðîöåíòíàÿ êîíöåíòðàöèÿ âåùåñòâà) – ýòî îòíîøåíèå ìàññû ðàñòâîðåííîãî âåùåñòâà m ê îáùåé ìàññå ðàñòâîðà. Äëÿ áèíàðíîãî ðàñòâîðà, ñîñòîÿùåãî èç ðàñòâîð¸ííîãî âåùåñòâà è ðàñòâîðèòåëÿ:
 ,
,
ãäå:
ω – ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà;
mâ-âà – ìàññà ðàñòâîð¸ííîãî âåùåñòâà;
mð-ðà – ìàññà ðàñòâîðèòåëÿ.
Ìàññîâóþ äîëþ âûðàæàþò â äîëÿõ îò åäèíèöû èëè â ïðîöåíòàõ.
2. Ìîëÿðíàÿ êîíöåíòðàöèÿ èëè ìîëÿðíîñòü – ýòî êîëè÷åñòâî ìîëåé ðàñòâîð¸ííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà V:
 ,
,
ãäå:
C – ìîëÿðíàÿ êîíöåíòðàöèÿ ðàñòâîð¸ííîãî âåùåñòâà, ìîëü/ë (âîçìîæíî òàêæå îáîçíà÷åíèå Ì, íàïðèìåð, 0,2 Ì HCl);
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
V – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîð íàçûâàþò ìîëÿðíûì èëè îäíîìîëÿðíûì, åñëè â 1 ëèòðå ðàñòâîðà ðàñòâîðåíî 1 ìîëü âåùåñòâà, äåöèìîëÿðíûì – ðàñòâîðåíî 0,1 ìîëÿ âåùåñòâà, ñàíòèìîëÿðíûì – ðàñòâîðåíî 0,01 ìîëÿ âåùåñòâà, ìèëëèìîëÿðíûì – ðàñòâîðåíî 0,001 ìîëÿ âåùåñòâà.
3. Ìîëÿëüíàÿ êîíöåíòðàöèÿ (ìîëÿëüíîñòü) ðàñòâîðà Ñ(x) ïîêàçûâàåò êîëè÷åñòâî ìîëåé n ðàñòâîðåííîãî âåùåñòâà â 1 êã ðàñòâîðèòåëÿ m:
 ,
,
ãäå:
Ñ (x) – ìîëÿëüíîñòü, ìîëü/êã;
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
mð-ëÿ – ìàññà ðàñòâîðèòåëÿ, êã.
4. Òèòð – ñîäåðæàíèå âåùåñòâà â ãðàììàõ â 1 ìë ðàñòâîðà:
 ,
,
ãäå:
T – òèòð ðàñòâîð¸ííîãî âåùåñòâà, ã/ìë;
mâ-âà – ìàññà ðàñòâîðåííîãî âåùåñòâà, ã;
Vð-ðà – îáú¸ì ðàñòâîðà, ìë.
5. Ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà – áåçðàçìåðíàÿ âåëè÷èíà, ðàâíàÿ îòíîøåíèþ êîëè÷åñòâà ðàñòâîðåííîãî âåùåñòâà n ê îáùåìó êîëè÷åñòâó âåùåñòâ â ðàñòâîðå:
 ,
,
ãäå:
N – ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà;
n – êîëè÷åñòâî ðàñòâîð¸ííîãî âåùåñòâà, ìîëü;
nð-ëÿ – êîëè÷åñòâî âåùåñòâà ðàñòâîðèòåëÿ, ìîëü.
Ñóììà ìîëüíûõ äîëåé äîëæíà ðàâíÿòüñÿ 1:
N(X) + N(S) = 1.
ãäå N(X) — ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà Õ;
N(S) — ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà S.
Èíîãäà ïðè ðåøåíèè çàäà÷ íåîáõîäèìî ïåðåõîäèòü îò îäíèõ åäèíèö âûðàæåíèÿ ê äðóãèì:

ω(X) — ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà, â %;
Ì(Õ) – ìîëÿðíàÿ ìàññà ðàñòâîðåííîãî âåùåñòâà;
ρ= m/(1000V) – ïëîòíîñòü ðàñòâîðà.6. Íîðìàëüíàÿ êîíöåíòðàöèÿ ðàñòâîðîâ (íîðìàëüíîñòü èëè ìîëÿðíàÿ êîíöåíòðàöèÿ ýêâèâàëåíòà) – ÷èñëî ãðàìì-ýêâèâàëåíòîâ äàííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà.
Ãðàìì-ýêâèâàëåíò âåùåñòâà – êîëè÷åñòâî ãðàììîâ âåùåñòâà, ÷èñëåííî ðàâíîå åãî ýêâèâàëåíòó.
Ýêâèâàëåíò – ýòî óñëîâíàÿ åäèíèöà, ðàâíîöåííàÿ îäíîìó èîíó âîäîðîäà â êèñëîòîíî-îñíîâíûõ ðåàêöèÿõ èëè îäíîìó ýëåêòðîíó â îêèñëèòåëüíî – âîññòàíîâèòåëüíûõ ðåàêöèÿõ.
Äëÿ çàïèñè êîíöåíòðàöèè òàêèõ ðàñòâîðîâ èñïîëüçóþò ñîêðàùåíèÿ í èëè N. Íàïðèìåð, ðàñòâîð, ñîäåðæàùèé 0,1 ìîëü-ýêâ/ë, íàçûâàþò äåöèíîðìàëüíûì è çàïèñûâàþò êàê 0,1 í.
 ,
,
ãäå:
ÑÍ – íîðìàëüíàÿ êîíöåíòðàöèÿ, ìîëü-ýêâ/ë;
z – ÷èñëî ýêâèâàëåíòíîñòè;
Vð-ðà – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîðèìîñòü âåùåñòâà S — ìàêñèìàëüíàÿ ìàññà âåùåñòâà, êîòîðàÿ ìîæåò ðàñòâîðèòüñÿ â 100 ã ðàñòâîðèòåëÿ:

Êîýôôèöèåíò ðàñòâîðèìîñòè – îòíîøåíèå ìàññû âåùåñòâà, îáðàçóþùåãî íàñûùåííûé ðàñòâîð ïðè êîíêðåòíîé òåìïåðàòóðå, ê ìàññå ðàñòâîðèòåëÿ:

Задача 1. Рассчитайте ионную силу растворов RbNO3, CuCl2 и Na3PO4, если их молярные концентрации равны 0,1 моль/дм3.
Решение.1 В растворе нитрата рубидия:
2 Для раствора CuCl2:
3 Ионы Na+ и РО4–3 создают ионную силу:
.
Задача 2. Рассчитайте активности ионов K+ и SO42– в растворе сульфата калия с молярной концентрацией С(K2SO4) = 0,1 моль/дм3.
Решение:ионная сила тринарного электролита K2SO4 – m = 0,3.
Рассчитаем f(K+ ) и f(SO42–) по (6.1.6):
Итак, в растворе сульфата калия с молярной концентрацией С(K2SO4) = 0,1 моль/дм3 активности ионов составят:
а(K+ ) = С(K+ ) ∙ f(K+ ) = 0,20.0,75 = 0,15;
a(SO42–) = С(SO42–) ∙ f(SO42–) = 0,1.0,32 = 0,032.
Задача 3. Рассчитайте средний коэффициент активности для водного раствора гидроксида натрия с молярной концентрацией С(NaOH) = 0,1 моль/дм3 и сравните его с экспериментально найденной величиной 0,764.
Решение: ионная сила бинарного NaOH – m = 0,1.
По формуле Дебая – Хюккеля (6.1.5) находим f±:
–
Как видно, в данном случае рассчитанное и экспериментально найденное значения среднего коэффициента активности близки, разница составляет 0,8 %.
По уравнению Дэвиса (6.1.7):
Задача 4. Вычислите произведение растворимости Fe(OH)2, если в 100 см3 его насыщенного раствора содержится 9,6∙10–5 г этого гидроксида.
Решение: протолиз гидроксида: Fe(OH)2 ↔ Fe2+ + 2OH– – из одного моль Fe(OH)2 образуется один моль ионов Fe2+ и два моль ионов OH–. Таким образом, в 1 дм3 насыщенного раствора гидроксида железа (+2) будет содержаться:
1) n(Fe(OH)2) =
так как
n(Fe(OH)2) = n(Fe2+) = 2n(OH–), то С(Fe2+) = 1,07∙10–5 моль/дм3
и
С(OH–) = 2∙1,07∙10–5 = 2,14∙10–5 моль/дм3;
2) ПР(Fe(OH)2) = [Fe2+][ OH–]2 =1,07∙10–5∙ (2,14∙10–5)2 = 4,9∙10–15.
Ответ: ПР(Fe(OH)2) = 4,9∙10–15.
Задача 5. Произведение растворимости Ag2CO3 составляет 8∙10–12. Рассчитать растворимость карбоната серебра в моль/дм3 и г/дм3.
Решение: 1) запишем выражение произведения растворимости для карбоната серебра – ПР(Ag2CO3) = [Ag+]2[CO32–] = 8∙10–12;
2) используем формулы (6.1.12) и (6.1.13)
Задача 6. В каком объёме насыщенного раствора Ag3PO4 содержится один грамм этой соли (ПР(Ag3PO4) = 1,3∙10–20)?
Решение: 1) вычислим растворимость ортофосфата серебра в г/дм3 по формуле (6.1.13)
2) вычисляем объём насыщенного раствора, который будет содержать один грамм соли Ag3PO4 из соотношения
Задача 7. В 10 дм3 насыщенного раствора СаСО3 содержится 0,0278г ионов кальция. Вычислить произведение растворимости карбоната кальция.
Решение:1) запишем выражение для произведения растворимости этой соли
ПР(СаСО3) = [Са2+][СО32–];
где концентрации ионов Са2+ и СО32– выражены в моль/дм3;
2) из выражения ПР(СаСО3) следует, что при протолизе одного моль СаСО3 образуется по одному моль ионов Са2+ и СО32–, т.е.
n(СаСО3) = n(Са2+)= n(СО32–) моль;
3) вычислим концентрации ионов Са2+ и СО32– (в моль/дм3) по формуле:
4) ПР(СаСО3) = [Са2+][СО32–] = 6,95∙10–5∙6,95∙10–5 = 4,8∙10–9.
Задача 8. Образуется ли осадок AgBr (ПР = 6,0∙10–13), если слить равные объёмы растворов AgNO3 и KBr с концентрациями С(AgNO3) = С(KBr) = 0,001 моль/дм3?
Решение: 1) условием выпадения осадка бромида серебра является выполнение соотношения – ПКи[Ag+][Br–] > ПР(AgBr);
2) концентрации Ag+ и Br–, с учетом разбавления, составят
[Ag+] = [Br–] = 0,001/2 = 5,0∙10–4 моль/дм3;
3) вычисляем произведение концентраций ионов и сравниваем его значение с ПР(AgBr)
ПКи[Ag+][Br–] = 5,0∙10–4 ∙5,0∙10–4 = 2,5∙10–7 >> ПР(AgBr) = 6,0∙10–13.
Вывод: осадок AgBr выпадет.
Задача 9. Вычислить растворимость CaF2 (в моль/дм3) в воде и в растворе CaCl2 c концентрацией С(CaCl2) = 0,05 моль/дм3 (ПР(CaF2) = 4∙10–11). Во сколько раз растворимость во втором случае меньше, чем в первом? Расчеты провести с учетом и без учета ионной силы раствора.
Решение. А. Расчет без учета ионной силы раствора.
1 В этом случае учитывается только протолиз фторида кальция:
CaF2 ↔ Са2+ + 2F–. При этом – S(CaF2) = [Са2+] = 1/2[F–]. Поэтому растворимость CaF2 в воде ведём по формуле (6.1.12)
2 Растворимость CaF2 в воде, но с учетом избытка одноимённого иона Са2+.
Ионные равновесия в данном растворе:
а) CaF2 ↔ Са2+ + 2F–; б) CaCl2 ↔ Са2+ + 2Cl– (100%). Протолиз по (а) протекает весьма незначительно и даёт концентрацию [Са2+]1; полный протолиз CaCl2 даёт концентрацию [Са2+]2 = С(CaCl2) = 0,05 моль/дм3. В итоге, суммарная концентрация ионов кальция в растворе составит:
[Са2+]S = [Са2+]1 + [Са2+]2 ≈ [Са2+]2 ≈ 0,05 моль/дм3.
Тогда равновесная концентрация ионов фтора будет равна:
ПР(CaF2) =[ Са2+][ F–]2 =0,05∙(2S(CaF2))2;
3 Из уравнения протолиза фторида (CaF2 ↔ Са2+ + 2F–) следует, что растворимость этой соли будет определяться из соотношения:
S(CaF2) = 1/2[F–] = 1/2∙1,4∙10–5 = 7,0∙10–6 моль/дм3.
4 Растворимость CaF2 в присутствии избытка CaCl2 меньше его растворимости в чистой воде в 2∙10–4 /7,0∙10–6 ≈ 28,6 раз.
Б. Расчет с учетом ионной силы раствора.
1 Ионную силу раствора будут, в основном, определять ионы Са2+ и Cl–, образующиеся при протолизе хлорида кальция. Учитывая, что CaCl2 тринарный электролит, то ионная сила данного раствора составит 3С(CaCl2), т.е. I = 3∙0,05 = 0,15. Из таблицы 6.1 находим: f(Са2+) = 0,42; f(Cl–) = 0,81. Тогда произведение растворимости фторида кальция будет определяться соотношением:
ПР(CaF2) = f(Са2+) f2(Cl–) [ Са2+][ F–]2.
2 Растворимость CaF2 в воде с учетом ионной силы раствора:
Растворимость CaF2 в воде с учетом ионной силы раствора увеличилась по сравнению с его растворимостью в чистой воде в:
3,3∙10–4/2∙10–4 = 1,65 раза.
3 Растворимость CaF2 с учетом ионной силы раствора и избытка одноимённого иона Са2+.
Равновесная концентрация ионов фтора:
ПР(CaF2) = f(Са2+)∙ f2(F–) ∙ [ Са2+][ F–]2, откуда
Растворимость CaF2 при этом составит:
S(CaF2) = 1/2[F–] = 1/2∙2,7∙10–5 ≈ 1,35∙10–5 моль/дм3.
4 Растворимость CaF2, в присутствии избытка CaCl2 и с учетом ионной силы раствора, меньше его растворимости в чистой воде в 2∙10–4 /1,35∙10–5 ≈ 14,8 раза.
10
По
общей неорганической химии
1.Химия s-элементов
Задача
1.1.Напишите
уравнения следующих реакций
KO2 | Mg |
Na2O2 | Be |
LiNO3 | Be |
Ca(HCO3)2 | Гидролиз BaS |
Mg(NO3)2 | BaSO4 |
Решение
1)
4 KO2
+ 2
H2O
4КОН + 3О2↑
2)
2Na2O2
+2
CO2
2Na2CO3
+ O2↑
3)
Термическое
разложение нитрита лития:
4
LiNO3
2Li2O
+4 NO2
+ O2↑
4)
Ca(HCO3)2
+ Са(ОН)2
2 СаСО3
+ 2Н2О
+ 2 СО2↑
5)
Водные растворы солей нитрата магния
и карбоната калия реагируют по уравнению:
Mg(NO3)2
+ K2CO3
→ 2KNO3
+ MgCO3↓
6)
С разбавленной азотной кислотой магний
реагирует по уравнению:
4
Mg + 10HNO3
→ 4 Mg(NO3)2
+ NO2↑
+ 5 H2O
7)
Сплавление бериллия с гидроксидом калия
протекает по уравнению:
Be
+ 2 KOH
→ K2BeO2
+ H2↑
8)
Be + 2 NaOH + 2 H2O
→ Na2[Be(OH)4]
+ H2↑
9)
Гидролиз сульфита бария. Сульфит бария
соль, образованная сильным основанием
и слабой кислотой. В воде диссоциирует
на ионы:
ВаS
↔ Ва2+
+ S2-
Гидролиз
по аниону. Т.к. заряд сульфид-иона (S2-),
гидролиз пойдет в 2 ступени (стадии).
I
ступень.
S2-
+ HOH → HS-
+ OH-
(т.к. в растворе накапливаются
гидроксид-ионы, среда – щелочная)
Ba2+
+ S2-
+ HOH→ HS-
+ OH-
+ Ba2+
2BaS
+ 2H2O
→ Ba(HS)2
+ Ba(OH)2
II ступень
HS-+
HOH
→ H2S
+ OH-
(среда – щелочная)
Ba2+
+ HS-+
HOH → H2S
+ OH-
+ Ba2+
Общее уравнение
гидролиза:
BaS
+ 2H2O
→ 2H2S↑
+ Ba(OH)2
10) Сплавление
сульфата бария с углеродом протекает
по уравнению:
BaSO4
+ 2C
ВаS
+ 2СО2↑
Задача
1.2. Напишите
уравнения реакций, с помощью которых
можно осуществить следующие превращения:
а)
K
KOH
KCl
K2SO4
KNO3
KNO2
б)
NaNO3
NaCl
NaOH
NaHCO3
Na2CO3
в)
Be
….Be(OH)2
BeO
BeSO4
Be2(OH)2CO3
Решение:
а)
K
KOH
KCl
K2SO4
KNO3
KNO2
2H2O
+ 2K
→ 2KOH
+ H2
КОН
+ НCl→
КCl
+Н2О
2KCl
+ H2SO4
→
K2SO4
+ 2HCl
K2SO4
+ 2 HNO3
→ 2KNO3
+ H2SO4
2KNO3
→ 2KNO2
+ О2
б)
NaNO3
NaCl
NaOH
NaHCO3
Na2CO3
NaNO3
+ HCl
NaCl + HNO3
2
NaCl + 2H20
→ 2NaOH + H2
+ Cl2
(электролиз)
NaOH
+ H2CO3
→NaHCO3
+ H2O
2NaHCO3
→
Na2CO3
+ H2O
+ CO2↑
(t= 60-200oC)
в)
Be
….Be(OH)2
BeO
BeSO4
Be2(OH)2CO3
Be
+2 HCl →2 BeCl2
+ H2↑
BeCl2
+ 2 NaOH → Be(OH)2↓
+ 2 NaCl
Be(OH)2
→ BeO
+ H2O
(при нагревании до 400 °C)
BeO
+ H2SO4
→ BeSO4
+ H2O
4BeSO4
+ 2Na2CO3
+ H2O
→2 [BeOH]2CO3
+ 4 Na2SO4
+ CO2
Задача
1.3. Для
нейтрализации 100 мл насыщенного при 298
К раствора гидроксида кальция потребовалось
40 мл 0,1 н раствора хлороводородной
кислоты. Рассчитайте произведение
растворимости (ПР) Са(ОН)2
при этой температуре.
Решение
Реакцию нейтрализации
гидроксида кальция хлороводородной
кислотой протекает по уравнению:
Ca(OH)2
+ 2 HCl → CaCl2
+
2 H2O
Так
как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
концентрация Са(ОН)2
определяется из соотношения:
![]()
Молярная
концентрация эквивалента (нормальность)
– это концентрация, которая показывает
количество вещества эквивалента,
содержащегося в 1 л раствора. Поскольку
молярная масса эквивалента Ca(OH)2
= 74/2 = 37 г/моль, то в растворимость Ca(OH)2
37*0,04 *0,1= 0,148 При растворении Ca(OH)2
в раствор переходит 1 моль ионов Са2+
и вдвое больше ионов ОН-.
Следовательно, в насыщенном растворе
[Са2+]
= 1,48*10-1;
[ОН-]
= 2,96*10-1
Отсюда
ПРCa(OH)2
= [Са2+]*[ОН-]2
= 1,3*10-2
Ответ:
1,3*10-2
Задача
1.4. Определите
рН 0,1 М раствора NaHCO3,
если первая и вторая константы диссоциации
угольной кислоты соответственно равны
4,2 *10-7
и 4,8 *10-11
.
Решение
Раствор
NaHCO3,
с позиций протолитической теории,
представляет собой раствор амфолита,
величина рН в котором может быть вычислена
по формуле:
рН
= 1/2 [ pK1(Н2СО3)
+ pK2(Н2СО3)
]
Поскольку
диссоциирует слабый электролит степень
диссоциации находим по формулам:
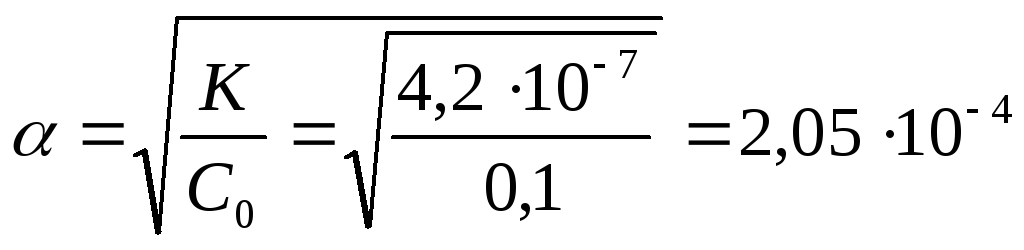
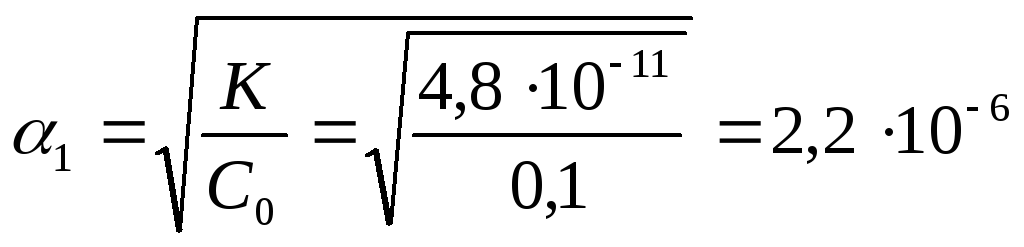
Определяем
концентрацию ионов Н+ при диссоциации
по первой ступени:
СН+
= α*С0
= 2,05*10-4*0,1
=2,05*10-5
pK1(Н2СО3)
= — lgCH+
= -lg(2,05*10-5)
= 5 –lg2,05=5
– 0,31 = 4,69
По
второй ступени:
СН+
= α*С0
= 2,2*10-6*0,1
=2,05*10-5
=2,2*10-7
pK2(Н2СО3)
= — lgCH+
= -lg(2,2*10-7)
= 7 –lg2,2
= 7 – 0,34 = 6,66
рН = ½ (4,69 + 6,66) =
5,675
Ответ:
5,675
Задача
1.5. В каком
объеме насыщенного раствора карбоната
кальция cодержится
2г CaCO3?
ПР(CaCO3)
= 4,8*10-9.
Решение
Записываем
уравнение гетерогенного равновесия в
насыщенном растворе соли:
Са2+
+ СО32-
↔ СаСО3
↓
Согласно
уравнению ПРСаСО3
= [Са2+]
* [СО32-]
= 4,8*10-9.
Поскольку в насыщенном растворе, не
содержащем посторонних избыточных
ионов, равновесные концентрации [Са2+]
и [СО32-]
равны, их можно обозначить [Са2+]
= [СО32-]
= Х, и тогда ПРСаСО3
= Х2
Х
=
![]()
Следовательно,
в насыщенном растворе СаСО3
содержится 6,9*10-4
моль/л. Растворимость в г получим, умножив
концентрацию в моль/л на молярную массы
СаСО3. (100 г/моль).
6,9*10-4
* 100 = 6,9*10-2
г/л.
Составляем
пропорцию:
В
1 л насыщенного раствора содержится
0,069 г СаСО3
В
Х л « «
2 г СаСО3
Откуда
![]()
Ответ:
28,98 л
Соседние файлы в папке 1361191805_archive
- #
- #
- #
- #
- #
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Примеры решения задач
––––––––––––––––
* См. табл. 4
Подавляющее большинство веществ обладает ограничений растворимостью в воде и других растворителях. Гетерогенная система, в которой в состоянии равновесия находится осадок и насыщенный раствор электролита при постоянной температуре, характеризуется величиной, которая называется произведением растворимости ПР.
Произведение растворимости равно произведению концентраций ионов малорастворимого электролита в насыщенном растворе, взятых в степенях их стехиометрических коэффициентов.
В общем случае выражение произведения растворимости для малорастворимого электролита типа описывается уравнением:
,
где , – концентрации ионов в растворе.
Более строго произведение растворимости выражается через произведение активностей ионов:
.
Величины произведений растворимости у разных веществ различны. Произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры.
Величины произведений растворимости позволяют оценить возможность образования осадка в данных условиях, вычислить концентрацией ионов малорастворимой соли в насыщенном растворе и т.д.
Если < – то раствор ненасыщенный,
если = – то раствор насыщенный,
если > – раствор пересыщенный.
Осадок образуется в том случае, когда произведение концентрацией ионов малорастворимого электролита превысит величину его произведения растворимости при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается.
Пример 1.
Растворимость СаСО3 равна 0,0069 г/л. Рассчитайте произведение растворимости СаСО3.
Растворимость СаСО3 равная 0,0069 г/л означает, что в 1 л раствора содержится 0,0069г СаСО3. Находим молярную концентрацию этого раствора:
СМ = 0,0069/(100×1) = 6,9×10-5 моль/л.
Так как каждая молекула СаСО3 при растворении дает по одному
иону и то моль/л.
Следовательно,
Пример 2.
Произведение растворимости PbSO4 составляет . Сколько грамм содержится в 500 мл раствора при 250С?
Равновесие в данной системе выражается следующей схемой:
.
Тогда моль/л.
Запишем выражение для произведения растворимости :
х×х = х2;
тогда моль/л.
моль/л – это молярная концентрация каждого иона в растворе или молярная концентрация раствора PbSO4, .
Массу PbSO4 в 500 мл раствора рассчитываем из формулы:
,
где г/моль;
Пример 3.
Выпадает ли осадок при смешивании равных объемов растворов и с одинаковыми концентрациями 0,2 моль/л. .
При смешивании объем раствора возрастает вдвое, и концентрация каждого из веществ уменьшается вдвое, т.е. станет 0,2 моль/л: 2 = 0,1 моль/л. Равновесие при диссоциации каждой исходной соли можно записать:
a cоли образованной при их смешивании:
Тогда концентрации моль/л; моль/л.
Следовательно, произведение концентраций ионов образовавшейся соли будет:
Полученная величина превышает . Поэтому часть соли PbCl2 будет выпадать в осадок.
Пример 4.
Какая масса кальция находится в виде ионов в 2 л насыщенного раствора ?
Так как раствор насыщенный, то произведение растворимости достигнуто, В растворе устанавливается равновесие:
Находим молярную концентрацию кальция в насыщенном растворе
;
Молярная концентрация кальция моль/л.
Найдем содержание кальция в граммах:
а в 2л насыщенного раствора:
Контрольные задания
111. Произведение растворимости Ag3PO4составляет 1,810-18. В ка-ком объёме насыщенного раствора содержится 0,05 г растворённой соли?
112. В 3 л насыщенного при комнатной температуре раствора PbSO4содержится 0,132 г соли. Вычислите произведение растворимости PbSO4.
113. В 3 л насыщенного раствора AgIO3содержится в виде ионов 0,176 г серебра. Вычислите произведение растворимости AgIO3.
114*. К 50 мл 0,001 н. раствора HCI добавили 450 мл 0,001 н. раствора азотнокислого серебра. Выпадет ли осадок хлорида серебра?
115*. Будет ли выпадать осадок при добавлении к 100 мл 0,02 н. раствора сульфата калия 100 мл 0,01 н. раствора хлорида кальция?
116*. Исходя из произведения растворимости карбоната кальция, найдите массу СаСО3, содержащуюся в 100 мл его насыщенного раствора.
Таблица 5. Произведение растворимости труднорастворимых в воде соединений (при температуре 25 С)
| Вещество | ПР | Вещество | ПР | |
| AgCl | 1,56·10-10 | Ag2S | 1,6·10-49 | |
| AgBr | 4,4·10-13 | CaCO3 | 4,8·10-9 | |
| Ag2SO4 | 7,7·10-5 | CaSO4 | 6,1·10-5 |
117*. Образуется ли осадок сульфата серебра, если к 0,02 М раствору азотнокислого серебра добавить равный объем 1 н. раствора серной кислоты?
118. В 500 мл воды при 18 С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
119*. Какая масса серебра находится в виде ионов в 1 л насыщенного раствора AgBr?
120*. В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
ГИДРОЛИЗ СОЛЕЙ
Примеры решения задач
Гидролизом солей называется обменное взаимодействие ионов соли с водой, протекающее в сторону образования молекул слабого электролита ( основания или кислоты) и накопления Н+ или ОН- ионов, приводящего к изменению нейтральной реакции среды.
Гидролиз по катиону.
Гидролизу подвергаются соли, образованные слабыми основаниями и сильными кислотами ( и др.). С водой взаимодействует катион слабого основания, объединяющийся с ионом ОH- из воды. Ион водорода H+ при этом освобождается и подкисляет раствор, рH которого становится меньше 7.
Гидролиз по аниону.
Гидролизу подвергаются соли, образованные сильными основаниями и слабыми кислотами ( и др.). Анион слабой кислотой взаимодействует с ионом Н+ из Н2О. Ион гидроксила при этом освобождается, и рН становится больше 7.
Гидролиз по катиону и аниону.
Соли, образованные слабыми основаниями и слабыми кислотами, гидролизуются и по катиону, и по аниону ( и др.). Гидролиз протекает до конца и характеризуется небольшими изменениями рН среды, так как связанными оказываются как ионы ОН- из воды, так и ионы Н+. Так как образующиеся слабые основание и кислота являются электролитами разной силы (их константы неодинаковы), то рН раствора будет определять более сильный из них электролит.
Если Кд (основания)> Кд (кислоты), то рН > 7;
Если Кд (основания)< Кд (кислоты), то рН < 7.
Гидролизу не подвергаются соли, образованные сильными основаниями и сильными кислотами: ( и др.) так как ни катион, ни анион соли не могут при взаимодействии с водой образовывать молекулы слабых электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (рН=7).
Гидролиз можно усилить, разбавлением раствора и повышением температуры раствора.
Пример 1.
Составьте молекулярные и ионно-молекулярные уравнения реакции гидролиза и укажите рН раствора КСN.
KCN+HOH«HCN+KOH
K++CN-+HOH«HCN+K++OH-
CN-+HOH«HCN+OH-, рН>7.
Соль КСN образована сильным основанием и слабой кислотой. Гидролиз идет по аниону слабой кислоты НСN. В результате гидролиза образуется слабая кислота НСN и избыток ионов ОН-, которые подщелачивают раствор. рН раствора будет больше 7.
Пример 2.
Составьте молекулярные и ионно – молекулярные уравнения реакций гидролиза и укажите реакцию раствора NH4Cl.
NH4Cl+HOH« NH4OH+HCl
рН<7.
Соль NH4Cl образована слабым основанием и сильной кислотой. Гидролиз идет по катиону слабого основания NH4OH. В результате гидролиза образуется слабое основание NH4OH и избыток ионов Н+, которые подкисляют раствор. рН раствора будет меньше 7.
Пример 3.
Составьте молекулярные и ионно-молекулярные уравнения реакций гидролиза и укажите рН раствора СН3СОО(NH4).
СН3СОО(NH4)+HOH « СН3СООH+ NH4OH
Гидролиз в данном случае идет и по катиону, и по аниону. В результате гидролиза образуются и слабые основания NH4OH , и слабая кислота СН3СООН (КД=1,86×10-5). Так как константы диссоциации этих электролитов практически одинаковы, то реакция раствора этой соли будет близка к нейтральной (рН=7).
Пример 4.
Составьте молекулярные и ионно-молекулярные уравнения реакций гидролиза и укажите рН раствора Аl(NO3)3.
Гидролиз соли, образованной поливалентным катионом и слабого основания, протекает ступенчато через стадии образования основных солей:
1 ступень AlCl3+HOH«Al(OH)Cl2+HCl
Al3++ 3Cl-+HOH«Al(OH)2++2Cl-+H++Cl-
Al3++HOH« Al(OH)2++H+,рН<7.
2 ступень Аl(OH)Cl2+HOH«Al(OH)2Cl+HCl
Al(OH)2++2Cl-+HOH«
pH<7.
3 ступень Al(OH)2Cl+HOH«Al(OH)3+HCl
рН<7.
Гидролиз соли протекает сильно по первой ступени, слабо – по второй ступени и совсем слабо – по третьей ступени (ввиду накопления ионов водорода процесс смещается в сторону исходных веществ).
Пример 5.
Изменится ли нейтральная реакция среды при растворении в воде соли NaCl?
Соль NaCl образована сильным основанием и сильной кислотой, поэтому гидролизоваться не будет и изменения рН в растворе не произойдет.
NaCl+HOH = NaOH+HCl
Na++Cl-+HOH=Na++OH-+H++Cl-
HOH=H++OH-
В этом случае происходит необратимая реакция, нейтрализации сильного основания сильной кислотой, обратная процессу гидролиза.
Контрольные задания
121. Составьте ионно-молекулярные и молекулярные уравнения реакции гидролиза и укажите реакцию растворов солей:
CH3COONa, ZnCl2
122**. NH4Cl, K2CO3
123**. Al2(SO4)3, KCl
124**. CuCl2, Na2SiO3
125**. FeCl3, Na2SO4
126**. NH4NO3, Na2SO3
128*. KCN, FeCl2
129*. Na2S, ZnSO4
130*. K2SiO3, NiCl2
