В каком объеме 3 н раствора содержится 600 г al2 so4 3
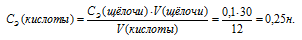
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
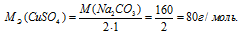
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
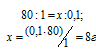
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
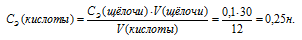
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
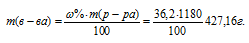
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
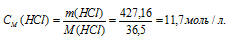
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
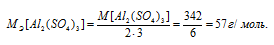
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
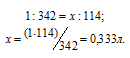
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
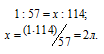
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
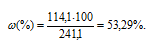
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
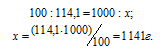
Теперь рассчитаем моляльность раствора:
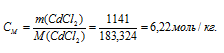
Ответ: 53,3%; 6,22 моль/кг.
Вопросы к контрольной работе
для студентов I курса заочной формы обучения
фармацевтического факультета
1. Основные способы приготовления растворов из фиксаналов, по навеске реактива, разбавлением более концентрированного раствора данного вещества. Как приготовить растворы, используемые в медико-санитарной практике: а) 0,1М HCl; б) 0,9% NaCl; в) 5%NH3*H2O;
г) 0,1н (КMnO4); д) 0,1н. NaOH.
2. Способы выражения концентрации растворов: массовая доля, молярная концентрация. Применение в медицине. Рассчитайте массовую долю вещества в растворе с молярной концентрацией уксусной кислоты
5,6 моль/л (r = 1,034 г/мл).
3. Способы выражения концентрации растворов: молярная концентрация эквивалента, титр. Молярная концентрация окислителя в растворе равна
0,03 моль/л. Определите молярную концентрацию эквивалента окислителя, принимая во внимание химизм реакции:
KMnO4 + H2O2 + H2SO4 ® MnSO4 + …
4. Дайте определение: «раствор», «растворитель», «растворенное вещество». Ответ поясните на примерах. Какой объем 0,1М раствора Н3РО4, можно приготовить из 85 мл раствора с молярной концентрацией эквивалента Н3РО4 равной 0,75н. (f(Н3РО4) = 1/3)?
5. Сколько миллилитров концентрированной соляной кислоты с массовой долей 40% и r = 1,198 г/мл следует взять для приготовления 1,0 л 2,5н. HCl? Опишите способ приготовления растворов методом разбавления концентрированных растворов.
6. Кальций хлорид используется как кровоостанавливающиее средство. Как приготовить 200 мл 3% раствора СаCl2 из кристаллического СаCl2*6Н2О, если плотность полученного раствора 1,0 г/мл? Какова молярная концентрация СаCl2 в полученном растворе. Опишите способ приготовления растворов из фиксаналов.
7. В 2,5 л раствора содержится 18,55 г алюмокалиевых квасцов KAl(SO4)3*12H2O. Рассчитайте: а) молярную концентрацию квасцов в растворе; б) молярную концентрацию эквивалента квасцов в растворе (fквасцов = 1/4). Опишите способ приготовления растворов из навески твердого вещества.
8. Рассчитайте массу кристаллического натрий хлорида, которая необходима для приготовления раствора с молярной концентрацией натрий хлорида 0,75М. Выразите концентрацию приготовленного раствора через массовую долю и титр (r = 1,034 г/мл). Опишите способ приготовления такого раствора.
9. Какой объем 0,1М раствора Н3РО4, можно приготовить из 40 мл раствора с молярной концентрацией эквивалента Н3РО4, равной 0,9 моль (f(Н3РО4) = 1/3)?
10. Вычислите молярную концентрацию и молярную концентрацию эквивалента H2SO4 в растворе, если массовая доля H2SO4 в этом растворе равна 58% (r = 1,48 г/мл). Медико-биологичес-кое значение растворов.
11. Молярная концентрация натрия карбоната в растворе 0,15 моль/л (r = 1,0 г/мл). Вычислите молярную концентрацию эквивалента, титр и массовую долю Na2CO3 в растворе. Дайте определение понятию «моляльность раствора».
12. При некоторых заболеваниях в кровь вводят 0,9% раствор NaCl (r =
1 г/мл). Вычислите: а) молярную концентрацию и титр этого раствора; б) массу соли, введенную в организм при вливании 600 мл этого раствора.
13. К 100 мл 96% (по массе) H2SO4 (r = 1,84 г/мл) прибавили 410 мл воды, получили раствор с r = 1,22 г/мл. Вычислите молярную концентрацию эквивалента и массовую долю H2SO4 в этом растворе с учетом, что (f(Н2SО4) = 1/2). Каким способом приготовлен этот раствор? Опишите методику приготовления такого раствора.
14. 5 мл раствора с молярной концентрацией H2SO4 1 моль/л разбавили водой до 250 мл. Рассчитайте w(H2SO4); c(H2SO4) и c(1/2H2SO4) для полученного раствора, если его плотность равна 1 г/мл.
15. Найдите молярность и моляльность 36,2% (по массе) раствора HCl, плотность которого 1,18 г/мл. Сколько мл этого раствора необходимо взять для приготовления 5 л 0,1н. раствора HCl?
16. Какой объем 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5н. раствора? Дайте определения понятиям: эквивалент, фактор эквивалентности, количество вещества эквивалента, молярная концентрация эквивалента. (fэк(H2SO4) = )
17. Найдите массу NaNO2, необходимую для приготовления 300 мл 0,2М раствора. Опишите способ приготовления такого раствора из навески твердого вещества.
18. Плотность 40% (по массе) раствора HNO3 равна 1,25 г/мл. Рассчитайте молярность, моляльность и титр этого раствора. Как приготовить раствор из фиксанала?
19. 6,8 г карбоната натрия растворили в 104 г воды. Вычислите массовую и молярную доли растворенного вещества в растворе. Опишите способ приготовления раствора с определенной массовой долей растворенного вещества.
20. Найдите моляльность и молярную долю растворенного вещества в 67%-ном (по массе) растворе сахарозы С12Н22О11. Дайте определение понятиям «молярная концентрация эквивалента» и «молярная концентрация».
21. В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114 г Al2(SO4)3. Опишите способы приготовления этих растворов.
22. Какой объем 6,0М раствора HCl нужно взять для приготовления 25 мл 2,5М раствора HCl. Определите титр полученного раствора.
23. Рассчитайте молярную массу эквивалента: а) фосфорной кислоты в реакции полного обмена протонов; б) сульфата железа(III) в реакции полного обмена ионов железа; в) гидрокарбоната кальция в реакции частичного обмена ионов кальция; г) дигидрофосфата аммония в реакции частичного обмена протонов.
24. При отравлениях цианидами внутривенно вводят 2%-ный раствор нитрата натрия (r = 1,011 г/мл). Вычислите молярную концентрацию, титр и моляльность этого раствора.
25. Водный раствор сульфата меди с массовой долей 1% (r = 1,009 г/мл) назначают в малых дозах для улучшения кроветворной функции. Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, титр и моляльность этого раствора?
26. Какую массу калий бромида нужно прибавить к 5 кг 16% раствора, чтобы получить 20% раствор? Рассчитайте молярную концентрацию и молярную концентрацию эквивалента полученного раствора?
27. Сколько граммов 30% раствора гидроксида калия надо прибавить к 200 г 90% раствора, чтобы получить 50% раствор гидроксида калия?
28. В лаборатории имеются растворы с массовой долей хлорида натрия 10% и 20%. Какую массу каждого раствора надо взять для получения 300 г раствора с массовой долей соли 12%?
29. Какой объем раствора с массовой долей серной кислоты 60% (r =
1,5 г/мл) и раствора с массовой долей серной кислоты 30% (r = 1,2 г/мл) надо взять для приготовления раствора H2SO4 массой 240 г с массовой долей кислоты 50%?
30. Какие объемы раствора NaCl с w1 = 5% и w2 = 24% нужно взять для приготовления 250 мл раствора с w3 = 18%? (r1 = 1,03 г/мл; r2 =
1,18 г/мл; r3 = 1,13 г/мл).
31. Определите массу раствора с массовой долей CuSO4 10% и массу воды, которые требуются для приготовления раствора массой 500 г с массовой долей CuSO4 2%.
32. Какая масса воды и раствора с массовой долей хлорида магния 0,2 потребуется для приготовления 300 г раствора с массовой долей MgCl2 0,04?
33. На нейтрализацию 40 мл раствора едкого натра израсходовано 25 мл
0,5 н. раствора серной кислоты. Определите молярную концентрацию эквивалента едкого натра.
34. Сколько литров 0,03 н. раствора Н3РО4 способно прореагировать с 250 г
4%-ного раствора NaOH с образованием дигидроортофосфата натрия?
35. Какой объем 3 н. раствора H2SO4 требуется для нейтрализации 8,415 г КОН?
36. Сколько граммов Na2CO3 требуется для взаимодействия с 600 мл 0,5 н. раствора HNO3?
37. Какой объем 4 н. раствора HCl требуется для нейтрализации 10 г NaOH?
38. Сколько граммов 5%-ного раствора AgNO3 требуется для обменной реакции со 120 мл 0,6 н. AlCl3?
Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?
• Масса 1 л раствора равна
ρp=1,105 г/мл
CM –? • Рассчитаем массу Al2(SO4)3 в 1105 г раствора, исходя из формулы (1):
• Молярная масса , следовательно, молярная концентрация сульфата алюминия исходя из формулы (4):
Пример 2. Чему равна массовая доля 0,2 М раствора (NH4)2SO4 с плотностью 1,015 г/мл?
• Масса 1 л раствора равна
ρp=1,015 г/мл
– ? • Рассчитаем массу (NH4)2SO4 в 1 л раствора,
используя формулу (4) (молярная масса ):
• Массовая доля сульфата алюминия в растворе по формуле (1) :
Пример 3. Смешали 50 мл 10 %-го раствора серной кислоты плотностью 1,069 г/мл и 150 мл 30 %-го раствора той же кислоты, плотностью 1,224 г/мл. Чему равна массовая доля кислоты в конечном растворе?
Условная схема приготовления конечного раствора:
раствор 1 (10 %) + раствор 2 (30 %) = раствор 3 (? %)
• Массовая доля серной кислоты, исходя из (1):
ρp1=1,069 г/мл
Vp1= 50 мл • Исходя из того, что масса конечного раствора складывается
из масс исходных растворов, а масса растворенной в нем
ρp2=1,224 г/мл кислоты – из масс кислоты в исходных растворах, получаем:
Vp2= 150 мл
• Используя значения плотностей растворов и выражение (1), найдем массы исходных растворов и растворенной в них серной кислоты:
• Найдем массовую долю серной кислоты в конечном растворе:
.
Пример 4. Какой объем 40 %-го раствора азотной кислоты плотностью 1,251 г/мл и воды потребуется для приготовления 500 мл 20 %-ой кислоты плотностью 1,119 г/мл?
Условная схема приготовления раствора:
раствор 1 (40 %) + вода = раствор 2 (20 %)
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1=1,251 г/мл
• В полученном выражении неизвестна масса кислоты, но при
ρp2=1,119 г/мл разбавлении исходного раствора водой масса растворенной
Vp2= 500 мл кислоты не изменяется, поэтому ее можно вывести из
Vp1– ? мл выражения массовой доли раствора 2:
• Рассчитаем объем исходного раствора:
• Исходя из схемы получения конечного раствора:
Пример 5. Какой объем 10 %-го раствора КОН плотностью 1,082 г/мл потребуется для приготовления 2 л 1 М раствора?
Условная схема приготовления раствора:
раствор 1 (10 %) + вода = раствор 2 (1 М)
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1=1,082 г/мл
• В полученном выражении неизвестна масса щелочи, но при
Vp2= 2 л разбавлении исходного раствора водой масса растворенной
Vp1– ? мл щелочи не изменяется, поэтому ее можно вывести из
выражения молярной концентрации раствора 2:
;
• Рассчитаем объем исходного раствора:
5.2. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Какой объем 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) требуется для приготовления 2 л 5 %-го раствора той же кислоты (ρ = 1,02 г/мл)?
2. Определить молярную концентрацию концентрированной соляной кислоты
(ρ = 1,183 г/мл), содержащей 36 % хлороводорода.
3. Какой объем 50 %-го раствора KOH (ρ = 1,538 г/мл) требуется для приготовления 3 л 10 %-го раствора (ρ = 1,082 г/мл)?
4. Плотность 32 %-го раствора KOH равна 1,31 г/мл. Сколько моль KOH находится в 3 л раствора?
5. Какой объем 28 %-го раствора серной кислоты (ρ = 1,21 г/мл) можно приготовить из 100 г 92 %-го раствора?
6. К 1 л 6 %-го раствора серной кислоты (ρ = 1,04 г/мл) добавили 1 л воды. Вычислить молярную концентрацию полученного раствора.
7. Какой объем 50 %-го раствора H2SO4 (ρ = 1,4 г/мл) требуется для приготовления 2 л 1 М раствора?
8. Смешали 50 мл 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) и 150 мл 30 %-го раствора той же кислоты (ρ = 1,152 г/мл). Какова массовая доля HCl в полученном растворе?
9. Сколько граммов K2SO4 необходимо для приготовления 500 мл 0,1 М раствора?
10. Какой объем 20 %-го раствора NaОН плотностью 1,225 г/мл потребуется для приготовления 1 л 2 М раствора?
11. Смешали 500 г 10 %-го раствора и 300 г 30 %-го раствора H2SO4. Какова процентная концентрация полученного раствора?
12. Смешали 50 мл 30 %-го раствора азотной кислоты плотностью 1,286 г/мл и 50 мл 50 %-го раствора той же кислоты плотностью 1,316 г/мл. Чему равна массовая доля кислоты в конечном растворе?
13. Какой объем 1 М раствора хлорида натрия можно приготовить из 20 г безводного NaCl?
14. Какой объем 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) необходим для приготовления 3 л 1,5 М раствора?
15. К 1 л 10 %-го раствора NaOH (ρ = 1,115 г/мл) прибавили 3 л воды. Какова процентная концентрация полученного раствора?
16. Какая масса сульфата натрия требуется для приготовления 500 мл 0,2 М
раствора?
17. 100 мл 2 М раствора разбавили водой до 400 мл. Какова молярная концентрация раствора?
18. Из 600 г 5 %-го раствора соды (Na2CO3) выпариванием удалили 100 г воды. Какова массовая доля Na2CO3 в полученном растворе?
19. Вычислить объем 10 %-го раствора NaOH (ρ = 1,115 г/мл), который требуется для приготовления 1 л 1 М раствора.
20. В каком объеме 0,2 М раствора содержится 10 г NiSO4?
21. Смешали 20 мл 20 %-го раствора азотной кислоты (ρ = 1,119 г/мл) и 100 мл 30 %-го раствора той же кислоты (ρ = 1,184 г/мл). Вычислить процентную концентрацию полученного раствора.
22. Какая масса хлорида натрия содержится в 100 мл 1 М раствора?
23. Какой объем 10 %-го раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 3 л 5 %-го раствора (ρ = 1,05 г/мл)?
24. Вычислить молярную концентрацию 25 %-го раствора сульфата цинка
(ρ = 1,3 г/мл).
25. Какой объем 30 %-й соляной кислоты (ρ = 1,152 г/мл) нужно взять для приготовления 1 л 2 М раствора?
26. Какой объем воды надо прибавить к 100 мл 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) для получения 20 %-го раствора?
27. Какая масса KNO3 должна быть растворена в 500 мл воды для получения 5 %-го раствора?
28. К 2 л 10 %-го раствора азотной кислоты (ρ = 1,054 г/мл) добавили 3 л
4 %-го раствора той же кислоты (ρ = 1,022 г/мл). Вычислить процентную концентрацию полученного раствора.
29. Вычислить молярную концентрацию 20 %-го раствора сульфата железа (II) (ρ = 1,21 г/мл).
30. К 50 мл 96 %-го раствора азотной кислоты (ρ = 1,5 г/мл) прилили 30 мл 9,9 М раствора той же кислоты (ρ = 1, 3 г/мл). Какова процентная концентрация полученного раствора?
Здравствуйте, мои Дорогие!!!
Несколько заданий, которые повторяются в ЕГЭ
Задание 1
К
раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора
серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г
кристаллической соды Na2CO3ˑ10 H2O. Рассчитайте массу
и массовую долю гидроксида натрия в исходном растворе.
Дано:
m
р-ра(NaOH) =1200 г
m (H2SO4) =490 г
ω (H2SO4)= 40%-
m (Na2CO3ˑ10 H2
_________________________
Найти: m(NaOH) -? ω(NaOH) -?
1) составим уравнения реакций:
2NaOH + H2SO4= Na2SO4+ 2H2O
H2SO4+ Na2CO3= Na2SO4 + CO2+ H2O
Возможен
также расчёт на основании уравнений реакций образования NaHSO4 и
последующего его взаимодействия с Na2CO3 . Конечный ответ
не изменится;
2)
рассчитываем общее количество серной кислоты, а также количество серной
кислоты, прореагировавшей с содой:
n(общ) (H2SO4) = 490 ˑ 0,4/98 = 2 моль
n(H2SO4) = n(Na2CO3ˑ10H2O) =143/ 286 = 0,5 моль
3)
рассчитываем количество серной кислоты, вступившей в реакцию с гидроксидом
натрия и масса гидроксида натрия в исходном растворе:
n(H2SO4) = 2 − 0,5 =1,5 моль
n(NaOH) = 2n(H2SO4 ) = 3 моль
m(NaOH) = 3ˑ 40 =120 г
4)
рассчитываем массовую долю гидроксида натрия в исходном растворе:
ω(NaOH) =120
/ 1200 = 0,1(10%)
Ответ:
m(NaOH)
=120 г, n(NaOH) =3 моль
Задание 2
В
15%-ном растворе серной кислоты массой 300 г растворили карбид алюминия.
Выделившийся
при этом метан занял объём 2,24 л (н.у.). Рассчитайте массовую долю
серной
кислоты в полученном растворе.
Решение
Дано:
ω(H2SO4)- 15% — 0,15
mр-ре(H2SO4)-
300 г
V(СН4)- 2,24 л (н.у.).
найти
w(H2SO4) 1) составим
уравнение реакции
серной кислоты с карбидом
алюминия
и рассчитана его масса:
Al4С3 + 6H2SO4 →
2Al2(SO4)3 + 3СН4
n(Al4С3) = 1/3·n(СН4) = 0,033 моль
m(Al4С3)
= 0,033моль · 144 г/моль = 4,8 г
2)
рассчитаем массу выделившегося метана:
n(СН4)
= 2,24/22,4 = 0,1 моль
m(СН4)
= 0,1 моль · 16 г/моль = 1,6 г
3)
определим массу прореагировавшей серной кислоты:
n(H2SO4)
= 2·n(СН4) = 0,2 моль
m(H2SO4)
= 0,2 моль · 98 г/моль = 19,6 г
4)
рассчитаем массу раствора и массовую доля оставшейся кислоты в нем:
m(раствора)
= 300 + 4,8 – 1,6 = 303,2 г
w(H2SO4) =
(300·0,15 – 19,6)/303,2 = 0,084 = 8,4%
Ответ:
w(H2SO4) =8,4%
Задание 3
Карбонат
кальция массой 10 г растворили при нагревании в 150 мл хлороводородной
кислоты
(ρ =
1,04 г/мл) с массовой долей 9%. Какова массовая доля хлороводорода в
образовавшемся
растворе?
Решение
Дано
m(CaCO3)=
10г
w(HCl)= 9%.
V(HCl)=
150 мл
(ρ = 1,04 г/мл)
Найти:
w(HCl) -? 1) Составим уравнение
химической реакции:
СаСO3 + 2HCl = H2O
+ CaCl2 + CO2↑
2)
Рассчитаем количества веществ реагентов и сделаем вывод об избытке хлороводорода:
n(HCl)исх.
= 150·1,04·0,09/36,5 = 0,385 моль – в избытке
n(CaCO3)
= 10/100 = 0,1 моль
n(HCl)прореаг.
= 2n(CaCO3) = 0,2 моль.
3)
Рассчитаем массу раствора (с учётом массы выделившегося углекислого газа):
n(CO2) = n(CaCO3)
= 0,1 моль
m(CO2) = 0,1 ·
44 = 4,4 г
mp-pa = 150·1,04
+ 10 – 4,4 = 161,6 г
4)
Рассчитаем массовую доля хлороводорода:
n(HCl)изб.
= 0,385 – 0,2 = 0,185 моль
m(HCl)
изб. = 0,185 · 36,5 = 6,75 г
w(HCl) = 6,75/161,6 = 0,042 или 4,2%
Ответ
правильный и полный, включает все названные w(HCl) = 4,2%
Задание 4
Какую
массу оксида серы (VI) следует добавить к 500 г 20%-ного
раствора серной
кислоты, чтобы увеличить её массовую долю до 40%?
Решение
Дано:
m (H2SO4)- 500 г
Найти:
m(SO3)
= ? 1) Составим
уравнение химической реакции:
SO3 + H2O = H2SO4
2)
Рассчитаем массу серной кислоты, находившейся в исходном
растворе и получившейся
из x моль оксида серы (VI):
m1(H2SO4)
= m1(раствора)·w1(H2SO4)
= 500·0,2 = 100 г
m(SO3)
= n(SO3)· M(SO3) = 80x
m2(H2SO4)
= n(H2SO4)· M(H2SO4) = 98x
3)
Рассчитаем массу раствора и суммарную массу серной кислоты в нём:
m2(раствора) = m1(раствора)
+ m(SO3) = 500 + 80x
m3(H2SO4)
= m1(H2SO4) +
m2(H2SO4) = 100 + 98x
4) Найдём массу SO3, необходимую для растворения:
w2(H2SO4) = m3 (H2SO4)/m2(раствора)
0,4
= (100+98x)/(500+80x)
откуда
x = 1,52 моль,
m(SO3) =1,52·80 = 121,6 г.
Ответ:m(SO3= 121,6 г
Задание 5
Нитрит
натрия массой 13,8 г внесли при нагревании в 220 г раствора хлорида аммония с
массовой
долей 10%. Какой объём (н.у.) азота выделится при этом и какова массовая доля
хлорида
аммония в получившемся растворе?
Решение
Дано:
m(NaNO2)-
13,8 г
m
(NH4Cl) — 220 г
Найти:
V(N2)-?
w(NH4Cl) в ра-ре — ? 1) Записываем уравнение реакции
и рассчитаем количества исходных веществ:
NaNO2
+ NH4Cl = N2↑ + NaCl + 2H2O
n(NaNO2) = 13,8/69 = 0,2 моль
n(NH4Cl)
= 220·0,1/53,5 = 0,41 моль
NH4Cl − в
избытке
2) Рассчитаем
объём выделившегося азота:
n(N2)
= n(NaNO2) = 0,2 моль
V(N2) = 0,2
моль · 22,4 л/моль = 4,48 л
3) Рассчитаем масса
хлорида аммония, оставшегося в избытке:
n(NH4Cl)изб
= 0,41 − 0,2 = 0,21 моль
m(NH4Cl)изб
= 0,21 · 53,5 = 11,2 г
4) Рассчитаем
массовую доля хлорида аммония:
mp-pa = 13,8 + 220 − 0,2·28 = 228,2 г
w(NH4Cl) = 11,2/228,2 = 0,049 или 4,9%
Ответ:
V(N2) =4,48 л w(NH4Cl)
=4,9%
Задание 6
Нитрит
калия массой 8,5 г внесли при нагревании в 270 г раствора бромида
аммония
с массовой долей 12%. Какой объем (н. у.) азота выделится при
этом
и какова массовая доля бромида аммония в получившемся растворе?
Решение
Дано:
m
(KNO2)- 8,5 г
m
(NH4Br) -270 г
Найти:
V(N2)-?
И получившийся ра-ор w(NH4Br)-?
1)
записываем уравнение реакции, и рассчитываем
количества исходных веществ:
KNO2
+ NH4Br = N2↑ + KBr + 2H2O,
n(KNO2) = 8,5/85 = 0,1 моль,
n(NH4Br)
= 270·0,12/98 = 0,33 моль − в избытке,
2) рассчитаем
объем выделившегося азота:
n(N2) = n(KNO2)
= 0,1 моль,
V(N2)
= 0,1 моль · 22,4 л/моль = 2,24 л,
3) рассчитаем масса
бромида аммония, оставшегося в избытке:
n(NH4Br)изб = 0,33 − 0,1 = 0,23 моль,
m(NH4Br)изб = 0,23 · 98 = 22,54 г,
4) рассчитана
массовая доля бромида аммония:
mp-pa = 8,5 +
270 − 0,1·28 = 275,7 г,
w(NH4Br) = 22,54/275,7 = 0,0818 или 8,2%.
Ответ: V(N2) =2,24 л,
w(NH4Br) =8,2%.
Добавленное
При растворении в соляной кислоте смеси железа и
магния массой 10,4 г выделилось
6,72 л водорода (н.у.). Найдите массу каждого
металла в смеси.
Дано:
m(смеси) = 10,4
г
Решение:
V
(H2) = 6,72 л____
1.
Запишем уравнения протекающих реакций:
m(Fe) — ? Fe + 2HCl =
FeCl2 + H2↑
m(Mg) — ?
Mg + 2HCl =
MgCl2 + H2↑
2. Рассчитаем количество вещества
выделившегося водорода:
n(H2) = V(H2) / Vn = 6,72 / 22,4 = 0,3 (моль).
3. Нам известна общая масса реагирующих
металлов, но, масса
каждого металла в смеси неизвестна. Из
условия задачи известен
суммарный объём водорода, выделившегося
в обеих реакциях.
Установить, объем водорода выделившийся
в каждой реакции по
данным условия невозможно. Для решения
задачи следует
обозначить неизвестные величины.
Пусть х
моль железа было в смеси и прореагировало с соляной
кислотой и у моль магния было в смеси и прореагировало с
соляной кислотой. Тогда масса железа в
смеси равна 56х, а масса
магния равна 24у.
Первое уравнение с двумя неизвестными
составлено:
56х + 24у = 10,4.
По уравнению видно, что водорода в
первой реакции выделилось
столько же, сколько прореагировало
железа – х моль, а во второйреакции – у моль. Всего же водорода выделилось 0,3 моль.
Второе уравнение: х
+ у = 0,3.
Составляем систему уравнений:
56х + 24у = 10,4
х + у = 0,3
Решая систему уравнений, получаем х
=
0,1; у = 0,2.
Тогда масса железа в смеси равна 56 ・ 0,1 = 5,6 (г), а масса
магния 10,4 – 5,6 = 4,8 (г)
Ответ: m(Fe)
= 5,6 г; m(Mg)
= 4,8 г.
Удачи
Вам, на экзаменах!!!!
Не
забудьте поделиться с другом, поставить плюсик и написать комментарий.
