В каком объеме 1м раствора содержится 114
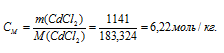
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
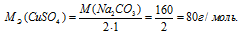
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
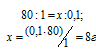
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
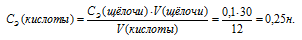
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
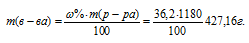
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
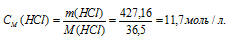
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
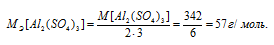
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
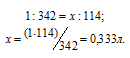
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
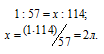
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
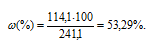
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
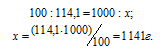
Теперь рассчитаем моляльность раствора:
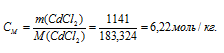
Ответ: 53,3%; 6,22 моль/кг.
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
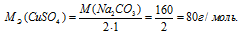
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
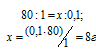
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
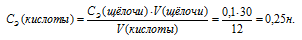
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
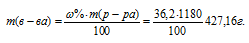
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
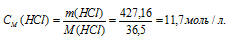
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
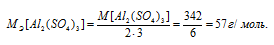
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
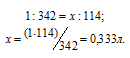
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
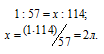
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
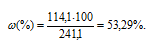
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
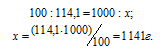
Теперь рассчитаем моляльность раствора:
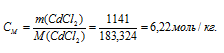
Ответ: 53,3%; 6,22 моль/кг.
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
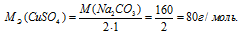
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
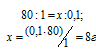
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
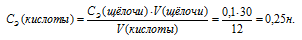
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
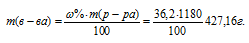
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
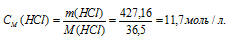
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
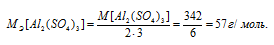
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
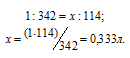
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
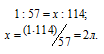
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
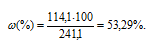
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
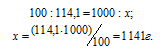
Теперь рассчитаем моляльность раствора:
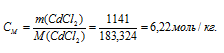
Ответ: 53,3%; 6,22 моль/кг.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ДЛЯ ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ХИМИИ
Тема №3:Растворы. Способы выражения концентрации растворов.
Количество часов:1
Курс: 1
Специальность:Фармация
Составители:
доц. Игенбаева Б.Б.
преп. Каримова А.С.
Астана 2013 г.
Тема: Растворы. Способы выражения концентрации растворов.
Цель: Сформировать знания о растворах, способах выражения их состава и значении в жизнедеятельности организмов. Применять знания при приготовлении растворов заданной концентрации и проведении соответствующих расчетов.
Задачи обучения: Студент должен знать химический эквивалент, способы выражения состава растворов и значение в жизнедеятельности организмов; должен уметь работать с химической посудой, приготовить растворы заданной концентрации и провести соответствующие расчеты.
Основы вопросы темы:
1. Основные определения: раствор, растворитель, растворенное вещество.
2. Способы выражения концентрации растворов.
3. Вода как наиболее распространенный растворитель в биосфере и химической технологии.
4. Роль водных растворов в жизнедеятельности организмов.
5. Понятие о коллигативных свойствах растворов неэлектролитов.
6. Осмос и осмотическое давление разбавленных растворов неэлектролитов.
7. Законы Рауля и Вант-Гоффа.
8. Роль осмотического давления в биологических системах.
9. Плазмолиз, гемолиз, тургор.
10. Гипо-, изо- и гипертонические растворы.
Методы обучения и преподавания:практическое занятие №3 (решение задач)
Решение задач:
Ø Сколько мл 50% -ного раствора серной кислоты (плотность равна 1,4г/мл) нужно взять для приготовления 2л 0,25н. раствора?
Ø Сколько граммов сульфата натрия потребуется для приготовления 5л 8 %-ного раствора (плотность раствора равна 1,075г/мл)?
Ø Какой объем 1М раствора серной кислоты потребуется для приготовления 500г 10%. раствора?
Ø Найти массу (г) соли, необходимую для приготовления 900 г 12%-ного раствора
Ø К 150г 30% -ного раствора НС1 прилили 500г кислоты неизвестной концентрации, в результате получился раствор с массовой долей равной 10%. Определите концентрацию прилитой кислоты.
Ø В каком объеме 1н. раствора содержится 114г сульфата алюминия?
Ø Имеется соль массой 200г. Рассчитайте массу воды, которую надо взять, чтобы получить раствор с массовой долей соли 12,5%.
Литература:
1. ГлинкаН.Л. «Общая химия» Л,Химия,1984г.,стр.166-168
2. АхметовН.С. «Общая и неорганическая химия» М,В,Ш., 1994г
3. Угай Л.Л «Общая химия»М,В,Ш.1997г
4. СтёпинБ.Д. Цветков А.А. «Неорганическая химия»М.В.Ш. 1994г.
5. Глинка Н.Л «Задачи и упражнения по общей химии» Л,Химия. 1998г
6. Оганесян Э.Т. «Неорганическая химия» М,В.Ш.1987г
7. АхметовН.С.АзизоваМ.И. «Лабораторные работы по общей химии» М,В.Ш.1999г.,
8. Таперова А.А «Лабораторные работы по общей химии» Л.,Химия.
9. Остапкевич Н.А. «Практикум по неорганической химии»,В.Ш. 1987г
10. Лекционный материал.
Контроль:
1. Растворы. Способы выражения состава раствора.
а) Массовая доля. Плотность раствора.
б) Молярная концентрация.
в) Эквивалент. Фактор эквивалентности. Молярная концентрация эквивалента.
г) Молярная концентрация.
д) Титр. Расчеты, связанные с приготовлением и разбавлением растворов.
Пример 1. Вычислите молярную концентрацию, молярную концентрацию эквивалентов и моляльность CuSO4 в растворе CuSO4 с концентрацией w , плотность которого г/см3.
Решение. Найдем значение молярной массы и молярной массы эквивалентов CuSO4:
В 100г раствора с w содержится 10г CuSO4 и 90г Н2O.
Следовательно, моляльность CuSO4 в растворе будет равна
.
Найдём массу 1л раствора:
.
В этой массе раствора содержится
1107 г × 0,1=110,7 г СuSO4.
Следовательно, молярная концентрация CuSO4 в растворе будет равна
,
а молярная концентрация эквивалентов CuSO4 в растворе составляет
.
Примечание.
Можно использовать следующие сокращённые записи для обозначения состава данного раствора:
– означает, что в растворе на каждый килограмм воды как растворителя приходится 0,696 моль CuSO4.
– означает, что в 1 л раствора содержится 0,693 моль CuSO4.
– означает, что в 1 л раствора содержится 1,386 моль эквивалентов CuSO4
Пример 2. Какой объем воды нужно прибавить к 200 мл раствора NaOH с концентрацией wNaOH=0,3 и с плотностью для получения раствора NaOH с концентрацией wNaOH=0,1.
Решение. Масса 200 мл исходного раствора NaOH равна
В этом растворе содержится 30 % NaOH, т.е. 266 г × 0,3=79,8 г.
По условию задачи эта масса составляет 10 % от общей массы разбавленного раствора. Тогда масса полученного раствора будет равна
Следовательно, к исходному раствору нужно прибавить Н2O:
798 г–266 г=532 г.
Пример 3. Определите молярную концентрацию эквивалентов NaOH в растворе, если на нейтрализацию 0,035л 0,3н. раствора H3PO4 израсходовано 0,02л раствора NaОН.
Решение. Произведение молярной концентрации эквивалентов вещества В на объем раствора VР равно количеству эквивалентов этого вещества. Поэтому для реакции, в которой участвуют равные количества эквивалентов веществ А и В, можно записать: .
В нашем случае .
Следовательно, .
Находим СЭК(NaOH):
Пример 4. Какой объем раствора H2SO4 с концентрацией W и с плотностью r=1,84 г/см3потребуется для приготовления 3л 0,4н. раствора H2SO4?
Решение. Молярная масса эквивалентов H2SO4 равна
г/моль.
Для приготовления 3л 0,4н. раствора H2SO4 требуется H2SO4:
49,04 г/моль × 0,4 моль/л × 3 л=58,848 г.
Масса 1см3 раствора H2SO4 с концентрацией w равна 1,84 г.
В этом растворе содержится 1,84 г × 0,96= 1,766 г H2SO4.
Отсюда для приготовления 3 л 0,4 н. раствора H2SO4 нужно взять
исходного раствора H2SO4.
Контрольные вопросы
151.Сколько граммов Na2SO3 потребуется для приготовления 5л раствора с концентрацией w =0,08 и плотностью 1,075 г/см3? Ответ: 430 г.
152.Из 400 г раствора H2SO4 с концентрацией w =0,5 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе? Ответ: 66,7 %.
153. Сколько граммов раствора NaCl с концентрацией w =0,3 нужно добавить к 300 г H2O, чтобы получить раствор с концентрацией w =0,1? Ответ:150 г.
154. Сколько граммов HCl содержится в 0,25 л раствора HCl с концентрацией wHCl=0,1052 и с плотностью 1,05 г/см3? Ответ: 27,6 г.
155. Вычислите молярную концентрацию K2SO4 в растворе, если в 0.02 л этого раствора содержится 2,74 г растворенного K2SO4. Ответ: 0.786 моль/л.
156. Раствор KOH с концентрацией wKOH=0,26 имеет плотность 1.24 г/см3. Какое количество вещества KOH содержится в 5 л этого раствора? Ответ: 28,7 моль.
157. Водный раствор содержит 577 г H2SO4 в одном литре. Плотность раствора равна 1,335 г/см3. Вычислить массовую долю, молярную концентрацию, молярную концентрацию эквивалентов и моляльность H2SO4 в растворе. Ответ: 43,22 %; 5,88 моль/л; 11,76 моль/л; 7,76 моль/кг.
158.Плотность 0,8 М раствора Fe2(SO4)3 равна 1 г/см3. Определите молярную концентрацию эквивалентов, моляльность, массовую долю Fe2(SO4)3 в растворе. Чему равен титр этого раствора? Ответ: 4,8 моль/л; 1,18 моль/кг; 32 %; 0,32 г/мл.
159. Вычислите массовую долю и моляльность HNO3 в 8н. растворе HNO3 с плотностью 1,246 г/см3. Ответ: 40,45 %; 10,8 моль/кг.
160. Сколько граммов Na2CO3 содержится в 500 мл 0,25н. раствора? Ответ: 6,63 г.
161. Сколько литров 0,1н. раствора HNO3 можно приготовить из 0,07 л раствора HNO3 с концентрацией w =0,3 и с плотностью 1,18 г/см3? Ответ: 3,93 л.
162. Из 5 л раствора KOH с концентрацией WKOH=0,5 и с плотностью 1,538 г/см3 надо приготовить раствор с концентрацией WKOH=0,18. Сколько литров H2O потребуется для этого? Ответ: 13,67 л.
163. Сколько литров 5н. раствора NaOH можно приготовить из 4 л раствора NaOH с концентрацией wNaOH=0,5 и с плотностью 1,525 г/см3? Ответ: 15,25 л.
164. Сколько миллилитров 0,5 М раствора H2SO4 можно приготовить из 15 мл 2,5 М раствора? Ответ: 75 мл.
165. В каком объеме 1 М раствора и в каком объеме 1н. раствора содержится 114 г Al2(SO4)3? Ответ: 0,333 л; 2 л.
166. Какой объем 6,0 М раствора HCl нужно взять для приготовления 25 мл 2,5 М раствора HCl? Ответ: 10,4 мл.
167. Сколько миллилитров концентрированной соляной кислоты с плотностью 1,19 г/см3 и с концентрацией wHCl=0,38 нужно для приготовления 1 л 2н. раствора? Ответ: 161,5 мл.
168. Сколько миллилитров раствора H2SO4 с концентрацией w =0,1 и с плотностью 1,07 г/см3 потребуется для нейтрализации раствора, содержащего 16 г NaOH? Ответ: 183,2 мл.
169. Какой объем 0,2н. раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0,5н. раствора FeCl3? Ответ: 0,25 л.
170. Для нейтрализации 20 мл 0,1н. раствора кислоты потребовалось 8 мл раствора NaOH. Сколько граммов NaOH содержит 1 л этого раствора? Ответ: 10 г.
171. К 1 л раствора КОН с концентрацией wKOH=0,1 и с плотностью 1,092 г/см3 прибавили 0,5 л раствора КОН с концентрацией wKOH=0,05 и с плотностью 1,045 г/см3. Объем смеси довели до 2-х литров. Вычислите молярную концентрацию КОН в полученном растворе. Ответ: 1,2 моль/л.
172. На нейтрализацию 31 см3 0,16н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны молярная концентрация эквивалентов H2SO4 в растворе и титр раствора H2SO4? Ответ: 0,023 моль/л; 1,12×10–3 г/мл.
173. Какой объем 0,3н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3.
174. На нейтрализацию 40 мл раствора щелочи израсходовано 25 мл 0,5н. раствора H2SO4. Какова молярная концентрация эквивалентов щелочи в растворе? Какой объем 0,5н. раствора HCl потребовался бы для той же цели? Ответ: 0,3 моль/л; 24 мл.
175. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2н. раствора HCl. Какова молярная концентрация эквивалентов AgNO3 в растворе? Какая масса AgCl выпала в осадок? Ответ: 0,1 моль/л; 1,433 г.
