В каком количестве вещества бензола c6h6 содержится 18 моль атомов углерода

Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
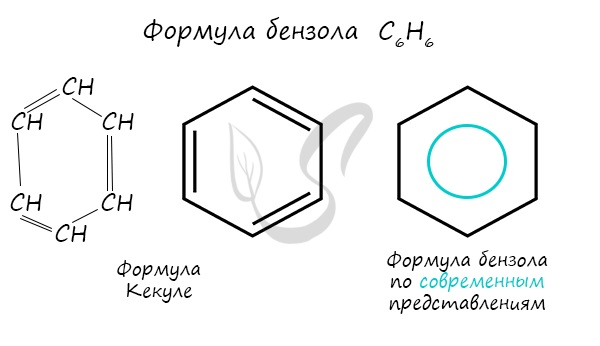
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям,
двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
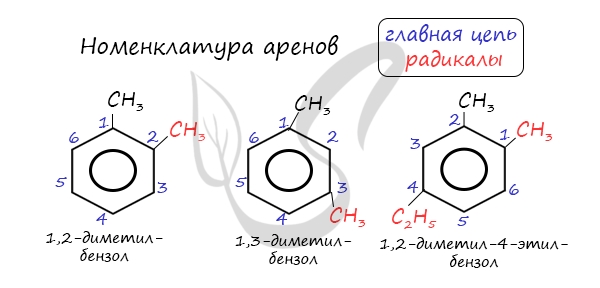
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
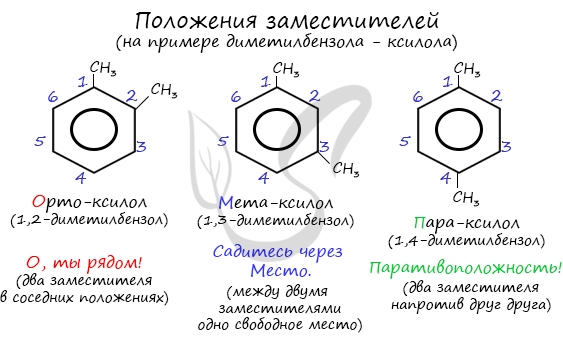
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
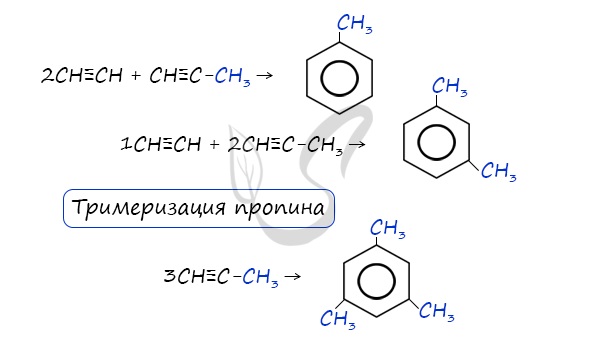
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
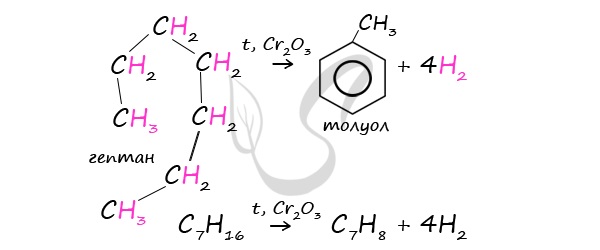
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
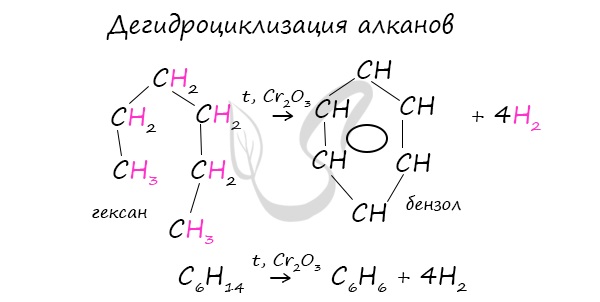
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.

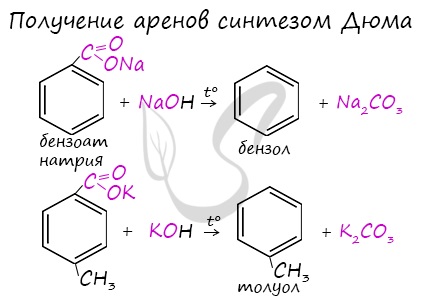
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.

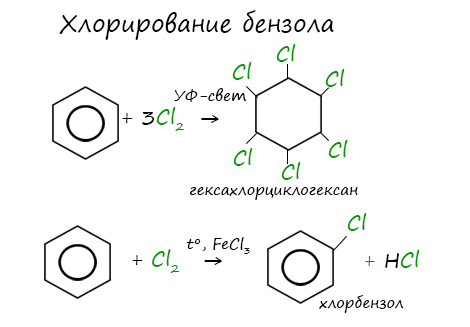
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
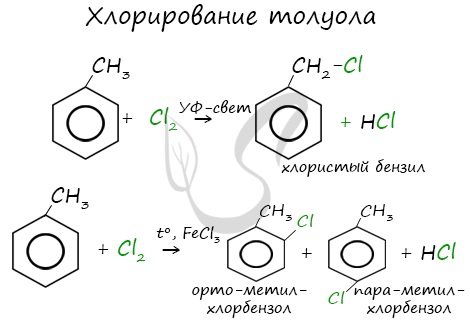
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
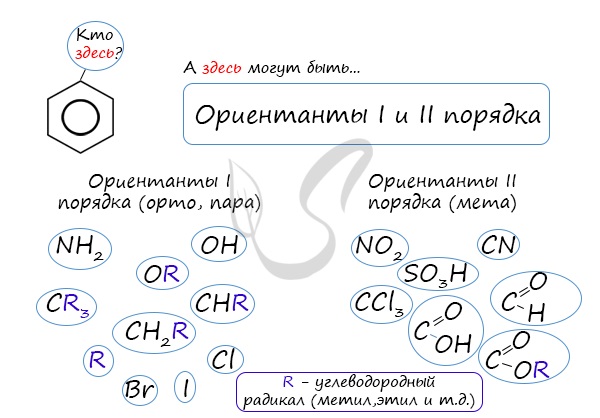
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
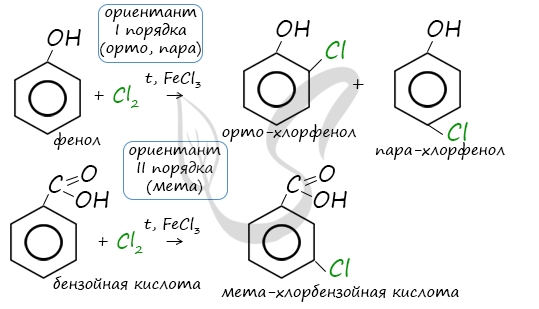
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
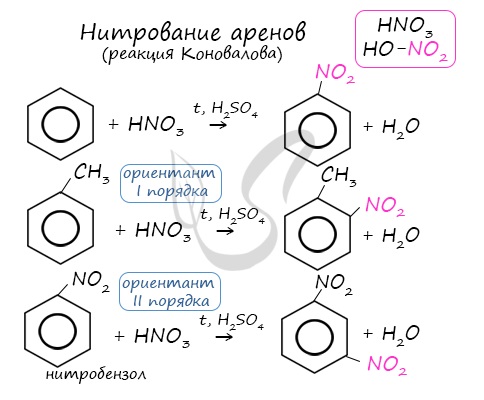
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
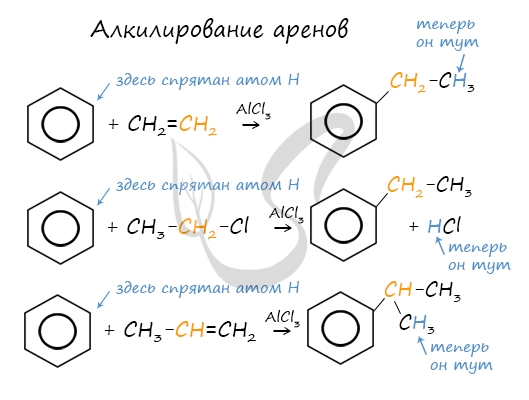
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
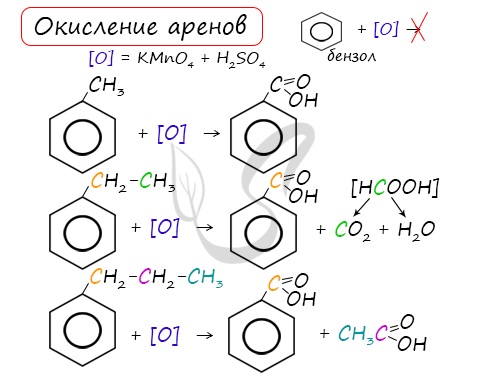
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
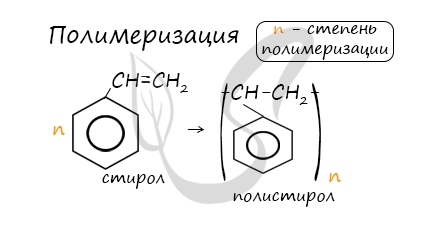
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Друзья! Предлагаю вашему вниманию реальный вариант ЕГЭ по химии-2020, который составил из материалов, выложенных в интернете участниками экзамена, которые после экзаменов смогли записать и запомнить задания.
Обращаю Ваше внимание, что вариант составлен на скорую руку из материалов в интернете. Некоторые формулировки и задания могут быть неточными или не соответствовать формулировкам на экзамене. Это не официальные и не точные материалы. Тем не менее, составить общее представление о прошедшем экзамене они позволяют.
Полный вариант реального ЕГЭ по химии 16 июля 2020 года можно скачать здесь.
1) Cl 2) Sr 3) Se 4) P 5) K
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите два элемента, электронные конфигурации ионов которых соответствуют электронной конфигурации атома криптона.
Из указанных в ряду химических элементов выберите три р-элемента.
Расположите выбранные элементы в порядке уменьшения их валентности в летучих водородных соединениях.
Запишите номера выбранных элементов в нужной последовательности.
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в кислородсодержащих анионах может быть одинаковой.
Запишите в номера выбранных элементов.
Из предложенного перечня выберите два вещества немолекулярного строения, которые имеют ковалентную полярную связь.
1) гидроксид натрия
2) нитрид натрия
3) хлорид бария
4) бромоводород
5) оксид кремния
Запишите в поле ответа номера выбранных соединений.
| Задание 5. | Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. соответствие между формулой соли и типом гидролиза. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) HClO3 Б) AlOH(NO3)2 В) Ba(CH3COO)2 | 1) кислая соль 2) основная соль 3) средняя соль 4) кислота |
Из предложенного перечня выберите два вещества, с каждым из которых реагирует калий.
1) водород
2) хлорид лития
3) вода
4) сульфат натрия
5) натрий
Запишите в поле ответа номера выбранных соединений.
Вещество Х разделили на две пробирки. В первую пробирку добавили гидроксид калия, во вторую добавили раствор слабого электролита Y. В обеих пробирках выпал осадок.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) KF
2) KHCO3
3) NH3·H2O
4) Mg3(PO4) 2
5) Fe2(SO4)3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
| Задание 8. | Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Na2SiO3 Б) CuO В) HCl Г) FeCl3 | 1) CaBr2, CO2(р—р), HNO3 2) NH3, CO, HBr 3) Br2, H2, ZnO 4) LiOH, NaOH, NaHCO3 5) Ba(OH)2, Pb(NO3)2, O2 |
| Задание 9. | Установите соответствие между веществом и продуктами его разложения. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Fe(NO3)3 Б) NaHCO3 В) Fe(NO3)2 Г) NH4NO3 | 1) Fe2O3, NO2, O2 2) Na2CO3, CO2, H2O 3) FeO, NO2, O2 4) N2O, H2O 5) Na2O, CO2, H2O |
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) AgNO3
2) NH3
3) N2
4) N2O
5) Ca(NO3)2
| Задание 11. | Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| A) Этиленгликоль Б) Изопрен В) Триолеат глицерина Г) Дибутиловый эфир | 1) сложные эфиры 2) простые эфиры 3) спирты 4) углеводороды |
Выберите, в каких соединениях только один атом углерода находится в состоянии sp3-гибридизации.
1) толуол
2) стирол
3) фенол
4) этанол
5) этаналь
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите вещества, которые реагируют с водным раствором перманганата калия.
1) толуол
2) ацетилен
3) изобутан
4) бензол
5) метан
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите вещества, с которыми реагирует и бензальдегид, и пропеновая кислота.
1) СuO
2) H2
3) Cu(OH)2
4) HCl
5) Ag
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, с которыми реагирует анилин.
1) аммиак
2) хлорид аммония
3) хлороводород
4) гидроксид натрия
5) хлорэтан
Запишите в поле ответа номера выбранных веществ.
| Задание 16. | Установите соответствие между названием реакции и продуктом, который преимущественно образуется в этой реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
| А) гидратация бутина-1 Б) дегидрохлорирование 2-бромбутана В) гидратация бутина-2 Г) дегидрогалогенирование 2,2-дибромбутана | 1) бутанол-2 2) бутанон 3) пропанол-1 4) бутен-2 5) бутин-1 6) бутин-2 7) пропанол-2 |
| Задание 17. | Установите соответствие между реагирующими веществами и продуктом, который образуется при взаимодействии этих веществ. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
 | 1) пропан 2) бутан 3) этан 4) этен 5) пропен 6) уксусная кислота |
Задана следующая схема превращений веществ:
метан → Х → этаналь → Y → пропилацетат
Определите, какие из указанных веществ являются веществами X и Y.
1) ацетилен
2) бромметан
3) этилен
4) муравьиный альдегид
5) уксусная кислота
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня веществ выберите два, взаимодействие которых с концентрированной серной кислотой является окислительно-восстановительной реакцией.
1) фосфин
2) гидроксид железа (III)
3) оксид меди (II)
4) гидроксид натрия
5) оксид меди (I)
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, на скорость реакции между которыми оказывает влияние давление.
1) оксид меди (II)
2) раствор серной кислоты
3) оксид кальция
4) водород
5) соляная кислота
Запишите в поле ответа номера выбранных веществ.
| Задание 21. | Установите соответствие между схемой реакции и свойством элемента железа, которое он проявляет в этой реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| СХЕМА РЕАКЦИИ | СВОЙСТВО ЖЕЛЕЗА |
| А) FeO + Cl2 + KOH → Fe(OH)3 + KCl Б) Fe2O3 + CO → FeO + CO3 В) FeO → Fe + Fe2O3 | 1) является и окислителем, и восстановителем 2) является окислителем 3) является восстановителем 4) не проявляет окислительно-восстановительных свойств |
| Задание 22. | Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) NaF Б) K2CO3 В) CuSO4 Г) CuBr2 | 1) металл и галоген 2) водород и кислород 3) металл и кислород 4) водород и галоген 5) металл и водород 6) водород и галоген |
| Задание 23. | Установите соответствие между названием соли и средой раствора этой соли. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ СОЛИ | СРЕДА РАСТВОРА |
| А) хлорид цинка Б) сульфат натрия В) нитрит калия Г) фенолят натрия | 1) нейтральная 2) кислая 3) щелочная |
| Задание 24. | Установите соответствие между способом воздействия на систему:
и направлением смещения химического равновесия в результате этого воздействия. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры Б) добавление твердого KCNS В) добавление твердого FeCl3 Г) повышение давления | 1) в сторону прямой реакции 2) в сторону обратной реакции 3) практически не смещается |
| Задание 25. | Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАГЕНТ |
| А) KOH и K2SO3 Б) KClO и HClO3 В) K2Cr2O7 и Br2 Г) NaCl и BaCl2 | 1) серная кислота 2) углекислый газ 3) сульфат бария 4) гидроксид натрия 5) фенолфталеин |
| Задание 26. | Установите соответствие между областью применения и веществом, которое используется в этой области. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ОБЛАСТЬ ПРИМЕНЕНИЯ | ВЕЩЕСТВО |
| А) производство удобрений Б) производство фосфора В) выплавка чугуна | 1) HCl 2) Fe2O3 3) Ca3(PO4)2 4) ZnS |
Определите массу 14 %-ного раствора соли, при добавлении к которому 10 г воды образуется раствор с массовой долей 8%. (Запишите число с точностью до десятых)
Определите количество теплоты (кДж), которое выделится при сгорании 11,2 л угарного газа (при н.у.) в соответствии с термохимическим уравнением:
2CO(г) + O2(г) = 2CO2(г) + 566 кДж
Вычислите массу оксида кремния (IV), который вступит в реакцию со фтором, если в ходе реакции выделилось 11,2 л кислорода (при н.у.).
Уравнение реакции:
SiO2 + 2F2 = SiF4 + O2
Количество вещества кислорода: n(O2) = 11,2/22,4 = 0,5 моль
n(SiO2) = n(O2) = 0,5 моль
m(SiO2) = 0,5·60 = 30 г
Ответ: 30 г.
Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид хрома (VI), гидроксид железа (II), азотная кислота, ацетат серебра (I), оксид бария, сульфат калия.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением бурого газа и образованием соли.
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель, и запишите уравнение этой реакции.
Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + 3H2O
Fe+2 –1e = Fe+3
N+5 + 1e = N+4
Fe(OH)2 (за счет Fe+2) — восстановитель
HNO3 (за счет N+5) — окислитель
Из предложенного перечня веществ выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков.
Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
CH3COOAg + HNO3 = AgNO3 + CH3COOH
CH3COO– + Ag+ + H+ + NO3– = Ag+ + NO3– + CH3COOH
CH3COO– + H+ = CH3COOH
Натрий сожгли в избытке кислорода. Полученное вещество растворили в растворе перманганата калия, подкисленного серной кислотой. Выделившийся газ смешали с пиритом. Полученное твердое вещество поместили в раствор йодоводородной кислоты.
Напишите уравнения четырёх описанных реакций.
2Na + O2 = Na2O2
5Na2O2 + 2KMnO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 5Na2SO4 + 8H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
CH2Br-CH2-CH2-CH3 + KOH → CH2=CH-CH2-CH3+ KBr + H2O
CH2=CH-CH2-CH3 + HBr → CH3-CHBr-CH2-CH3
2CH3-CHBr-CH2-CH3 + 2Na → CH3-CH2-CH(CH3)—CH(CH3)-CH2-CH3 + 2NaBr


Смесь меди и оксида меди (II) с массовой долей атомов меди 96% растворили в избытке концентрированной серной кислоты массой 472 г. При этом наблюдалось выделение газа. Минимальная масса 10%-го раствора NaOH, который может прореагировать с выделившимся газом, равна 200 г. Определите массовую долю соли в растворе, полученном растворением исходной смеси в серной кислоте.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Пусть n(Cu) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди nат.(Cu) = (х+y) моль.
Масса атомов меди: mат.(Cu) = nат.(Сu)·M(Cu) = 64(x + y) г.
Масса чистой меди: m(Cu) = n(Cu)·M(Cu) = 64x г.
Масса оксида меди (II): m(CuO) = n(CuO)·M(CuO) = 80у г.
Масса смеси: mсм = m(Cu) + m(CuO) = (64х + 80у) г
Получаем выражение:
64(x + y)/(64х + 80у) = 0,96
Преобразуя приведённое выше равенство, получаем х = 5у.
Далее протекают реакции:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
CuO + H2SO4 = CuSO4 + H2O
Масса и количество гидроксида натрия:
m(NaOH) = mр-ра(NaOH)·ω(NaOH) = 200·0,1 = 20 г
n(NaOH) = m(NaOH)/M(NaOH) = 20/40 = 0,5 моль
Если количество щелочи минимально, то протекает реакция с образованием кислой соли:
SO2+ NaOH = NaHSO3
По уравнению третьей реакции:
n(SO2) = n(NaOH) = x = 0,5 моль
y = 1/5x = 0,1 моль
Масса чистой меди: m(Cu) = n(Cu)·M(Cu) = 64·0,5 = 32 г.
Масса оксида меди (II): m(CuO) = n(CuO)·M(CuO) = 80·0,1 = 8 г.
Масса диоксида серы: m(SO2) = n(SO2)·M(SO2) = 64·0,5 = 32 г.
Количество и масса сульфата меди (II):
n(CuSO4) = 0,5 + 0,1 = 0,6 моль
m(CuSO4) = n(CuSO4)·M(CuSO4) = 160·0,6 = 96 г.
Масса раствора, полученного растворением исходной смеси в серной кислоте:
mр-ра = m(Cu) + m(CuO) + mр-ра(H2SO4) — m(SO2) = 32 + 8 + 472 — 32 = 480 г
Массовая доля сульфата меди (II) в растворе:
ω(CuSO4) = m(CuSO4)/mр-ра = 96/480 = 0,2 или 20%
Ответ: ω(CuSO4) = 20%
Вещество А содержит 9,3% углерода, 10,85% азота, 24,8% серы, 49,6% кислорода по массе. Известно, что вещество А получают восстановлением вещества В цинком в присутствии серной кислоты.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции получения вещества А восстановлением вещества В (используйте структурные формулы органических веществ)
Пусть формула вещества А CxHyNzStOh
Пусть масса вещества А равна 100 г m(А) = 100 г, тогда:
m(C) = 9,3 г, n(C) = 0,775 моль
m(N) = 10,85 г, n(N) = 0,775 моль
m(S) = 24,8 г, n(S) = 0,775 моль
m(O) = 49,6 г, n(O) = 3,1 моль
m(H) = 5,43 г, n(H) = 5,43 моль
Получаем выражение:
х:y:z:t:h = 0,775:5,43:0,775:0,775:3,1 или
х:y:z:t:h = 1:7:1:1:4
или CH7NSO4
Данной формуле и условию задачи соответствует гидросульфат метиламмония:
[CH3-NH3]HSO4
Вещество В — нитрометан
Реакция получения вещества А из вещества В:
CH3-NO2 + 3Zn + 4H2SO4 → [CH3-NH3]HSO4 + 3ZnSO4 + 2H2O
Ответ: [CH3-NH3]HSO4
